桃PpSGR基因功能鑒定及其對乙烯合成的調控
邵允 張蒙蒙 陳云 王曉菲 董康 劉寧 張郎郎 譚彬 王偉 程鈞 馮建燦


摘? ? 要:【目的】乙烯合成及果肉褪綠是桃果實成熟過程中相伴出現的兩個生理事件。STAY-GREEN(SGR)是參與植物葉片和果實褪綠的重要基因。然而,桃SGR基因在果實成熟及褪綠過程中的功能尚不清晰,旨在初步探究PpSGR基因在桃果實成熟及褪綠過程中的功能。【方法】以秋蜜紅為試驗材料,對PpSGR基因進行克隆,對PpSGR的核苷酸及氨基酸序列進行分析,對不同發育時期桃果肉中PpSGR的轉錄水平進行檢測,并對PpSGR基因調控葉綠素降解及乙烯合成的功能進行研究。【結果】PpSGR編碼區全長為831 bp;該基因編碼的蛋白序列含有1個高度保守的SGR域。PpSGR基因的表達水平隨著果肉逐漸褪綠呈現上升的趨勢。瞬時過表達PpSGR基因后,桃葉片顏色明顯褪綠,并且在300 mmol·L-1 NaCl的鹽脅迫下,過表達PpSGR的葉片褪綠更加明顯。此外,過表達PpSGR后,桃苗乙烯合成的限速基因PpACS1、PpACS4及PpACS6均表達上調,且內源乙烯釋放量顯著增多。【結論】對PpSGR的基因功能進行鑒定和研究,并分析了其對乙烯的調控作用,為進一步解析桃果實成熟及果肉褪綠提供了新的思路,也為不同成熟期桃品種的選育提供了理論基礎。
關鍵詞:桃;STAY-GREEN (SGR);褪綠基因;葉綠素降解;乙烯
中圖分類號:S662.1 文獻標志碼:A 文章編號:1009-9980(2023)12-2513-11
收稿日期:2023-07-28 接受日期:2023-11-02
基金項目:河南省杰出外籍科學家工作室(GZS2020007);國家河南省聯合項目(U1804114)
作者簡介:邵允,女,在讀碩士研究生,研究方向為果樹分子生物學。E-mail:15937171226@163.com
*通信作者 Author for correspondence. E-mail:jcheng2007@163.com;E-mail:jcfeng@henau.edu.cn
Function identification of PpSGR gene and its regulation of ethylene synthesis in peach
SHAO Yun, ZHANG Mengmeng, CHEN Yun, WANG Xiaofei, DONG Kang, LIU Ning, ZHANG Langlang, TAN Bin, WANG Wei, CHENG Jun*, FENG Jiancan*
(College of Horticulture, Henan Agricultural University, Zhengzhou 450002, Henan, China)
Abstract: 【Objective】 Ethylene synthesis and disappearance of peel green color are two physiological events associated with fruit ripening of peach. STAY-GREEN (SGR) is a crucial gene that promotes disappearance of leaf and fruit green color in the plant kingdom. In various plant species, SGR genes exhibit similar functions in regulating chlorophyll. Peach (Prunus persica) is a significant fruit globally. However, the function of the PpSGR gene in the peach genome has not been identified, and its potential impact on green color disappearance and ripening of peach fruit remains unclear. This study aims to identify the SGR gene in the peach genome, analyze the expression level of the PpSGR gene in different fruit maturity stages, and preliminarily investigate the function of the PpSGR gene. 【Methods】The nucleotide sequences of the PpSGR gene were cloned from the Qiumihong cultivar. Bioinformatics analysis was conducted to analyze the gene structure of PpSGR in peach, the secondary and tertiary structure of the PpSGR protein was predict, the amino acid sequences of SGR in different species were compared, and a phylogenetic tree was constructed. Subsequently, the transcriptional level of the PpSGR gene in peach fruits at different maturity stages was analyzed using Quantitative Real-time PCR (qRT-PCR). The function of the PpSGR gene in chlorophyll degradation was preliminarily verified by transient overexpression in peach seedlings. Numerous studies have reported that the SGR gene can promote chlorophyll degradation under salt stress, leading to leaf yellowing. To verify the function of SGR under salt stress, the Fv/Fm values were measured and analyzed using a chlorophyll fluorescence analyzer after dark treatment of the whole peach seedlings transiently infected with the PpSGR gene. Additionally, there is evidence suggesting that ethylene can promote the expression of the SGR gene, but whether the SGR gene has a direct effect on ethylene synthesis remains to be studied. Therefore, we measured ethylene production and the transcriptional level of PpACSs genes involved in ethylene synthesis in the peach seedlings transiently overexpressing the PpSGR gene. 【Results】 The results of the bioinformatics analysis revealed that the length of the PpSGR gene sequencewas 1115 bp, consisting of 4 exons and 3 introns. The coding region of PpSGR spanned a total length of 831 bp, encoding 277 amino acids. Comparative analysis of SGR proteins from different species demonstrated that the PpSGR protein shared high homology with SGR proteins from other species. The middle region of the SGR protein contained a highly conserved SGR domain, while the N-terminal region contained a conserved chloroplast transit peptide. The C-terminal region of the SGR protein exhibited variability across different species. The amino acid sequence similarities between PpSGR and MdSGR, FvSGR or CsSGR were found to be 77.63%, 69.83% and 63.05%, respectively. A phylogenetic tree was constructed using amino acid sequences of SGR proteins from 13 different plant species, revealing that the PpSGR protein from peach was closely related to apples and strawberries, which belonged to the same Rosaceae family. The predicted tertiary structure of the PpSGR protein consisted mainly of α-helices and random graph curls, which was consistent with the predicted secondary structure. qRT-PCR results indicated that the transcription level of the PpSGR gene was lower during the early stage of peach fruit development when the flesh was still green. As the fruit matured gradually, the flesh turned green, and the expression level of PpSGR increased continuously. At 120 days after the full-bloom stage, the expression of PpSGR increased rapidly, reaching a level of 16 times higher than that at 80 days after the full-bloom stage, with the highest expression observed at 180 days after the full-bloom stage. This suggested that the expression level of the PpSGR gene gradually increased with the decolorization of peach fruit. Phenotypic analysis of PpSGR transgenic plants revealed that the leaves of transient PpSGR plants were light green, whereas the control plants had dark green leaves. This suggested that transient overexpression of the PpSGR gene led to chlorosis in peach seedlings. Under salt stress conditions (300 mmol·L-1 NaCl), the leaves of peach plants transiently overexpressing PpSGR exhibited a slower rate of yellowing, compared to control plants. The Fv/Fm value of the leaves in PpSGR-overexpressing plants was significantly lower than that of the control plants, indicating that the PpSGR gene may play an important role in leaf yellowing induced by the abiotic stress. Furthermore, the expression levels of genes involved in ethylene production were analyzed in peach seedlings transiently overexpressing PpSGR. The results demonstrated that the ethylene synthesis genes PpACS1, PpACS4 and PpACS6 were significantly induced and up-regulated in these seedlings. The expression of PpACS1 in peach seedlings with PpSGR overexpression was more than 32 times higher than that in control seedlings. Additionally, the ethylene production of peach seedlings with PpSGR overexpression showed a gradual increase. 【Conclusion】 Based on the aforementioned findings, it can be concluded that the PpSGR gene plays a role in promoting chlorosis in peach leaves. Moreover, our preliminary analysis suggests that PpSGR may enhance the function of ethylene synthesis in peach seedlings. This finding holds great significance for understanding the molecular mechanism of SGR in regulating ethylene synthesis. Additionally, it also provides some theoretical references for SGR gene function research, peach fruit ripening and post-harvest preservation.
Key words: Peach; STAY-GREEN (SGR); Degreening gene; Chlorophyll degradation; Ethylene
葉綠素降解是葉片衰老、果實成熟進程中發生的一系列重要的生化反應,由6種葉綠素代謝酶(chlorophyll catabolic enzymes,CCE)共同催化完成[1]。除了這6種CCE之外,STAY GREEN(SGR)在葉綠素降解過程中也發揮著非常重要的作用。SGR可以和6個CCE、光系統Ⅱ形成動態的蛋白復合體,從而形成葉綠素代謝通道,最大程度上減少代謝中間產物對細胞的毒害。有研究表明,SGR既不具有CCE活性,也不能直接結合葉綠素,這表明SGR可能不是一種直接參與葉綠素代謝的酶[2]。SGR參與葉綠素降解的功能在大豆[3]、水稻[4]、柑橘[5]、擬南芥[6]、甘藍型油菜[7]等多個物種中都得到了驗證。例如,Wang等[3]對大豆顏色變化的研究表明,GmSGR在控制種子黃化方面具有重要作用;Peng等[4]研究發現,敲除水稻OsSGR后植株能保持綠色;Zhu等[5]研究顯示,CsSGRa能使煙草葉片中葉綠素含量顯著降低,而突變CsSGRa后,棕橙果實和葉片中葉綠素的降解受到抑制,葉綠素含量顯著增加。同樣,在擬南芥中,AtSGR1被報道具有誘導葉綠素和葉綠素結合蛋白降解的作用,AtSGR1過表達后誘導擬南芥葉片逐漸褪綠[8]。此外,在番茄、辣椒、香蕉等植物中,發現SGR1同源基因突變后可延緩葉綠素的降解速度[9-12]。SGR基因具有響應非生物脅迫的功能,在鹽脅迫下會表現出早期衰老和葉片褪綠速度加快的現象,而sgr突變體在非生物脅迫條件下表現出不褪綠的現象[9-10,13]。許多研究表明,在植物發育和衰老過程中葉綠素的分解代謝受到遺傳程序的高度調控,因此,在非生物脅迫下對SGR的基因功能進行研究,對進一步闡明葉綠素降解的未知調節機制也具有重要作用。
不同物種中SGR基因在調控葉綠素方面表現出的類似現象,可能是由于不同物種中SGR蛋白結構較為保守(在其N-端含有一個葉綠體的信號肽,C端存在一個多變區域,兩者之間存在一個高度保守的SGR保守域,且在C端多變區域中含有一個保守的富含半胱氨酸的基序)。
桃(Prunus persica)是廣受消費者喜愛的重要水果之一。PpSGR基因在桃中的功能尚未鑒定,其對桃果實成熟可能存在的影響也未得到深入研究。筆者在本研究中對其編碼的蛋白結構特征進行了生物信息學分析,并對PpSGR的基因功能進行鑒定和研究,這對桃成熟及采后保鮮等方面的研究具有一定的啟發意義,也為進一步研究PpSGR基因在桃中的生物學功能奠定理論基礎。
1 材料和方法
1.1 試驗材料
以新疆毛桃實生苗為試驗材料。將毛桃種子置于4 ℃低溫貯存1個月,溫水浸種后去除1/3種皮進行催芽5~7 d,將種胚單獨種植在營養缽中,放置于溫度為25 ℃、光周期為長日照條件(16 h光照/8 h黑暗)、光照為白光(140 μmol·m-2·s-1)的溫室培養至幼苗,待試驗使用[14]。
1.2 桃PpSGR過表達載體的構建及轉化
根據PpSGR目的基因編碼區(CDS)的全長序列,結合pSAK277載體上的EcoRⅠ和XhoⅠ為酶切位點,進行同源重組引物的設計,由上海生工公司進行引物的合成。以秋蜜紅莖尖的cDNA為模板,利用合成的全長引物(pSAK277-PpSGR-F:AAAGAATTCGGTACCATGGGTACTTTGACTGCTGCTTC;pSAK277-PpSGR-R:TTTGTAATCCTCGAGGTTTGTTTCTTGGGTTTGGC)擴出PpSGR目的基因CDS區的全長序列,用限制性內切酶EcoRⅠ和XhoⅠ對空載體進行雙酶切以獲得線性化載體,于水浴鍋中37 ℃酶切2~3 h。待PCR擴增反應及酶切反應結束后,用200 V的電壓,經1.0%瓊脂糖凝膠電泳檢測,切下帶有目的基因條帶的凝膠,利用DNA凝膠回收試劑盒(莊盟生物)進行目的DNA片段的回收及純化,將所得到的DNA溶液進行濃度及質量檢測后用于后續的載體連接或置于-20 ℃冰箱中保存備用。利用SE無縫克隆和組裝試劑盒SE Seamless Cloning and Assembly Kit(ZC231,北京莊盟生物)對PpSGR基因的純化產物與線性化載體進行重組連接反應,以構建35S啟動子驅動的pSAK277-PpSGR的過表達載體。步驟為:在冰上進行無縫克隆的連接反應體系的配制,輕輕將其混勻后,放于PCR儀上,37 ℃條件下反應30 min。
將構建好的載體質粒使用凍融法轉入根癌農桿菌菌株GV3101中,利用真空滲透的方法瞬時侵染桃幼苗。
1.3 葉片顏色觀察及葉綠素含量分析
將GV3101::SAK277-PpSGR基因侵染桃苗后,對整株植物進行黑暗處理,黑暗孵育后對葉片進行取樣,使用葉綠素熒光分析儀(捷克PSI Flu)進行分析。如前所述[15]進行鹽脅迫分析,將3周齡植物的離體葉片背面朝上漂浮在300 mmol·L-1 NaCl的3 mmol·L-1 MES 緩沖液(pH 5.8)中孵育數天。
1.4 總RNA的提取、cDNA的合成和實時定量PCR
提取轉PpSGR基因秋蜜紅桃的葉片總RNA,反轉錄第一鏈cDNA。實時定量PCR鑒定乙烯合成相關基因PpACS1、PpACS4、PpACS5和PpACS6的表達水平。利用SPSS Statistics 22對數據進行方差分析,用GraphPad Prism 8軟件進行作圖。按照DNase Ⅰ(TaKaRa,Dalian,China)試劑盒步驟除去基因組DNA污染。根據SYBR? Primescript miRNA RT-PCR Kit(TaKaRa,Dalian,China)試劑盒說明書進行第一鏈cDNA的合成。定量RT-PCR反應體系為20 μL,含有1 × ROX參比染料,10 μL 2 × SYBR預混物Ex Taq Ⅱ(TaKaRa),每個引物濃度0.4 μmol·L-1,模板cDNA 100 ng。所有分析均采用3個生物學重復,qPCR所用引物見表1。
1.5 葉綠素含量的測定
稱取0.3 g左右的桃葉片放入干凈無水的研缽內,加入少量的碳酸鈣粉末和3 mL 95%乙醇,使用干凈的研磨棒進行充分研磨,再向其中加入10 mL 95%乙醇,繼續研磨至組織變白,放置在避光條件下,靜置5 min后,使用濾紙將研磨液過濾至25 mL的棕色容量瓶中,并用少量的95%乙醇沖洗濾紙定容至25 mL。以95%乙醇作為空白對照,分別在波長665 nm、649 nm下測定提取液的吸光度[16-17]。
根據以下公式計算葉綠素含量:
C葉綠素a/(mg·L-1)=13.95×A665-6.88×A649;
C葉綠素b/(mg·L-1)=24.96×A649-7.32×A665;
w(葉綠素a)/(mg·g-1)=C葉綠素a×V×N/W×0.001;
w(葉綠素b)/(mg·g-1)=C葉綠素b×V×N/W×0.001;
w(總葉綠素)/(mg·g-1)=w(葉綠素a)+w(葉綠素b)。
式中,V為提取液體積,N為稀釋倍數,W為鮮質量(g)。
1.6 乙烯釋放量的測定
取處理后生長良好的桃幼苗5 g;將上述材料分別放入100 mL 色譜瓶中,使用氣相色譜分析儀(島津GC-2010 Plus)進行乙烯測定,每個處理3次重復。色譜條件:WBI為110 ℃,柱溫 50 ℃,FID為200 ℃,氫氣流速為50 mL·min-1,進樣量:1000 μL,運行時間5 min。
乙烯釋放量/(ng·kg-1·s-1)=[乙烯質量濃度(ng·mL-1)×容器體積(mL)]/[樣品質量(g)×密封時間(s)]。
1.7 生物信息學分析
利用Phytozome網站(https://phytozome.jgi.doe.gov/pz/portal.html)獲得PpSGR和PpSGRL序列信息,同時根據文獻下載其他物種中的同源序列。通過DNAMAN獲得不同物種中SGR氨基酸序列比對圖,并結合MEGA 7.0的Clustal W進行聚類分析。使用ProtParam(https://web.expasy.org/protparam/)在線分析,對PpSGR蛋白的分子質量、等電點、氨基酸數目、氨基酸組分、脂肪指數、親水性等進行分析。用SOPMA(https://npsa-prabi.ibcp.fr/)在線軟件對PpSGR蛋白的二級結構進行預測;使用Phyre2軟件對PpSGR蛋白的三級結構進行預測。
2 結果與分析
2.1 PpSGR基因的序列特征
PpSGR基因組序列全長1115 bp,包含4個外顯子和3個內含子。編碼區全長831 bp,編碼277個氨基酸。通過Protparam進行預測,等電點pI為8.05,屬于堿性蛋白,相對分子質量約為31.18 ku。由20種氨基酸組成,帶負電荷氨基酸殘基數量為30,帶正電荷氨基酸殘基數量為32;不穩定系數為47.54,屬于不穩定蛋白;脂肪系數為77.04,總平均親水性為-0.386,屬親水蛋白(+值為疏水蛋白,-值為親水蛋白)。
不同物種SGR氨基酸序列比對的結果顯示,PpSGR蛋白與其他物種中SGR蛋白具有較高的同源率,且都含有保守的SGR保守域(SGR domain),N端的葉綠體信號肽(chloroplast transit peptide)和C端多變區域(variable C-terminal region)(圖1)。其中PpSGR與蘋果MdSGR蛋白的同源率最高,為77.89%,與草莓FvSGR蛋白的同源率為70.41%,與柑橘CsSGR蛋白和楊樹PtSGR蛋白的同源率為64.29%,系統進化樹的結果顯示,桃PpSGR蛋白與同屬薔薇科的蘋果、草莓的親緣關系最近(圖2)。
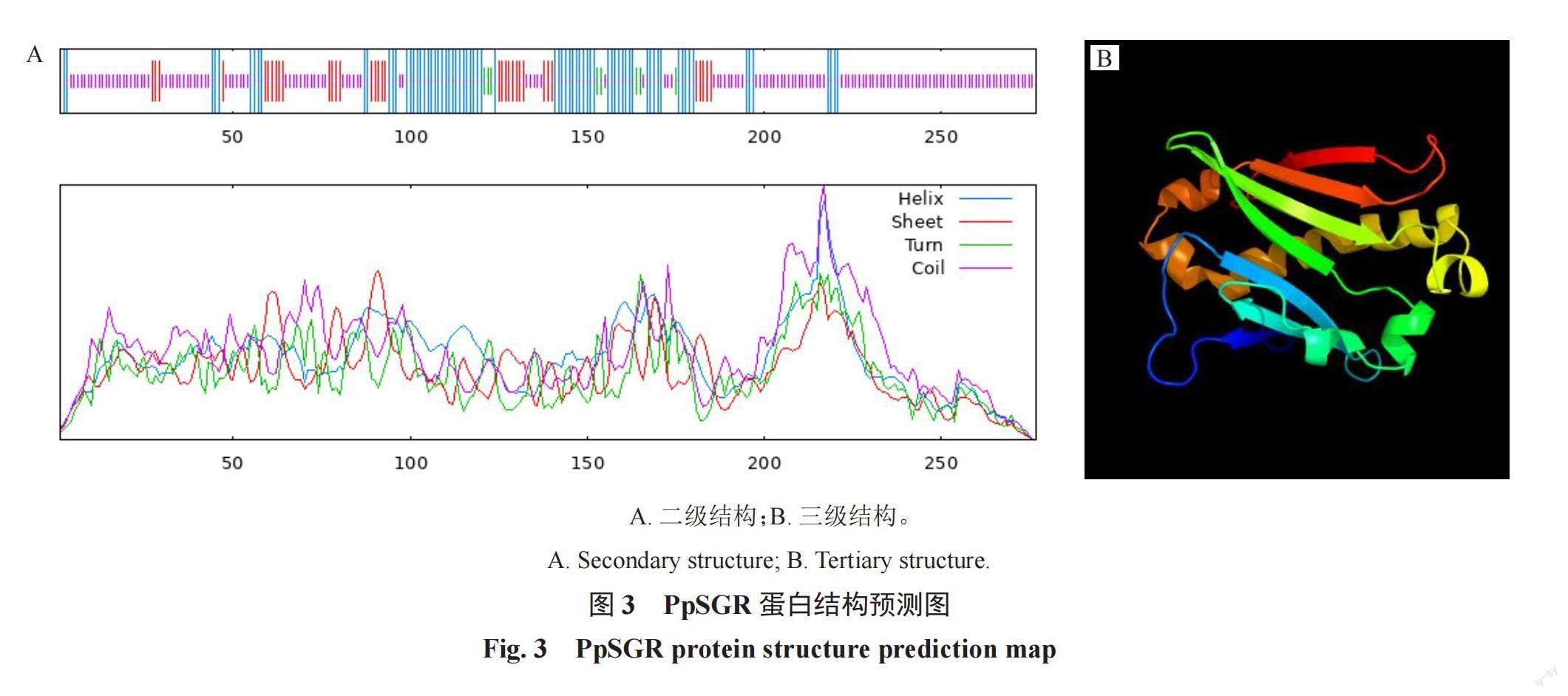
對PpSGR蛋白的二級結構和三級結構進行預測,蛋白質的多肽鏈通過折疊、螺旋和卷曲等二級結構形成比較穩定的空間結構,利用Sopma網站分析桃PpSGR的二級結構(圖3-A),發現多個氨基酸參與α-螺旋、無規則卷曲和延伸鏈等二級結構的形成,其中α-螺旋占比27.44%、延伸鏈占比12.64%、無規則卷曲占比57.04%(表2)。采用在線軟件Phyre2對PpSGR蛋白三級結構進行預測的結果(圖3-B)顯示,PpSGR蛋白的三級結構主要由α-螺旋和無規則圖卷曲構成,與二級結構預測結果一致。
2.2 PpSGR在不同發育時期桃果實中的表達分析
葉綠素降解主要發生在果實成熟及葉片衰老的過程中。因此,筆者選用花后20 d、50 d、80 d、120 d、160 d、180 d,共6個時間點的桃果實,進行PpSGR轉錄水平分析。qRT-PCR分析的結果(圖4)顯示,在果實發育的前期果肉呈現明顯綠色時,PpSGR轉錄水平較低。隨著果實逐步成熟,果肉褪綠,表達量不斷升高。在花后120 d,PpSGR的表達量快速上升,達到花后80 d的16倍,并在180 d達到最高。基于以上結果,推測PpSGR基因可能是調控桃果實褪綠的重要基因。
2.3 瞬時轉化桃幼苗驗證PpSGR的功能
為了驗證PpSGR基因的功能,利用桃實生幼苗瞬時轉化法對PpSGR基因的功能進行初步的驗證。半定量結果顯示,瞬時過表達的材料中PpSGR的轉錄水平明顯上升(圖5-A)。為進一步確認PpSGR瞬時轉化的效果,隨機選取7個單株,分別進行定量檢測。結果顯示,在每一個單株中都實現了PpSGR的過表達(圖5-B)。對轉基因植株表型分析,發現瞬轉PpSGR植株葉片顏色呈現淡綠色,而對照植株呈現深綠色(圖6-A),PpSGR植株葉片葉綠素含量較低而對照植株葉片葉綠素含量較高(圖6-B)。上述結果表明,PpSGR具有促進葉綠素降解,進而導致桃葉片褪綠的功能。
2.4 鹽脅迫下PpSGR促進葉片黃化
有研究表明,過表達SGR基因的植物植株葉片在非生物脅迫條件下會表現出早期衰老葉片褪綠的現象[9-10]。筆者在本研究中的結果顯示,在300 mmol·L-1 NaCl的鹽脅迫條件下,與空載相比,轉PpSGR基因的桃葉片在鹽處理5 d后出現明顯的黃化表型(圖7-A),且轉PpSGR的桃葉片隨著脅迫處理時間的延長,PSⅡ原初光能轉化效率(Fv/Fm值)顯著降低(圖7-B)。
2.5 PpSGR基因對乙烯釋放量的影響
乙烯是促進果實成熟、葉片衰老的重要內源激素。因此,推測瞬轉PpSGR促進桃葉片褪綠的過程可能會對乙烯合成產生影響。乙烯合成酶(ACS)是乙烯合成途徑中的關鍵酶,ACS基因家族是乙烯合成途徑中的重要基因家族,它們編碼乙烯合成酶,參與乙烯的生物合成。前人研究顯示桃中共有6個ACS基因[18-19]。筆者在本研究中對轉PpSGR桃幼苗中乙烯合成相關基因進行了定量分析。半定量和定量結果(圖8)顯示,除了ACS2和ACS3未檢出轉錄水平外,乙烯合成基因PpACS1、PpACS4和PpACS6在轉PpSGR桃幼苗中被顯著誘導上調表達,其中轉PpSGR桃幼苗中PpACS1表達量是對照的32倍以上;PpACS5表達量在轉PpSGR桃幼苗中顯著下調。
為確認PpSGR對桃苗乙烯合成的調控,設計了一個乙烯含量測量的容器,進行桃幼苗乙烯釋放量的測定(圖8-B)。結果顯示,瞬轉PpSGR的桃苗,其乙烯釋放量呈現逐漸上升的趨勢。在侵染4 d和6 d時,試驗組與對照組乙烯釋放量達到極顯著差異水平。該結果表明,過表達PpSGR具有促進桃幼苗乙烯合成的功能。
3 討 論
葉綠素是存在于類囊體中的一種色素蛋白,也是綠色植物吸收光能的重要物質,大量分布于植物的葉片和莖中[20-21]。植物綠色組織褪綠是植物在成熟和衰老過程中的葉綠素發生降解而引起的,例如果實成熟時果皮顏色變化及葉片老化黃化等[22-23]。在柑橘成熟過程中,果實外表皮的葉綠素發生降解,表皮變黃[24]。
乙烯對葉綠素的降解有一定的影響[25]。乙烯釋放量增加會促進果實的成熟,導致葉綠素降解,如:成熟的葡萄果實會釋放大量乙烯,引起葡萄穗梗中的葉綠素含量明顯降低,并導致穗梗發生褐化[26],其中使得調控葉綠素降解速率的關鍵基因,如SGR1等的表達量明顯升高[27],暗示著乙烯與SGR1基因之間可能存在著調控關系。此外,有研究表明,乙烯對SGR基因的表達也具有促進作用。在擬南芥中乙烯可以迅速誘導AtSGR1的表達[28];在豆科植物中間錦雞兒中乙烯能通過誘導CiNAC1基因上調促進葉片衰老,進而促進葉綠素降解相關基因SGR1、SGR2的表達量升高[29]。Shimoda等[30]報道了STAY-GREEN(SGR),也稱為NON-YELLOWING(NYE),Wei等[31]從高羊茅中分離得到FaNYE1,與大麥中HvSGR具有較高的同源率,在自然老化和黑暗條件下FaNYE1誘導表達,FaNYE1蛋白含量與植株中的葉綠素含量成反比,過表達FaNYE1會加速葉綠素的降解。SGR在植物葉綠素降解過程具有非常重要的作用。有研究者在擬南芥中發現SGRs編碼脫鎂螯合酶(MCS),能嵌入到Chl-蛋白酶復合體中提取Mg2+,具有酶的活性,從而對植物葉綠素降解具有重要調控作用[8,32]。目前,已有大量研究對SGR基因的褪綠功能進行驗證。例如,當萊茵衣藻CrSGR在擬南芥細胞中過表達時,擬南芥葉片中葉綠素含量下降,證實了SGR基因在葉綠體中具有解鎂活性,從而使得擬南芥葉片褪綠表現黃化[32];Sato等[33]在水稻和豌豆中找到了孟德爾的綠子葉突變體,即SGR,它能減緩在暗條件下對葉綠素的分解,結果表明,SGR參與葉綠素降解主要是通過葉綠素降解酶基因CNYC1/NOL、PAO實現的。Sakuraba等[15]發現在鹽脅迫下擬南芥SGR1和SGRL可在衰老前快速降解葉綠素。筆者的研究結果表明,隨著果實成熟PpSGR基因表達量逐漸升高,過表達PpSGR基因后桃葉片出現褪綠表型,并且在鹽脅迫條件下,PpSGR促進了葉片黃化。上述結果證實了PpSGR具有促進桃葉片褪綠的功能。
在桃果實成熟過程中會產生大量乙烯,同時果皮和果肉褪綠也相伴發生。前人的大量研究顯示,乙烯可以上調SGR1表達促進褪綠發生[27-28]。但也有研究指出,在番茄中沉默SlSGR1能通過改變乙烯相關基因的表達進而延長果實貨架期。這意味著SGR1可能具有反饋調節乙烯合成或乙烯信號通路的功能[34-35]。乙烯合成酶基因家族成員在乙烯的生物合成和信號傳遞過程中發揮重要功能,如Zeng等[19]的結果表明,PpACS1在調控油桃成熟階段的乙烯產量方面發揮著關鍵作用。本研究中,過表達PpSGR后,乙烯合成關鍵基因ACS表達量也隨之變化,除了ACS2和ACS3未檢出轉錄水平外,乙烯合成基因PpACS1、PpACS4和PpACS6在轉PpSGR桃幼苗中均顯著誘導上調表達,PpACS5表達量在轉PpSGR桃幼苗中卻顯著下調。這與桃果實成熟后乙烯合成相關基因的表達量變化類似,筆者的結果表明,轉PpSGR的桃苗中PpACS1的表達量超出對照32倍。乙烯含量測定結果顯示,在過表達PpSGR后,桃幼苗乙烯的釋放量顯著增加。上述結果表明SGR可能具有促進乙烯合成的功能。
SGR除了具有酶的活性,另外也有研究指出,SGRs蛋白還可以通過與LHCII互作或招募主要的Chl降解酶來實現調控過程[36]。也正是由于SGR在葉綠素降解中充當的角色尚不夠清晰,因此,進一步解析SGR是如何調控ACS基因的表達從而影響乙烯的合成具有重要意義,這將加深對SGR在葉綠素降解以外的生理過程中潛在作用的理解。
4 結 論
本研究表明,PpSGR基因隨著果實成熟轉錄水平逐漸上升;瞬時過表達結果表明,PpSGR具有促進葉片褪綠的功能。此外,發現過表達PpSGR后,桃苗乙烯合成限速基因PpACS1的表達顯著上調32倍,且內源乙烯釋放量顯著增多。基于本研究的結果,初步推測PpSGR具有促進桃幼苗乙烯合成的功能,這對桃果實成熟以及果實采后保鮮等方面的研究具有一定的啟發意義,也為SGR基因功能研究提供了一定的理論參考。
參考文獻 References:
[1] SAKURABA Y,PARK S Y,KIM Y S,WANG S H,YOO S C,H?RTENSTEINER S,PAEK N C. Arabidopsis STAY-GREEN2 is a negative regulator of chlorophyll degradation during leaf senescence[J]. Molecular Plant,2014,7(8):1288-1302.
[2] SAKURABA Y,PARK S Y,PAEK N C. The divergent roles of STAYGREEN (SGR) homologs in chlorophyll degradation[J]. Molecules and Cells,2015,38(5):390-395.
[3] WANG C,GAO L E,LI R Z,WANG Y E,LIU Y Y,ZHANG X,XIE H. High-throughput sequencing reveals the molecular mechanisms determining the stay-green characteristic in soybeans[J]. Journal of Biosciences,2020,45:103.
[4] PENG Y Y,LIAO L L,LIU S,NIE M M,LI J A,ZHANG L D,MA J F,CHEN Z C. Magnesium deficiency triggers SGR-mediated chlorophyll degradation for magnesium remobilization[J]. Plant Physiology,2019,181(1):262-275.
[5] ZHU K J,ZHENG X J,YE J L,HUANG Y,CHEN H Y,MEI X H,XIE Z Z,CAO L X,ZENG Y L,LARKIN R M,XU Q,PEREZ-ROMAN E,TAL?N M,ZUMAJO-CARDONA C,WURTZEL E T,DENG X X. Regulation of carotenoid and chlorophyll pools in hesperidia,anatomically unique fruits found only in Citrus[J]. Plant Physiology,2021,187(2):829-845.
[6] ONO K,KIMURA M,MATSUURA H,TANAKA A,ITO H. Jasmonate production through chlorophyll a degradation by Stay-Green in Arabidopsis thaliana[J]. Journal of Plant Physiology,2019,238:53-62.
[7] 唐玉鳳,姚敏,何昕,官梅,劉忠松,官春云,錢論文. 甘藍型油菜SGR基因家族的全基因組鑒定與功能分析[J]. 作物學報,2023,49(7):1829-1842.
TANG Yufeng,YAO Min,HE Xin,GUAN Mei,LIU Zhongsong,GUAN Chunyun,QIAN Lunwen. Genome-wide identification and functional analysis of SGR gene family in Brassica napus L.[J]. Acta Agronomica Sinica,2023,49(7):1829-1842.
[8] SHIMODA Y,ITO H,TANAKA A. Arabidopsis STAY-GREEN,Mendels green cotyledon gene,encodes magnesium-dechelatase[J]. The Plant Cell,2016,28(9):2147-2160.
[9] REN G D,AN K,LIAO Y,ZHOU X,CAO Y J,ZHAO H F,GE X C,KUAI B K. Identification of a novel chloroplast protein AtNYE1 regulating chlorophyll degradation during leaf senescence in Arabidopsis[J]. Plant Physiology,2007,144(3):1429-1441.
[10] PARK S Y,YU J W,PARK J S,LI J J,YOO S C,LEE N Y,LEE S K,JEONG S W,SEO H S,KOH H J,JEON J S,PARK Y I,PAEK N C. The senescence-induced staygreen protein regulates chlorophyll degradation[J]. The Plant Cell,2007,19(5):1649-1664.
[11] BARRY C S,MCQUINN R P,CHUNG M Y,BESUDEN A,GIOVANNONI J J. Amino acid substitutions in homologs of the STAY-GREEN protein are responsible for the green-flesh and chlorophyll retainer mutations of tomato and pepper[J]. Plant Physiology,2008,147(1):179-187.
[12] YANG X T,ZHANG Z Q,JOYCE D,HUANG X M,XU L Y,PANG X Q. Characterization of chlorophyll degradation in banana and plantain during ripening at high temperature[J]. Food Chemistry,2009,114(2):383-390.
[13] SAKURABA Y,LEE S H,KIM Y S,PARK O K,H?RTENSTEINER S,PAEK N C. Delayed degradation of chlorophylls and photosynthetic proteins in Arabidopsis autophagy mutants during stress-induced leaf yellowing[J]. Journal of Experimental Botany,2014,65(14):3915-3925.
[14] 蔣亞君. 桃PpIDD4、PpIDD12和PpIDD13參與DELLA依賴的赤霉素合成反饋調控及PpIDD11調控雌蕊柱頭伸長的功能[D]. 鄭州:河南農業大學,2022.
JIANG Yajun. PpIDD4,PpIDD12 and PpIDD13 are involved in DELLA-dependent feedback regulation of gibberellin biosynthesis and PpIDD11 regulates pistil stigma elongation in peach[D]. Zhengzhou:Henan Agricultural University,2022.
[15] SAKURABA Y,KIM D,KIM Y S,H?RTENSTEINER S,PAEK N C. Arabidopsis STAYGREEN-LIKE (SGRL) promotes abiotic stress-induced leaf yellowing during vegetative growth[J]. FEBS Letters,2014,588(21):3830-3837.
[16] 項倩,吳磊,徐若涵,楊再強. 不同溫度下染病番茄葉片SPAD和葉綠素含量的相關性[J]. 北方園藝,2022(18):8-15.
XIANG Qian,WU Lei,XU Ruohan,YANG Zaiqiang. Correlation between SPAD and chlorophyll content in infected tomato leaves at different temperatures[J]. Northern Horticulture,2022(18):8-15.
[17] 張憲政. 植物葉綠素含量測定:丙酮乙醇混合液法[J]. 遼寧農業科學,1986(3):26-28.
ZHANG Xianzheng. Determination of plant chlorophyll content by acetone ethanol mixed solution[J]. Liaoning Agricultural Science,1986(3):26-28.
[18] 陳星星,張斌斌,郭紹雷,馬瑞娟,姜衛兵. 不同肉質型桃果實成熟過程中乙烯生物合成相關基因的表達差異[J]. 南京農業大學學報,2020,43(4):637-644.
CHEN Xingxing,ZHANG Binbin,GUO Shaolei,MA Ruijuan,JIANG Weibing. The expression differences of genes related to ethylene biosynthesis in different fleshy peach fruits during ripening[J]. Journal of Nanjing Agricultural University,2020,43(4):637-644.
[19] ZENG W F,PAN L,LIU H,NIU L,LU Z H,CUI G C,WANG Z Q. Characterization of 1-aminocyclopropane-1-carboxylic acid synthase (ACS) genes during nectarine fruit development and ripening[J]. Tree Genetics & Genomes,2015,11(2):18.
[20] ZHU X Y,CHEN J Y,QIU K,KUAI B K. Phytohormone and light regulation of chlorophyll degradation[J]. Frontiers in Plant Science,2017,8:1911.
[21] KUAI B K,CHEN J Y,H?RTENSTEINER S. The biochemistry and molecular biology of chlorophyll breakdown[J]. Journal of Experimental Botany,2018,69(4):751-767.
[22] LAI B,HU B,QIN Y H,ZHAO J T,WANG H C,HU G B. Transcriptomic analysis of Litchi chinensis pericarp during maturation with a focus on chlorophyll degradation and flavonoid biosynthesis[J]. BMC Genomics,2015,16(1):225.
[23] LIRA B S,DE SETTA N,ROSADO D,ALMEIDA J,FRESCHI L,ROSSI M. Plant degreening:Evolution and expression of tomato (Solanum lycopersicum) dephytylation enzymes[J]. Gene,2014,546(2):359-366.
[24] YIN X R,XIE X L,XIA X J,YU J Q,FERGUSON I B,GIOVANNONI J J,CHEN K S. Involvement of an ethylene response factor in chlorophyll degradation during citrus fruit degreening[J]. The Plant Journal,2016,86(5):403-412.
[25] 李志謙,李靖雯,鄒東方,黃瑩瑩,葉霞,馮建燦. 葡萄采后貯藏過程中穗梗褐變的研究進展[J]. 河南農業大學學報,2021,55(5):815-820.
LI Zhiqian,LI Jingwen,ZOU Dongfang,HUANG Yingying,YE Xia,FENG Jiancan. Research progress of rachis browning in postharvest storage of grape[J]. Journal of Henan Agricultural University,2021,55(5):815-820.
[26] LI L,KAPLUNOV T,ZUTAHY Y,DAUS A,PORAT R,LICHTER A. The effects of 1-methylcyclopropane and ethylene on postharvest rachis browning in table grapes[J]. Postharvest Biology and Technology,2015,107:16-22.
[27] 李具鵬,傅茂潤,楊曉穎. 1-MCP處理對采后葡萄果梗褐變及葉綠素降解相關基因的影響[J]. 食品工業科技,2018,39(20):268-273.
LI Jupeng,FU Maorun,YANG Xiaoying. Effect of 1-MCP treatment on postharvest browning and chlorophyll breakdown pathway related genes in grape rachis[J]. Science and Technology of Food Industry,2018,39(20):268-273.
[28] QIU K,LI Z P,YANG Z,CHEN J Y,WU S X,ZHU X Y,GAO S,GAO J,REN G D,KUAI B K,ZHOU X. EIN3 and ORE1 accelerate degreening during ethylene-mediated leaf senescence by directly activating chlorophyll catabolic genes in Arabidopsis[J]. PLoS Genetics,2015,11(7):e1005399.
[29] 岳文冉,岳俊燕,張秀娟,楊杞,韓曉東,王瑞剛,李國婧. 中間錦雞兒CiNAC1基因促進轉基因擬南芥葉片的衰老[J]. 中國生物工程雜志,2018,38(4):24-29.
YUE Wenran,YUE Junyan,ZHANG Xiujuan,YANG Qi,HAN Xiaodong,WANG Ruigang,LI Guojing. The CiNAC1 from Caragana intermedia promotes transgenic Arabidopsis leaf senescence[J]. China Biotechnology,2018,38(4):24-29.
[30] SAKURABA Y,SCHELBERT S,PARK S Y,HAN S H,LEE B D,ANDR?S C B,KESSLER F,H?RTENSTEINER S,PAEK N C. STAY-GREEN and chlorophyll catabolic enzymes interact at light-harvesting complex II for chlorophyll detoxification during leaf senescence in Arabidopsis[J]. The Plant Cell,2012,24(2):507-518.
[31] WEI Q,GUO Y J,KUAI B K. Isolation and characterization of a chlorophyll degradation regulatory gene from tall fescue[J]. Plant Cell Reports,2011,30(7):1201-1207.
[32] MATSUDA K,SHIMODA Y,TANAKA A,ITO H. Chlorophyll a is a favorable substrate for chlamydomonas Mg-dechelatase encoded by STAY-GREEN[J]. Plant Physiology and Biochemistry,2016,109:365-373.
[33] SATO Y,MORITA R,NISHIMURA M,YAMAGUCHI H,KUSABA M. Mendels green cotyledon gene encodes a positive regulator of the chlorophyll-degrading pathway[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(35):14169-14174.
[34] LUO Z D,ZHANG J H,LI J H,YANG C X,WANG T T,OUYANG B,LI H X,GIOVANNONI J,YE Z B. A STAY-GREEN protein SlSGR1 regulates lycopene and β-carotene accumulation by interacting directly with SlPSY1 during ripening processes in tomato[J]. New Phytologist,2013,198(2):442-452.
[35] BARRY C S. The stay-green revolution:Recent progress in deciphering the mechanisms of chlorophyll degradation in higher plants[J]. Plant Science,2009,176(3):325-333.
[36] SAKURABA Y,SCHELBERT S,PARK S Y,HAN S H,LEE B D,ANDR?S C B,KESSLER F,H?RTENSTEINER S,PAEK N C. STAY-GREEN and chlorophyll catabolic enzymes interact at light-harvesting complex II for chlorophyll detoxification during leaf senescence in Arabidopsis[J]. The Plant Cell,2012,24(2):507-518.

