真菌鞘糖脂的生物學功能及應用研究進展
卓少恩, 林瀛栩, 胡 琪, 曾 斌, 蔣春苗
(江西科技師范大學生命科學學院 江西省生物加工過程重點實驗室,江西 南昌 330013)
真菌是地球上分布最廣泛的生物之一,具有重要的環境和醫學意義,其中酵母菌和絲狀真菌在工業生產中有著廣泛的應用。目前已知的具有生物活性的微生物次級代謝產物中,近一半都是由絲狀真菌所產生[1],如臨床上使用的青霉素型和頭孢菌素型β-內酰胺類抗感染藥物也是來源于絲狀真菌。另外,有些絲狀真菌如黑曲霉(Aspergillusniger)、里氏木霉(Trichodermareesei)和黃曲霉(Aspergillusflavus)在發酵工業中,主要用于開發工業酶制劑和有機酸的生產[2-3]。除此之外,米曲霉(Aspergillusoryzae)、醬油曲霉(Aspergillussojae)和構巢曲霉(Aspergillusnidulans)等絲狀真菌的特殊代謝產物,如鞘糖脂,在功能性醫藥用品、保健食品、化妝品及抗真菌藥物開發等相關領域有著廣泛應用[4-5]。 糖脂(Glygolipids)是糖還原末端以糖苷鍵的形式與脂類結合在一起形成的化合物的總稱,廣泛分布于動物、高等植物和真菌中。糖脂的種類很多,其中研究得較為深入和廣泛的是鞘糖脂(Glycosphingolipids)。鞘糖脂是細胞內重要的生物活性物質,不僅參與細胞分化、增殖、免疫、凋亡及衰老等重要生理活動[6-7],中性鞘糖脂還可作為功能性醫藥用品、化妝品、保健食品等的重要活性組分。近年來,隨著生物化學和分子生物學的發展,以及新型分離分析技術的涌現,鞘糖脂的結構、功能及應用研究取得了很大的進步。本文主要對真菌鞘糖脂的結構、生物合成代謝、生物學功能及其作為生物活性分子在保健食品和護膚品中的潛在應用等研究進展進行詳細的總結。
1 真菌鞘糖脂的結構及種類
真菌鞘糖脂屬鞘脂的一類糖脂。目前,人類致病性菌白色念珠菌(Candidaalbicans)[8]、植物病原體禾谷鐮刀菌(Fusariumgraminearum)[9]、模式真菌粗糙脈孢菌(Neurosporacrassa)[10]等真菌的鞘糖脂均已成功分離和鑒定。真菌鞘糖脂主要由鞘氨醇長鏈、C16-26脂肪酸鏈和特殊的極性基團三個部分組成,根據極性基團的不同,可分為中性鞘糖脂和酸性鞘糖脂兩大類。
在真菌中,Δ4-Δ8-9-甲基-鞘氨醇作為鞘氨醇長鏈,與C16-18脂肪酸鏈連接形成神經酰胺,再與葡萄糖或半乳糖殘基形成中性鞘糖脂—葡萄糖神經酰胺(Glucosylceramide, GlcCer)或半乳糖神經酰胺 (Galactosylceramide, GalCer)(圖1A)。迄今為止,所有研究過的絲狀真菌均含有GlcCer或GalCer,其中大多數曲霉屬,如煙曲霉(Aspergillusfumigatus)[11-13]、A.niger[14-15]、A.oryzae,A.sojae和泡盛曲霉(Aspergillusawamori)[16]等真菌均能合成GlcCer和GalCer。有趣的是,菌絲形態的申克孢子絲菌(Sporothrixschenckii)僅能合成GlcCer,但其酵母態可同時合成GlcCer和GalCer[17-18]。在真菌中,GlcCer和GalCer是中性鞘糖脂代謝通路的最后一步產物;在高等動物中,GlcCer進一步加上各種糖基形成分布于全身的復雜鞘糖脂,GalCer或其被修飾形成的硫苷脂僅分布于中樞神經組織;目前發現在植物中只有中性鞘糖脂GlcCer,沒有GalCer。
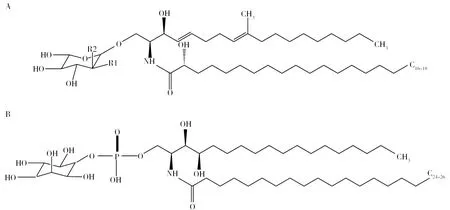
圖1 中性鞘糖脂基本結構和肌醇磷脂酰神經酰胺結構[26]Fig.1 Basic structure of neutral glycosphingolipids and Inositol phosphatidylceramide structures[26]A: 中性鞘糖脂基本結構,當R1為-OH,R2為-H時,則為GlcCer;當R1為-H,R2為-OH,則為GalCer;B: 肌醇磷脂酰神經酰胺結構A: Basic structure of neutral glycosphingolipids,When R1 is -OH and R2 is -H, it is GlcCer; When R1 is -H and R2 is -OH, it is GalCer; B: Inositol phosphatidylceramide structures
真菌酸性鞘糖脂又稱為糖基肌醇磷酸神經酰胺(Glycosyl inositol phosphoceramide, GIPC),包括甘露糖基肌醇磷脂酰神經酰胺(Metabolic inositol phosphoceramide, MIPC)和甘露糖-(肌醇磷脂酰)2-神經酰胺(Metabolic (inositol phosphoceramide)2, M(IP)2C)。在真菌中,酸性鞘糖脂以植物神經酰胺鞘氨醇作為骨架,與C18-26的脂肪酸鏈和多種復雜糖基連接形成肌醇磷脂酰神經酰胺(Inositolphosphoryl-ceramides,IPC),IPC可作為合成更復雜酸性鞘糖脂的前導物質,通過添加甘露糖和第二個肌醇磷酸基進一步修飾,生成具有甘露糖單元的MIPC和具有甘露糖單元以及兩個肌醇基的M(IP)2C[19]。MIPC和M(IP)2C的聚糖部分表現出很大的多樣性和復雜性,在不同的真菌種類之間存在差異。
真菌中性和酸性鞘糖脂的神經酰胺骨架結構上有特殊的差異,如中性鞘糖脂的鞘氨醇在C4-5和C8-9處有不飽和雙鍵,在C9上有一個甲基化(-CH3)基團[20-23],這種Δ4-Δ8-9-甲基-鞘氨醇結構是真菌中性鞘糖脂特有的結構(圖1A)。而在植物中,Δ4-Δ8-鞘氨醇結構(C4-5和C8-9不飽和雙鍵)在中性鞘糖脂中也有發現[20,22,24], 但在哺乳動物中主要以Δ4-鞘氨醇結構(C4-5不飽和雙鍵)形式存在[22]。相反,與中性鞘糖脂不同,真菌酸性鞘糖脂在鞘氨醇的C4處有一個羥基(-OH),且酸性鞘糖脂的鞘氨醇的C4-5和C8-9沒有不飽和雙健及C9的甲基化結構(圖1B)。此外,中性和酸性鞘糖脂的脂肪酸鏈長度也不同,如真菌中性鞘糖脂脂肪酸鏈多為C16-18,而酸性鞘糖脂以C18-26脂肪酸鏈為主[25],且一些真菌鞘糖脂的脂肪酸鏈在C3-4有1個不飽和雙鍵,這種雙鍵僅存在于子囊真菌的GlcCer和GalCer中,如A.fumigatus[11-12]和A.niger[14-15]。植物鞘糖脂脂肪酸鏈的長度范圍在C14~C26[24],而哺乳動物中性鞘糖脂的脂肪酸鏈主要為 C16或C18[22]。
2 真菌鞘糖脂生物合成涉及的關鍵基因和重要產物
目前,釀酒酵母(Saccharomycescerevisiae)、C.albicans、N.crassa[10]、A.nidulans[27-28]和F.graminearum[9,29-31]等真菌的鞘糖脂生物合成途徑已比較清楚。鞘糖脂的原料神經酰胺可來自3條途徑,denovo合成(或稱從頭合成途徑)、鞘磷脂的降解和鞘糖脂再循環利用途徑,本文主要討論真菌鞘糖脂的denovo合成途徑。鞘糖脂的denovo合成途徑起始于內質網上的膜結合酶催化反應[32-33],為了更好地理解真菌鞘糖脂的生物合成,將整個鞘糖脂生物合成過程分為三個模塊(圖2),即二氫鞘氨醇的合成、中性鞘糖脂的合成和酸性鞘糖脂的合成。
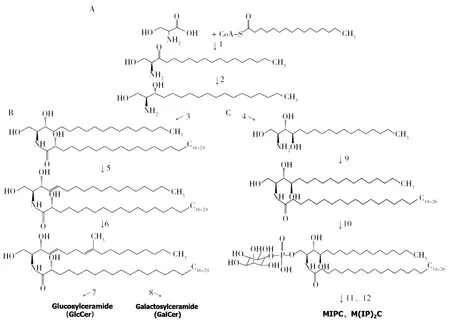
圖2 真菌鞘糖脂的生物合成途徑Fig.2 Biosynthetic pathway of fungal glycosphingolipidsA:de novo合成途徑中二氫鞘氨醇的合成途徑; B:中性鞘糖脂的合成途徑; C:酸性鞘糖脂的合成途徑.1:絲氨酸軟脂酰輔酶A轉移酶;2:3-酮基二氫神經酰胺鞘氨醇還原酶;3:神經酰胺合成酶;4: 鞘脂C4羥化酶;5:鞘脂Δ4-去飽和酶;6:鞘脂Δ8-去飽和酶和鞘脂C9-甲基轉移酶;7:葡萄糖神酰神經酰胺合成酶;8:半乳糖神酰神經酰胺合成酶;9:神經酰胺合成酶;10:肌醇磷脂酰神經酰胺合成酶;11:GDP-甘露糖-肌醇-磷酸神經酰胺轉移酶;12:肌醇磷脂酰神經酰胺合成酶A: Synthesis pathway of dihydrosphinganol in de novo synthesis pathway; B: Synthesis pathway of neutral glycosphingolipids; C: Synthesis pathway of acid glycosphingolipids. 1:Serine palmitoyl transferase; 2: 3-ketodihydroceramide sphingosine reductase; 3: Ceramide synthetase; 4: Sphingolipid C4 hydroxylase; 5: Sphingolipids Δ 4-desaturase; 6: Sphingolipids Δ 8-desaturase and sphingolipid C9 methyltransferase; 7: Glucosylceramide synthase; 8: Galactosylceramide synthetase; 9: Ceramide synthase; 10: Inositol phosphatidyl ceramide synthetase; 11: GDP mannose inositolphosphate ceramidase; 12: Inositol phosphatidyl ceramide synthetase
2.1 二氫鞘氨醇的生物合成
二氫鞘氨醇的合成是中性和酸性鞘糖脂生物合成的共同起點,主要涉及兩步酶催化反應(圖2)。絲氨酸和棕櫚酰輔酶A在絲氨酸軟脂酰輔酶A轉移酶的催化下縮合成3-酮基二氫鞘氨醇,然后經3-酮基二氫鞘氨醇還原酶還原為二氫鞘氨醇(圖2A)。絲氨酸軟脂酰輔酶A轉移酶作為鞘糖脂合成的第一個限速酶,在所有生物中都相當保守。在酵母和絲狀真菌中,絲氨酸軟脂酰輔酶A轉移酶由LCB1、LCB2和TSC3基因編碼,LCB1和LCB2是該酶活性所必需的兩個基因,敲除LCB1或/和LCB2基因的S.cerevisiae突變菌株均不能合成鞘糖脂[34-36]。在A.nidulans中,編碼絲氨酸軟脂酰輔酶A轉移酶的基因與S.cerevisiaeLCB1為同源基因,并命名為lcbA,是A.nidulans菌絲極性生長必需基因。TSC3屬于TSC基因家族,TSC3基因編碼一種新的80-氨基酸蛋白,具有親水性的氨基末端和膜相關的疏水羧基末端。該蛋白可與LCB1或/和LCB2結合形成酶復合體,可調控絲氨酸軟脂酰輔酶A轉移酶的最佳活性,并且是維持真菌在高溫下生長所不可缺少的[37]。3-酮基二氫鞘氨醇還原酶在絲狀真菌中的研究較少,在A.fumigatus中,該酶由ksrA基因編碼,但ksrA在曲霉中的生物學作用還有待闡明;C.albicans缺失ksr1會損害菌絲的生長,表明ksr1的表達對菌絲的極性生長具有重要作用[38]。在真菌中,二氫鞘氨醇合成后可分別用于生成二氫神經酰胺和植物神經酰胺,是中性鞘糖脂和酸性鞘糖脂生物合成的起點和共同途徑[13,39-41]。
2.2 中性鞘糖脂的生物合成
在合成中性鞘糖脂過程中,二氫鞘氨醇首先在神經酰胺合成酶的催化作用下與C16或C18的脂肪酸鏈發生酰化作用生成二氫神經酰胺,隨后在脂肪酸鏈的C2位插入羥基(-OH)基團,生成OH-二氫神經酰胺,真菌OH-二氫神經酰胺可以由不同長度和飽和度的脂肪酸鏈組成。參與該步驟的神經酰胺合酶編碼基因BarA(或Cer1或Bar1)已在A.nidulans、新型隱球菌(Cryptococcusneoformans)中鑒定且證明其在菌絲極性生長中起著重要作用[39-41]。BarA(或Cer1或Bar1)基因在合成中性鞘糖脂中起到重要作用,敲除該基因的突變菌株不能直接合成中性鞘糖脂[41,43-44]。
隨后,OH-二氫神經酰胺由鞘脂Δ4-去飽和酶還原為Δ4-OH-神經酰胺。鞘脂Δ4-不飽和酶基因在S.cerevisiae和C.albicans中已被鑒定和研究,敲除該基因的C.albicans突變菌株與野生型相比,菌絲生長速率降低。然后Δ4-OH-神經酰胺通過鞘脂Δ8-去飽和酶及鞘脂C9甲基轉移酶分別在C8-9處和C9處引入一個雙鍵和一個甲基(-CH3)基團,生成OH-Δ4-Δ8-9-甲基神經酰胺。這種Δ8-不飽和和C9-甲基化的神經酰胺鞘氨醇特征是真菌中性鞘糖脂特有的,是真菌生長、分化和致病所必需的[42]。在A.nidulans、C.neoformans和F.graminearum中,敲除鞘脂Δ8-脫氫酶基因(sdeA)和鞘脂C9-甲基轉移酶基因(SmtA/SmtB)會導致飽和(未甲基化)GlcCer的積累,抑制真菌菌絲生成,嚴重影響真菌生長。因此Δ8-不飽和及甲基化的鞘氨醇修飾是真菌正常生長和菌絲分化所必需的[28,43]。
最后,合成的Δ4-Δ8-9-甲基神經酰胺從內質網轉移到高爾基體,在葡萄糖神經酰胺合成酶或半乳糖神經酰胺轉移酶的作用下,將UDP-葡萄糖或UDP-半乳糖轉移到OH-Δ4-Δ8-9-甲基神經酰胺骨架上,合成中性鞘糖脂GlcCer或GalCer[26,44-46]。目前研究表明大多數真菌葡萄糖神經酰胺合成酶編碼基因GCSA或GCS1的表達在真菌的菌絲生成過程中極為重要,敲除GCSA或GCS1基因的真菌不能合成GlcCer,直接影響菌體的生長和絲狀化[28]。與葡萄糖神經酰胺合成酶不同,在真菌中編碼神經酰胺半乳糖基轉移酶的基因只在N.crassa和稻瘟病菌(Magnaporthegrisea)中被發現[47-48],關于真菌神經酰胺半乳糖基轉移酶及GalCer功能的研究報道極其有限。在哺乳動物中,GlcCer和GalCer是中性復雜鞘糖脂形成的前導物質,進一步可形成腦苷脂、神經節苷脂、紅細胞糖苷脂,而在真菌中,GlcCer和GalCer是鞘糖脂代謝通路的最后一步產物。
2.3 酸性鞘糖脂的生物合成
二氫鞘氨醇通過羥基化先形成植物鞘氨醇,并作為脫飽和神經酰胺的前體,在C.albicans、畢赤酵母(Pichiapastoris)、粟酒裂殖酵母(Schizosaccharomycespombe)、乳酸克魯維酵母(Kluyveromyceslactis)和S.cerevisiae中發現[44,49-51]。二氫鞘氨醇的羥基化由鞘脂C4-羥化酶催化,在S.cerevisiae中,Sur2基因對鞘脂C4羥基化活性是必需的,但對正常生長不是必需的。但是Sur2同源基因A.nidulansBasA對植物鞘氨醇的生物合成是必需的,對真菌生存也是必需的[52],敲除BasA基因的A.nidulans突變體將會導致真菌異常細胞壁增厚,研究表明,產生這種表型的原因是二氫鞘氨醇的積累[52]。
生成的植物鞘氨醇通過神經酰胺合成酶催化形成植物神經酰胺。編碼神經酰胺合成酶的LagA基因在酵母和絲狀真菌中廣泛存在,是真菌生長和菌絲極性生長必需基因。研究表明,抑制A.nidulansLagA基因表達的突變菌株生長緩慢,菌絲發生扭曲[39]。在C.albicans中,缺乏Lag1基因嚴重影響該菌的生長和菌絲形態的構建。此外,在酵母型真菌中,過表達Lag1可誘導該生物體的假菌絲生長,這表明Lag1對于傳遞信號以誘導菌絲特異性基因表達是必需的[41]。
以上的反應都在內質網進行,植物神經酰胺必須從內質網轉移到高爾基體中才能加入極性基團形成復雜的酸性鞘糖脂,植物神經酰胺的囊泡轉運和非囊泡轉運都不需要ATP,但需要內質網和高爾基膜之間的直接接觸[53]。在真菌中,IPC合成酶將肌醇-1-磷酸基團從磷脂酰肌醇上轉移到植物神經酰胺C1-OH上形成IPC。IPC合成酶在曲霉屬種[54]中由aurA基因編碼,也稱IPC1基因,在真菌中是必不可少的,對真菌的存活至關重要。抑制A.nidulansaurA的菌株孢子喪失萌發能力,引起終端表型[55]。IPC作為合成更復雜的酸性鞘糖脂的前導物質,進一步形成MIPC和M(IP)2C等復雜酸性鞘糖脂。例如,在GDP-甘露糖-肌醇-磷酸神經酰胺轉移酶作用下將GDP-甘露糖基轉移到IPC的肌醇2-OH上,從而形成MIPC。該反應需要Csg1 (Sur1)、Csg2[56]和Csh1[57-58]三種蛋白,這些蛋白可以形成兩個不同的肌醇磷酸神經酰胺甘露糖基轉移酶復合物Csg1-Csg2和Csh1-Csg2,Csg1和Csh1亞基起催化作用,Csg2起調節作用[57]。MIPC還可以進一步在IPC合成酶的作用下將另一個肌醇磷脂酰基加入到MIPC形成M(IP)2C[59]。酵母也可通過將第二個肌醇磷酸從磷脂酰肌醇轉移到MIPC產生M(IP)2C,這一反應需要Ipt1基因[60]。另外,Skn1基因也已被證明是M(IP)2C合成的必需基因[61]。Skn1通過調節Ipt1的活性發揮作用或者在營養不良的生長條件下,Skn1可以作為Ipt1的功能同源物,酵母在馬鈴薯葡萄糖培養基中生長時,Ipt1缺失的細胞會產生低水平的M(IP)2C[62]。
3 真菌鞘糖脂的生物學功能
3.1 鞘糖脂在真菌生長中的作用
鞘糖脂是真菌細胞膜的主要成分,在膜微區中與膽固醇、甾醇聚集形成脂筏,參與真菌細胞極化和菌絲的極性生長[63]。鞘糖脂的生物學功能在絲狀真菌中已通過基因缺失或抑制途徑進行了研究[8,28,31,64-66]。研究表明,GlcCer生物合成途徑中任何步驟的打斷都會抑制真菌菌絲生長和菌絲延伸,并導致脂筏定位錯誤。例如,敲除barA或通過抑制劑打斷GlcCer合成途徑,都極大地減少了菌絲極性生長或菌絲延伸[39,67]。同樣,通過敲除GlcCer合成最后一步的葡萄糖神經酰胺合成酶基因或添加該酶抑制劑,也會損害A.nidulans菌絲的延伸,或抑制A.fumigatus出芽、芽管形成等[27-28,30]。這些研究結果表明,GlcCer對絲狀真菌極性軸的建立和維持、真菌的生長和分化至關重要。
與GlcCer相比,GalCer的大部分功能研究主要在哺乳動物中進行,其在真菌中的生物學功能尚不清楚。現有研究發現菌絲形態的S.schenckii只合成GlcCer,但其酵母形態同時含有GlcCer和GalCer,表明在S.schenckii菌絲體形態-酵母形態轉換過程中,神經酰胺半乳糖基轉移酶可能被激活,或者在酵母形態-菌絲形態轉化過程中被抑制[17-18]。A.fumigatus和S.schenckii菌絲中性鞘糖脂的結構分析發現,GalCer和GlcCer具有相同的神經酰胺骨架,但GalCer含有較高比例的Δ3-不飽和脂肪酸[12,18]。這些結果表明,GalCer的產生和脂肪酸鏈的Δ3-不飽和度可能是鞘糖脂通過激活/失活信號轉導通路調控真菌形態發生的分子機制。
在真菌中,不僅中性鞘糖脂的合成受損時影響真菌的生長和菌絲分化,酸性鞘糖脂合成在真菌生長中也具有重要作用。如抑制IPC合成酶后,植物鞘氨醇和植物神經酰胺代謝物的積累會導致真菌細胞周期阻滯和凋亡[55]。IPC合成途徑的完整性與真菌的生存能力有關,不僅是因為IPC在真菌分化中的作用,還與二氫鞘氨醇、植物鞘氨醇和植物神經酰胺含量水平的高度調控有關,因為二氫鞘氨醇和植物鞘氨醇的積累對真菌細胞具有極大的毒性作用,兩者的高水平積累會導致真菌細胞死亡。所以,植物神經酰胺合成酶和IPC合成酶可以成為開發新型抗真菌藥物的潛在靶點,因為抑制這些酶活性將導致植物鞘氨醇和植物神經酰胺的積累,最終導致真菌細胞死亡,從而達到抑菌效果。
3.2 非生物脅迫
在真菌的維持正常生理功能中,適宜的細胞膜流動性是必要條件,膜流動性降低或提高是細胞感受溫度信號的關鍵早期反應之一。當細胞處于寒冷、高溫或極端環境情況下,降低質膜的滲透性,有利于保護質膜的穩定性[26,68-69]。真菌鞘糖脂含量的多少直接影響細胞膜的完整性和離子通透性。在中性鞘糖脂合成途徑中,當GlcCer合成通路被阻斷或外源施加鞘糖脂后,其對環境溫度脅迫的耐受能力都受到明顯的影響。有研究表明酵母ΔLCB突變體因缺少鞘氨醇而不能在溫度較高或過高(大于37 ℃)的環境下生存,而施加外源鞘糖脂后重新獲得抵抗熱敏感的能力[70]。不同溫度脅迫會直接影響酵母鞘糖脂類型、含量和鞘氨醇碳鏈長度[71]。此外,敲除鞘糖脂生物合成途徑中的關鍵基因CSG2或IPT,會抑制酵母突變菌株在12 ℃時的菌絲生長,而在28 ℃時沒有影響[72],但這些基因的過表達又改善了酵母的菌絲在低溫下的生長和發酵活性,表明鞘糖脂在冷脅迫下參與發酵活性細胞的過程中也發揮了重要作用[73]。
嗜熱微生物在高溫脅迫下可以通過改變細胞中鞘糖脂類物質的含量響應高溫脅迫。嗜熱微生物中酸性鞘糖脂IPC的相對含量會隨著溫度的升高而增加,但MIPC或M(IP)2C的相對含量卻降低[71]。N.crassa在應答熱脅迫中合成C18和C24脂肪酸鏈的植物神經酰胺,作為信號分子介導真菌的細胞凋亡[74]。GlcCer合成在真菌響應酸堿環境脅迫中也具有重要作用。例如C.neoformans的Cer1突變體因不能合成GlcCer而不能在酸/堿性環境中生存;S.cerevisiae自身不能合成GlcCer,但在外源施加GlcCer后,可以提高其對堿性環境和乙醇的耐受性[75]。除此之外,細胞中只能合成飽和GlcCer的C.neoformans突變體對膜應激物的敏感性增強,抗逆能力減弱[43]。這些研究結果表明,鞘糖脂含量和種類在微生物應答逆境脅迫中起著重要的作用。
3.3 細胞凋亡
鞘糖脂代謝在細胞凋亡中起重要作用。在細胞增殖、分化、衰老到凋亡過程中,鞘糖脂被認為是細胞凋亡外部通路的關鍵因子[76],許多鞘糖脂在細胞生長分化過程中都有抑制細胞凋亡的作用。研究發現,二氫鞘氨醇和植物鞘氨醇對A.nidulans具有非常高的結構和立體化學特異性,具有很強的殺菌活性。在細胞的凋亡過程中,二氫鞘氨醇和植物鞘氨醇能快速誘導DNA凝聚,而不依賴于有絲分裂、大規模DNA斷裂,這些都是細胞凋亡的共同形態學特征,表明二氫鞘氨醇和植物鞘氨醇能誘導A.nidulans細胞凋亡[77]。在中性鞘糖脂合成途徑中,C.albicans的細胞壁含有GlcCer,可與從蘿卜中分離的抗真菌植物防御素RsAFP2相互作用,由于RsAFP2耐受基因涉及細胞壁完整性和菌絲生長/分隔環形成,從而阻斷了C.albicans酵母形態-菌絲形態的轉化,最終導致C.albicans的細胞凋亡[78]。
4 真菌鞘糖脂的應用
4.1 真菌GlcCer和GalCer的潛在開發應用
鞘糖脂是細胞內重要的生物活性物質,作為信號分子不僅參與細胞分化、凋亡及衰老等重要生理活動,中性鞘糖脂還可作為功能性醫藥用品、化妝品、保健食品的重要活性組分。目前,作為保濕成分被廣泛添加在化妝品中或作為功能成分添加到保健食品的中性鞘糖脂GlcCer主要來源于植物[79-80]。研究表明,在表皮細胞分化過程中,GlcCer在角質形成細胞中可被β-葡萄糖神經酰胺水解酶水解為神經酰胺并儲存在角質層,神經酰胺是維持和形成表皮通透性屏障的關鍵分子,是皮膚保水的重要成分[81]。表皮中β-葡萄糖神經酰胺水解酶的缺乏或抑制可改變神經酰胺和GlcCer的分布,導致表皮通透性屏障功能下降[79]。而GalCer可激活角質細胞中β-葡萄糖神經酰胺水解酶,促進GlcCer水解釋放出神經酰胺[79],增加角質細胞中神經酰胺的含量以改善皮膚干燥和過敏性皮膚炎等。純化的GlcCer通常作為功能補充添加到保健食品中,多項動物模型和人體試驗結果表明,口服植物GlcCer可減少皮膚表皮水分流失、皮膚過敏和UVA 誘導的皮膚皺紋[82-84]。除了改善皮膚屏障功能和預防特應性皮炎外,植物 GlcCer 作為膳食補充劑還具有預防腸道損傷的功能。口服GlcCer 能保護結腸表面免受各種藥物的有害影響,并可通過調節腸道微生物群來改善腸道微環境[85-87]。有趣的是,GlcCer必須在β-葡萄糖神經酰胺水解酶的作用下釋放出神經酰胺才能在皮膚屏障和預防腸道損傷中發揮作用。目前應用到化妝品和保健食品中的GlcCer主要從小麥、稻米、大豆等植物中進行提取,但來自植物的中性鞘糖脂沒有GalCer。在發現瘋牛病之前,GalCer主要來源于牛等動物神經組織,但由于存在病毒疾病風險,從動物神經組織提取的GalCer不能直接用于化妝品或其他人類用途[88]。因此,尋求新的合成 GlcCer 和 GalCer 的生物資源并利用基因工程技術定向改造,以此來提高生物體內 GlcCer 和 GalCer 含量具有非常廣闊的應用前景。
在真菌中,有多種食品級安全真菌可以合成GlcCer和GalCer,由GalCer(30.3%)和GlcCer(69.7%)組成的糖基神經酰胺(中性鞘糖脂)是曲霉菌中豐富的鞘糖脂之一,如Koji類曲霉中1 g菌絲體大約含有240 μg中性鞘糖脂[89]。早在1977年,學者們陸續從A.oryzae、A.fumigatus、A.niger中提取純化并鑒定到了GlcCer,直到2014年,日本學者首次從A.oryzae、A.sojae和A.awamori等曲霉中提取純化鑒定到GalCer,證實了A.oryzae、A.sojae和A.awamori可同時生成GlcCer和GalCer[16,23,89-90]。
目前有研究表明真菌糖基神經酰胺在預防腸道損傷和提高皮膚水分含量中發揮重要的作用[91]。來源于圓酵母(Torulayeast)的GlcCer可以增加真皮成纖維細胞增殖和膠原蛋白的生成,有助于保持皮膚彈性[4]。Miyagawa等[92]研究表明,糖基神經酰胺還會影響正常人表皮角化細胞基因的表達,如Koji、琉球曲霉(Ryukyuaspergillus)和A.oryzae的糖基神經酰胺可增強OCLN蛋白(一種表皮緊密連接蛋白)基因和ABCA12蛋白基因(ATP結合亞家族成員12)的表達水平來增加角質形成細胞中神經酰胺的含量。此外,Hamajima等[93]證實,A.oryzae糖基神經酰胺可作為益生元被腸道微生物菌群消化,增加了腸道中有益物種球形白球菌(Blautiacoccoides)的比例。Hamajima等報道,向肥胖小鼠喂食A.oryzae糖基神經酰胺可改變小鼠膽固醇代謝,并能明顯降低肝臟膽固醇含量[94]。綜上所述,來自曲霉的 GlcCer 和 GalCer 既可作為化妝品的保濕成分,又可作為“功能成分”添加到保健食品中,且來源于曲霉的中性鞘糖脂因同時含有 GlcCer 和 GalCer,彌補了植物僅含有 GlcCer 的缺陷,尤其被認定為食品級安全菌株的A.oryzae,將是開發中性鞘糖脂的理想生物資源。
4.2 中性鞘糖脂作為抗菌肽的靶點
由于真菌鞘糖脂的結構與哺乳動物不同,真菌中性鞘糖脂可以作為抗菌肽的靶點來阻斷它們的功能。先前研究已經確定了幾種天然產物可直接靶向真菌GlcCer并調節其生長。研究表明,RsAFP2和海利霉素(Heliomycin)對產生GlcCer的C.albicans和P.pastoris具有活性,而缺乏GlcCer的菌株對RsAFP2和Heliomycin具有抗藥性。RsAFP2結合GlcCer將會改變真菌細胞壁的形狀,最終影響C.albicans的酵母形態—菌絲形態的轉化。有趣的是,RsAFP2和Heliomycin不與人類GlcCer相互作用[95]。近些年,由于GlcCer具有高度免疫原性,針對真菌GlcCer的單克隆抗體已被開發出來。如被C.neoformans感染的患者會產生抗體,經過用GlcCer抗體處理后,C.neoformans所合成的GlcCer含量減少,細胞出芽和體外生長受到抑制,再向其他患者注射這些人類血清的抗體時[96],將會抑制C.neoformans細胞的出芽。單克隆抗體最終產生了抗真菌GlcCer的抗體,表明被動給藥是一種可以避免受C.neoformans感染的治療方法[97]。此外,用GlcCer抗體處理裴氏著色霉(Fonsecaeapedrosoi)[98]和膠孢炭疽菌(Colletotrichumgloeosporioides)[99]后會直接抑制真菌生長和降低分生孢子萌發率。中性鞘糖脂作為抗菌肽的靶點顯然還需要進一步的研究,但目前獲得的研究結果清楚地表明,使用特異性單克隆抗體阻斷鞘糖脂功能可能是一種很有希望的治療侵襲性真菌感染的選擇。
4.3 酸性鞘糖脂在開發抗真菌藥物中的應用
IPC是真菌生長所必需的,抑制IPC合成途徑會導致真菌細胞死亡。因此通過合成IPC合成抑制劑,直接抑制酸性鞘糖脂代謝酶的酶活性來開發抗真菌藥物,可以有效抑制真菌的生長。其中IPC合成酶就是一個理想的抗真菌藥開發靶點。目前已經合成的IPC合成抑制劑有金擔子素A(Aureobasidin A,AbA)[100]、羅他霉素(Rotamycin)[101]、Khafrefungin[102]、銹霉素(Rustmicin)。AbA是最先被開發出來的IPC合成酶的抑制劑,對C.albicans、C.neoformans、A.oryzae等病原真菌都有很強的殺菌作用[103]。AbA是結合在IPC合成酶的疏水部位從而抑制真菌IPC合成酶的活性使酸性鞘糖脂IPC合成量減少[104],IPC合成酶實際上被稱為Aur1,因為它是對AbA[105]產生抗性的基因,但是AbA只會殺死正在生長的細胞,而對處于休眠期的細胞卻無任何影響,這表明AbA不抑制遺傳物質的合成。而Rotamycin抑制劑對C.albicans具有良好的抗真菌活性。此外,Khafrefungin是由內生真菌產生的一種殺真菌化合物,在體外較低的濃度就可抑制IPC合成酶活性并導致植物鞘氨醇和植物神經酰胺的積累從而抑制真菌生長。同樣,Rustmicin在體外較低的濃度也會抑制IPC合成酶且對真菌的抑制作用具有選擇性,對C.albicans和S.cerevisiae的抑制作用基本相似,抑制效果相對于C.neoformans較不明顯。
以上抗菌藥物已經開發出來,可是霉菌中的IPC合成酶不易受AbA的影響,新的AbA衍生物已被合成,對IPC合成酶的抑制能力有所提高,可較好地抑制A.fumigatus[106]。但這些化合物對真菌的選擇性是否與哺乳動物細胞相似,還有待進一步研究。除此之外,Pleofunins是最近被鑒定的IPC合成酶新抑制劑,該抑制劑從根霉屬(Rhizopus)的菌絲提取物中分離出來,屬于一類對酵母和霉菌均有效的IPC合酶抑制劑[107],抑制效果比先前的IPC合成酶抑制劑都要好。Pleofunins雖然預期對哺乳動物細胞沒有毒性,但這些化合物的選擇性指數在很大程度上是未知的。
5 展 望
鞘糖脂是一類化學性質復雜的糖脂物質,廣泛存在于真菌、植物和動物中。我們總結了真菌鞘糖脂的種類和結構,討論了鞘糖脂在真菌中的生物合成途徑和生物學功能,并特別關注了中性鞘糖脂作為保濕成分和功能成分在化妝品和保健食品中的重要作用,也闡述了鞘糖脂在抗真菌藥開發中的應用。
關于鞘糖脂抗真菌藥的開發研究中,目前已經研制出了多種抗真菌藥物,如Aureobasidin A(AbA)、Hough cephalosporins、Rotamycin、Khafrefungin、Rustmicin以及相應的衍生物等,這些藥物都對IPC合成酶有著一定的抑制效果,從而抑制了真菌的生長。但是抗真菌化合物的護理標準有限,真菌耐藥性正在迅速上升,抗真菌化合物的抑制水平明顯下降,目前迫切需要具有新作用機制的抗真菌化合物。由于真菌鞘糖脂在結構上不同于哺乳動物,或者完全不存在于哺乳動物系統中,關鍵的真菌鞘糖脂代謝酶在哺乳動物細胞中不存在或存在顯著差異,并且已被證明在實驗室環境中具有針對性。唯一一個限制是這些化合物是否只會殺死真菌而對哺乳動物細胞沒有影響?毒性研究和選擇性指數分析將能夠解決這一限制,隨著藥物設計和藥物篩選新技術的發展,真菌鞘糖脂途徑為開發具有生物活性的抗真菌化合物提供了更廣闊的前景。同時,真菌鞘糖脂代謝途徑中所特有的其他相關酶類也會受到廣大學者的關注,這對研究新型的具有口服活性、半衰期長、低毒、廣譜并具有一定體內和體外活性的抗真菌藥物有著十分重要的理論指導意義。
另外,還探討了真菌中性鞘糖脂作為保濕成分添加到化妝品或作為功能成分的膳食補充劑添加在保健食品中的重要作用。同時也注意到動植物中性鞘糖脂在應用上的局限性及真菌中性鞘糖脂的化妝品和保健食品中應用的優勢。中性鞘糖脂GlcCer在預防腸道損傷和提高皮膚水分含量中發揮重要作用,但不管是在角質形成層細胞還是在小腸或結腸黏膜細胞中,GlcCer必須被β-葡萄糖神經酰胺酶水解成神經酰胺才能發揮作用,而GalCer可以激活β-葡萄糖神經酰胺酶促進GlcCer水解釋放出神經酰胺。但目前應用到化妝品和保健食品中的植物中性鞘糖脂只有GlcCer,沒有GalCer。而來自動物腦組織的GalCer有病毒感染的風險,且來源于動物腦組織的GalCer在化妝品或保健食品中的應用是不被接受的。因此,那些能同時合成GlcCer和GalCer的食品發酵工業的真菌,可以作為生產中性鞘糖脂的直接來源,尤其被美國食品與藥物管理局(FDA)和世界衛生組織(WHO)認定為安全生產菌株(GRAS)的A.oryzae,將被認為是可用于生產GlcCer和GalCer的潛在重要生物資源。因為A.oryzae不僅可以快速生長并積累大量脂質,合成GlcCer和GalCer并將它們儲存在細胞中,而且也可用于食品和保健品的商業規模栽培。此外,與植物或動物相比,利用A.oryzae生產鞘糖脂還具有以下優點:①A.oryzae生長迅速,其生長速度可達到許多陸地植物的100倍以上;②A.oryzae的生長和收獲受季節條件的影響較小;③在中性鞘糖脂提取后,A.oryzae殘留物可用作動物飼料;④來源于A.oryzae的中性鞘糖脂因同時含有GlcCer和GalCer,彌補了植物僅含有GlcCer的缺陷,添加到護膚品或保健食品中對增強皮膚屏障功能或維護腸道健康更加有效。因此,A.oryzae等可作為一種全新且安全的中性鞘糖脂來源的生物資源。但由于真菌鞘糖脂生物合成及分解代謝途徑的復雜性和動態變化,這些活性分子的產生規律和調控機制尚不清楚,很大程度上限制了A.oryzae中性鞘糖脂的開發和應用。因此,研究A.oryzae中性鞘糖脂的合成調控通路,并通過基因工程技術提高中性鞘糖脂的產量將具有非常重要的意義和廣闊的應用前景。

