微小RNA-144對人結腸癌細胞株增殖、侵襲遷移影響及其與同源盒基因 A10結合力
李萍,張月曉,符皓,時軍利,李炳慶
1 承德醫學院附屬醫院消化內科,河北承德 067000;2 承德醫學院附屬醫院營養科
結腸癌是全球范圍內最常見的消化系統惡性腫瘤之一。手術、手術聯合放化療治療結腸癌的效果不佳,治療后結腸癌患者的中位生存率仍然較低[1]。結腸癌的發病是一個包括癌癥相關基因或分子的變化等因素在內的多因素、多步驟的過程。尋找有效的結腸癌分子治療基因靶點仍然是一個目前結腸癌研究的焦點[2]。微小RNA(microRNA, miRNA)可通過直接介導其靶基因的表達,參與調控細胞增殖、周期進展和腫瘤轉移等癌細胞生物學過程,可能是結腸癌發生發展的重要調控靶點之一[3]。研究[4]發現,miR-144 在惡性腫瘤組織和細胞中表達異常,可作為腫瘤抑制因子或癌基因,參與調控癌細胞的生物學表型。目前,miR-144 在結腸癌發生發展中的作用及具體機制尚不完全清楚。同源盒基因 A10(homeobox gene A10,HOXA10)是同源盒基因家族成員之一,HOXA10 在結腸癌組織中表達升高且與患者的不良預后、5-FU 耐藥性有關[5-7]。miR-144 是否通過調控HOXA10 表達,調控結腸癌腫瘤細胞的惡性生物學行為,目前相關研究報道較少。為此,我們觀察了miR-144 對人結腸癌細胞株增殖、侵襲及遷移的影響及結腸癌細胞中miR-144 與HOXA10 的結合力,現將結果報告如下。
1 材料與方法
1.1 細胞、試劑及儀器 人結腸癌細胞株HCT116、SW480、CL-11和永生化正常人結腸上皮細胞株FHC 均購自美國ATCC 公司,置于含10%胎牛血清、100 μ/mL 青霉素、100 μg/mL 鏈霉素的DMEM 培養基中。RNA 抽取試劑、逆轉錄試劑盒和qRT-PCR 熒光定量試劑盒購自大連寶生物公司;陰性對照物NC-mimics、miR-144模擬物miR-144 mimics、過表達HOXA10質粒載體(pcDNA3.1-HOXA10)、野生型及突變型HOXA10 熒光素酶報告基因質粒HOXA10-WT、HOXA10-MUT 購自上海吉瑪制藥公司;DMEM/F12 培養基購自美國Hyclone 公司;Lipofectamine 2000 購自美國Invitrogen 公司;熒光素酶檢測試劑購自美國Promega公司;CCK-8試劑盒購自武漢博士德公司,Transwell 小室購自購自美國Corning公司;基質膠購自美國BD 公司;一抗HOXA10 和GAPDH 抗體購自美國Santa Cruz 公司;二抗IgG 購自美國Bioworld公司。
1.2 人結腸癌細胞株及FHC 細胞miR-144、HOXA10 mRNA檢測 采用qRT-PCR法。取對數生長期HCT116、SW480、CL-11 及FHC 細胞,使用RNA抽取試劑提取細胞總RNA,取總RNA,逆轉錄得到cDNA 后,加入引物,按照qRT-PCR 熒光定量試劑盒說明書配置反應體系后進行PCR 擴增反應。miR-144 引物序列:上游引物5′-GGGAGATCAGAAGGTGATT-3′,下游引物5′-GTGCAGGGTCCGAGGT-3′;U6引物序列:上游引物5′-CTGGCTTCGGCAGCACA- 3 ′,下游引物5′-AACGCTTCACGAATTTGCGT-3′;HOXA10 引物序列:上游引物5′-TCACGGCAAAGAGTGGTC- 3 ′,下游引物5′-AGTTTCATC CTGCGGTTCTG-3′;GAPDH 引物序列:上游引物5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物5′-GA AGATGGTGATGGGATTTC-3′。以2-△△Ct代表miR-144 和HOXA10 mRNA 的相對表達量,重復檢測3次,取平均值。觀察人結腸癌細胞和人結腸上皮細胞miR-144、HOXA10 mRNA 表達變化,選擇miR-144 表達量最低的結腸癌細胞株進行后續實驗。
1.3 miR-144 對人結腸癌細胞株增殖、侵襲及遷移的影響觀察
1.3.1 HCT116 細胞分組及miR-144 mimics、質粒轉染方法 取對數生長期HCT116 細胞接種于6孔培養板,等待細胞融合度70%~80%時,將細胞分為3 組:3 組、2 組、1 組用脂質體轉染試劑Lipofectamine 2000 說明書分別轉染NC-mimics、miR-144 mimics、miR-144 mimics + pcDNA3.1-HOXA10(上調HCT116 細胞HOXA10 表達,逆轉miR-144 對靶基因HOXA10表達的抑制作用),轉染24 h時收集細胞進行后續實驗。
1.3.2 各組細胞增殖情況觀察 采用CCK-8法,轉染24 h時取各組細胞,接種于96孔板,細胞密度:1×103/孔,每組4 個復孔,分別于培養0、24、48、72 h 時每孔加入10 μL的 CCK-8溶液,繼續孵育2 h,在酶標儀下測算450 nm 處的光密度OD 值。以OD 值代表各組細胞的增殖活力,重復測算3次,取平均值。
1.3.3 各組細胞侵襲、遷移情況觀察 采用Transwell 侵襲、遷移實驗。轉染24 h 時取各組細胞,侵襲實驗時首先用無血清培養液稀釋的Matrigel 膠均勻涂抹至Transwell 小室上室的濾膜面,再在Transwell 小室上室內加入無血清培養液重懸的200 μL HCT116 單細胞懸液,下室加入600 μL 含血清的細胞培養液,繼續培養24 h,去除Transwell小室上室濾膜面未能穿過濾膜的細胞,固定、染色。在高倍倒置顯微鏡觀察并計數。遷移實驗時,Transwell 小室上室的濾膜面不涂抹Matrigel 膠,其余操作同侵襲實驗。實驗均重復測算3次,取平均值。
1.3.4 各組細胞miR-144 及HOXA10 蛋白檢測 轉染24 h 時取各組細胞,采用qRT-PCR 法檢測各組細胞miR-144,所有操作均同“1.2”。轉染24 h時采用Western Blotting 法檢測各組細胞HOXA10蛋白。收集細胞并提取總蛋白,取40 μg 蛋白樣品制備電泳凝膠,電泳、轉膜,5%脫脂奶封閉,分別加入一抗HOXA10(1:1 000)和GAPDH(1:1 000),4 ℃孵育過夜,洗膜3 遍后,加入二抗(1:1 000),室溫孵育1 h 后,加入化學發光試劑顯影。采用Image J 軟件測定目的蛋白的條帶灰度值,以目的蛋白的條帶灰度值與內參GAPDH 灰度值比值作為目的蛋白的相對表達量。實驗重復測算3次,取平均值。
1.4 HCT116 細胞中miR-144 及HOXA10 蛋白的靶向關系驗證 采用雙熒光素酶報告基因實驗。取對數生長期HCT116 細胞,待細胞融合度70%~80%時將細胞分為4 組:A 組先后加入HOXA10-WT、miR-144 mimics 轉染,B 組先后加入HOXA10-WT 、NC-mimics 轉染,C 組先后加入HOXA10-MUT、miR-144 mimics 轉染,D 組先后加入HOXA10-MUT 、NC-mimics 轉染,所有操作均嚴格按照Lipofectamine 2000 說明書進行,轉染24 h 時后收集細胞,應用熒光素酶檢測試劑測算各組細胞的相對熒光素酶活性。實驗重復測算3 次,取平均值。
1.5 統計學方法 采用SPSS 22.0 統計軟件進行數據處理。正態性檢驗采用Shapiro-Wilk 檢驗,符合正態分布的計量資料以-x± s 表示,兩組間數據比較采用獨立樣本t檢驗,多組間數據比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。P<0.05為差異具有統計學意義。
2 結果
2.1 人結腸癌細胞株及FHC 細胞miR-144、HOXA10 mRNA 相對表達量比較 HCT116、SW480、CL-11及FHC細胞中miR-144相對表達量分別為0.33 ± 0.09、0.57 ± 0.07、0.46 ± 0.10、1.03 ±0.05,與FHC 比較,HCT116、SW480、CL-11 細胞miR-144 相對表達量低(P均<0.05)。HCT116、SW480、CL-11 及FHC 細胞中HOXA10 mRNA 相對表達量分別為1.87 ± 0.13、1.58 ± 0.10、1.55 ±0.09、0.99 ± 0.06,與FHC 比較,HCT116、SW480 及CL-11 細胞HOXA10 mRNA 相對表達量高(P均<0.05)。
2.2 各組HCT116細胞OD 值比較 培養0、24、48、72 h時各組HCT116細胞OD值比較見表1。
表1 培養不同時間各組HCT116細胞OD值比較(±s)
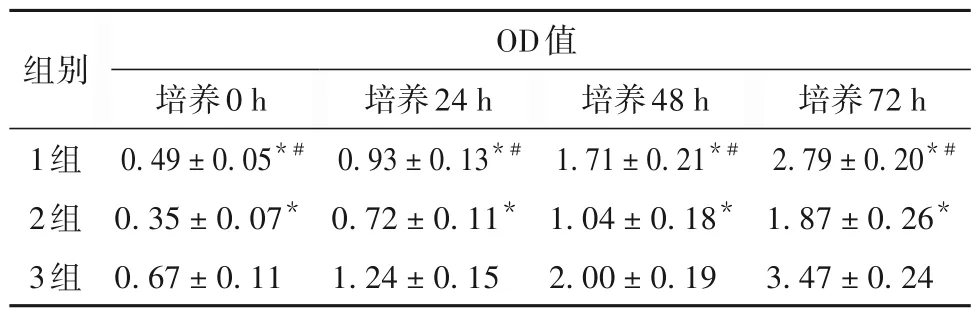
表1 培養不同時間各組HCT116細胞OD值比較(±s)
注:與3組比較,*P<0.05;與2組比較,#P<0.05。
組別1組2組3組OD值培養72 h 2.79 ± 0.20*#1.87 ± 0.26*3.47 ± 0.24培養0 h 0.49 ± 0.05*#0.35 ± 0.07*0.67 ± 0.11培養24 h 0.93 ± 0.13*#0.72 ± 0.11*1.24 ± 0.15培養48 h 1.71 ± 0.21*#1.04 ± 0.18*2.00 ± 0.19
2.3 各組侵襲和遷移細胞數比較 轉染24 h 時各組侵襲和遷移細胞數比較見表2。
表2 各組侵襲和遷移細胞數比較(個,±s)

表2 各組侵襲和遷移細胞數比較(個,±s)
注:與3組比較,*P<0.05;與2組比較,#P<0.05。
組別1組2組3組侵襲細胞數49 ± 11*#26 ± 10*68 ± 17遷移細胞數52 ± 10*#31 ± 12*73 ± 19
2.4 各組細胞miR-144 和HOXA10 蛋白相對表達量比較 1、2、3 組細胞miR-144 相對表達量分別為3.99 ± 0.24、4.09 ± 0.28、1.01 ± 0.05。與3 組比較,1、2 組細胞miR-144 相對表達量高(P均<0.05)。3 組、2 組和1 組細胞HOXA10 蛋白相對表達量分別為0.49 ± 0.10、0.21 ± 0.07、0.92 ± 0.12。與3 組比較,2 組HOXA10 蛋白表相對表達量低(P均<0.05);與2 組比較,1 組HCT116 細胞HOXA10 蛋白相對表達量高(P<0.05)。
2.5 各組細胞相對熒光素酶活性比較 A 組、B組、C 組、D 組HCT116 細胞的相對熒光素酶活性分別為0.54 ± 0.09、1.01 ± 0.04、0.99 ± 0.07、1.03 ±0.05。與B 組比較,A 組HCT116 細胞的相對熒光素酶活性低(P<0.05)。
3 討論
結腸癌是一種常見的消化道惡性腫瘤,在全球癌癥發病率和死亡率排名中,結腸癌分別位居第三和第四位。男性結腸癌患者多于女性, 結腸癌通常發生在直腸和乙狀結腸的交界處。盡管近年來人們對癌癥的診斷和治療進行了更深入的研究,但由于人們生活方式和飲食的改變,結腸癌患者的數量仍在增加,并且雖然近年結腸癌的治療方法有了一定的進步,但結腸癌患者的中位生存率仍然很低[8]。因此,探索結腸癌發生發展的相關因素,從而有效的預防治療結腸癌具有積極的意義。
惡性腫瘤細胞的無限增殖、凋亡受限以及侵襲轉移是惡性腫瘤患者死亡的主要原因。研究發現miRNA 通過直接介導其靶基因的表達水平,與細胞增殖、細胞周期、細胞凋亡和腫瘤發生進展等各種生物學過程密切相關。近年來,由于miRNA 對關鍵癌基因和抑癌基因表達的控制,miRNA 已被證明在癌癥中發揮關鍵作用[9]。因此篩選腫瘤發生發展的關鍵特異性miRNA 對腫瘤的特異性靶向治療具有重要的作用。在結腸癌細胞和組織中存在很多miRNA 的差異表達,并且發揮著促癌基因或抑癌基因的作用。結腸癌患者血液中miRNA 表達水平的變化,可能作為特異性的腫瘤標志物應用于結腸癌的早期篩查及診斷。逆轉結腸癌細胞中異常表達的miRNA,可能為結腸癌的治療提供新的思路。CHEN 等[10]通過qRT-PCR 檢測了164 例結腸癌患者血清標本,發現結腸癌患者血清中miR-19-5p 水平顯著降低,與患者臨床分析及預后有關,可能作為結腸癌患者早期診斷和判斷預后的生物學標志物。有研究[11]報道,miR-876-3p能夠抑制結腸癌的進展,并且與患者預后有關。ZHU 等[12]報道miR-3653 通過調控Zeb2抑制結腸癌細胞的侵襲轉移及EMT。
miR-144 是一種高度保守的非編碼RNA,是腫瘤相關miRNA 家族成員之一,其基因定位于人染色體17q11.2 上,最早其被發現為紅細胞譜系存活和成熟過程必不可少的基因。MUSHTAQ 等[13]報道miR-144 在胃癌細胞表達異常下降,能夠通過下調激活增強子結合蛋白4 抑制胃癌細胞增殖和侵襲。在肺癌[14]、前列腺癌[15]、乳腺癌[16]、骨肉瘤[17]等多數惡性腫瘤組織和細胞中也發現miR-144 表達異常降低,發揮著類似抑癌基因的作用。但在食管癌[18]和鼻咽癌[19]等少部分惡性腫瘤組織和細胞中發現miR-144 異常升高,發揮著癌基因的作用,提示miR-144 具有明顯的異質性,在不同的腫瘤中通過不同的分子通路發揮著不同的作用。至今,miR-144 在結腸癌發病中的作用的研究較少,并且具體作用機制尚不完全清楚。本研究通過qRTPCR檢測人結腸癌細胞株HCT116、SW480、CL-11和永生化正常人結腸上皮細胞株FHC中miR-144的表達水平發現,HCT116、SW480、CL-11 細胞中miR-144表達明顯低于FHC,提示miR-144在結腸癌中可能起著抑癌基因的作用。為了進一步驗證miR-144在結腸癌發生發展中可能的作用,我們選擇miR-144 表達水平最低的HCT116 細胞作為后續研究對象,上調HCT116 細胞中miR-144 的表達后發現HCT116 細胞的增殖活性、遷移及侵襲穿膜細胞數均明顯降低,提示miR-144 能夠抑制結腸癌細胞的增殖活性、遷移及侵襲能力從而參與其發生進展,起著抑癌基因的作用。
一項肺腺癌研究[6-7]發現,miR-144 能夠靶向調控HOXA10 基因表達,發揮抑癌基因作用。HOXA10 是一種高度保守的基因,屬于同源盒基因家族成員。HOXA10基因與人類多種腫瘤的發生進展有關,在多種腫瘤細胞和組織中表達異常升高,作為癌基因發揮作用。HOXA10 通過調節TGFB2/Smad/METTL3信號通路,介導上皮間質轉化促進胃癌細胞的轉移[20]。在食管癌的相關研究[21]中發現,HOXA10 通過激活p38/ERK 信號通路促進食管癌細胞增殖并抑制其凋亡。已有研究報道結腸癌組織中HOXA10表達異常升高[5,22],但HOXA10在結腸癌中作用的上下游機制機制尚不清楚。本研究通過雙熒光素酶報告基因證實,miR-144 可以與HOXA10基因的3′UTR區特異性結合從而使其熒光素酶活性明顯降低,并且上調miR-144 的HCT116 中HOXA10蛋白的表達水平顯著降低,提示miR-144 能夠靶向調控HOXA10 基因。進一步研究發現轉染過表達HOXA10 質粒載體至高表達miR-144 的HCT116 細胞后,伴隨著細胞中HOXA10表達水平的增高,腫瘤細胞的增殖活性、遷移和侵襲能力也明顯升高,提示過表達HOXA10 能夠部分逆轉miR-144 對HCT116細胞增殖活性、遷移和侵襲能力的抑制作用,證實miR-144 在結腸癌發生進展中的抑制作用,與其對靶基因HOXA10的靶向調控有關。
綜上所述,結腸癌細胞中miR-144 低表達、HOXA10 mRNA 高表達。miR-144 可抑制結腸癌細胞的增殖、遷移及侵襲。miR-144 可能通過靶向抑制細胞HOXA10表達,抑制結腸癌細胞的增殖、遷移及侵襲等生物學表型。miR-144 可能作為結腸癌的分子靶向治療靶點,但其在結腸癌發生發展中的具體作用機制今后尚有待于進一步研究。

