3種測試片對煙用香精香料菌落總數檢測的適用性評價
葉長文,周 蕓,李 棟,崔中月,趙婉霞,黃 闊,胡中軍,周 曉*
1.中國煙草總公司鄭州煙草研究院,鄭州高新技術產業開發區楓楊街2 號 4500012.廣西中煙工業有限責任公司技術中心,南寧市西鄉塘區北湖南路28 號 530001
煙用香精香料種類繁多,組分復雜,富含微生物生長所需營養成分,易受污染變質[1-4]。菌落總數是影響煙用香精香料質量穩定的重要因素之一[5],也是評價煙用香精香料衛生狀況的重要指標。目前,食品樣品的菌落總數檢測常參照國家標準GB 4789.2—2022[6]中的平板計數法或測試片法進行。平板計數法為傳統的菌落總數檢測方法,但該方法操作復雜,且對檢測環境要求較高[7]。測試片法是以凝膠或無紡布為培養基載體代替瓊脂培養微生物的一種新型檢測方法,具有操作快速、易于判讀、準確性好等優點[8]。采用測試片法檢測各類食品樣品菌落總數的研究已有報道[9-10]。王曦等[11]采用測試片法與平板計數法檢測了30個糕點樣品的菌落總數,發現2種方法檢測的菌落總數無顯著差異;林杰等[12]采用測試片法和平板計數法分別檢測了沙拉、茶葉、明蝦等15 種食品樣品的菌落總數,發現2 種方法的菌落總數檢測結果無顯著差異;趙立冬等[13]采用測試片法與平板計數法對129 個熟肉樣品的菌落總數進行檢測,發現測試片法與平板計數法的檢測結果一致性較好。然而,測試片法檢測煙用香精香料菌落總數的相關研究還鮮見報道。為此,使用3種測試片以及PCA培養基檢測標準菌株樣品、菌落總數定量質控樣品和煙用香精香料樣品的菌落總數,評價3種測試片檢測煙用香精香料菌落總數的適用性,旨在為測試片用于煙用香精香料菌落總數檢測提供依據。
1 材料與方法
1.1 材料、試劑和儀器
供試的17株標準菌株(表1)購自中國食品藥品檢定研究院,為菌落總數測定過程中常見的可培養細菌[7,14],也是變質煙用香精香料中常見的優勢菌[2,4]。菌落總數定量質控樣品(QC-FD-002)購自中國檢驗檢疫科學研究院。標準菌株和菌落總數定量質控樣品均保存于-20 ℃冰箱。代表性煙用香精香料樣品采集于廣西中煙工業有限責任公司倉庫,共計56個。其中,1~53號樣品為煙用香料(含單體香料、香基、浸膏、酊劑、凈油等),54~56號樣品為煙用香精。煙用香精香料樣品均保存于4 ℃冰箱。

表1 標準菌株名稱和編號Tab.1 Name and number of standard strains
3M PetrifilmTM菌落總數測試片(3M-AC 測試片,3M 中國有限公司);DNP 菌落總數測試片[DNP-AC測試片,安科生物制品(上海)有限公司];MC-Media 菌落總數測試片(MC-AC 測試片,德國Merck公司)。
平板計數瓊脂(PCA)培養基和腦心浸出液肉湯(BHI)(北京陸橋技術有限公司);無菌磷酸鹽緩沖液(PBS,pH=7.2,山東微色譜生物科技有限公司)。
Bio II Advance 生物安全柜(西班牙Telstar 公司);BagMixer 400 均質器(法國Interscience 公司);CTHI-250B2H 恒溫恒濕箱[施都凱儀器設備(上海)有限公司];CL-40M 高壓滅菌鍋(日本ALP 公司);ZQZY-C58F 恒溫振蕩培養箱(上海知楚儀器有限公司)。
1.2 方法
1.2.1 標準菌株樣品菌懸液制備
分別挑取17株標準菌株的單菌落接種于10 mL BHI培養基中,36 ℃、180 r/min振蕩培養24 h進行活化。取10 μL活化后的菌液加入含有9 mL無菌磷酸鹽緩沖液的試管中,充分混勻后對所得液體進行梯度稀釋,得到7個稀釋梯度(10-1、10-2、10-3、10-4、10-5、10-6、10-7)的標準菌株菌懸液。
1.2.2 菌落總數定量質控樣品菌懸液制備
參照菌落總數定量質控樣品說明書制備菌懸液原液。使用無菌磷酸鹽緩沖液對菌懸液原液進行梯度稀釋,得到4個稀釋梯度(10-2、10-3、10-4、10-5)的菌落總數定量質控樣品菌懸液。
1.2.3 煙用香精香料樣品勻液制備
稱取25 g或量取25 mL煙用香精香料樣品放入無菌均質袋中,加入225 mL無菌磷酸鹽緩沖液后使用拍擊式均質器(2 擋)均質1~2 min。將所得液體進行梯度稀釋,得到4 個稀釋梯度(10-1、10-2、10-3、10-4)的煙用香精香料樣品勻液。
1.2.4 菌落總數檢測方法
1.2.4.1 平板計數法
在無菌條件下分別取10-1~10-7稀釋梯度的標準菌株菌懸液、10-2~10-5稀釋梯度的菌落總數定量質控樣品菌懸液和10-1~10-4稀釋梯度的煙用香精香料樣品勻液1 mL滴至無菌培養皿上,然后加入15~20 mL冷卻至46~50 ℃的PCA培養基,轉動培養皿使其充分混勻,每個稀釋梯度設置3次重復。待瓊脂凝固后將培養皿倒置,(36±1)℃培養48 h后觀察PCA培養基上的菌落形態,并進行菌落計數,參照文獻[6]計算菌落總數。
1.2.4.2 測試片法
在無菌條件下分別取10-1~10-7稀釋梯度的標準菌株菌懸液、10-2~10-5稀釋梯度的菌落總數定量質控樣品菌懸液和10-1~10-4稀釋梯度的煙用香精香料樣品勻液1 mL滴至測試片中央,每個稀釋梯度重復3次。(36±1)℃培養24 h后觀察MC-AC測試片上的菌落形態,并進行菌落計數;在培養48 h后觀察3M-AC和DNP-AC測試片上的菌落形態,并進行菌落計數。測試片法的詳細操作和菌落總數的計算參照3M-AC、DNP-AC和MC-AC測試片使用說明書進行。
1.2.5 數據統計分析
使用Excel 軟件將菌落總數轉換為10 的對數值,再用SPSS 24.0軟件對標準菌株和煙用香精香料樣品的菌落總數對數值進行Pearson相關性分析,并對煙用香精香料的菌落總數對數值進行配對t檢驗。
菌落總數定量質控樣品的結果通過計算Z比分數進行評價。Z比分數計算公式:
式中:x為實驗室菌落總數檢測結果對數值,lgCFU/mL;X為特性值;s為能力評定標準差。本實驗中菌落總數定量質控樣品的特性值和能力評定標準差分別為3.370 lgCFU/mL 和0.182 lgCFU/mL。當|Z|≤2時,評價結果為“滿意”;2<|Z|<3時,評價結果為“有問題”;|Z|≥3時,評價結果為“不滿意”。
2 結果與分析
2.1 標準菌株樣品菌落形態和菌落總數
2.1.1 標準菌株樣品菌落形態
17株標準菌株在PCA培養基和3種測試片上的菌落形態描述見表2。在3種測試片上,所有標準菌株菌落均為紅色;在PCA培養基上,除金黃色葡萄球菌(Staphylococcusaureus)為黃色外,其他標準菌株菌落均為白色。在PCA培養基上培養48 h后,同一標準菌株在PCA培養基表面和內部的菌落大小和形狀差異較大。17 株標準菌株在3M-AC 測試片上培養48 h后,枯草芽胞桿菌(Bacillussubtilis)、解淀粉芽胞桿菌(Bacillusamyloliquefaciens)和多黏類芽胞桿菌(Paenibacilluspolymyxa)的菌落有明顯的液化現象(圖1),影響計數,其他標準菌株菌落一般為圓形或近似圓形,菌落形態清晰,便于計數。在DNP-AC測試片上培養48 h后,標準菌株菌落一般為圓形,菌落形態清晰,便于計數。在MC-AC測試片上培養24 h后,標準菌株菌落形狀多不規則,但菌落形態清晰,無液化現象,便于計數。

圖1 3M-AC測試片上有明顯液化現象的標準菌株Fig.1 Standard strains with visible liquefaction on 3M-AC count plates
2.1.2 標準菌株菌落總數檢測結果
表3為17株標準菌株的菌落總數和菌落總數對數值。其中,大腸桿菌(Escherichiacoli)、腸沙門氏菌腸亞種鼠傷寒血清型(Salmonellaentericasupbsp.entericaserovarTyphimurium)、塞氏檸檬酸桿菌(Citrobactersedlakii)、鮑曼不動桿菌(Acinetobacter baumnnii)、金黃色葡萄球菌(Staphylococcusaureus)和緩慢葡萄球菌(Staphylococcuslentus)6株標準菌株的3種測試片與PCA培養基菌落總數檢測結果均為同一數量級;蠟樣芽胞桿菌(Bacilluscereus)的3M-AC 和DNP-AC 測試片菌落總數檢測結果與PCA培養基菌落總數檢測結果存在2個數量級的差異;蘇云金芽胞桿菌(Bacillusthuringiensis)的3M-AC測試片菌落總數檢測結果與PCA培養基菌落總數檢測結果存在2個數量級的差異。由圖2可見,PCA培養基與3M-AC、DNP-AC和MC-AC測試片的菌落總數對數值呈極顯著(P<0.01)正相關。其中,MC-AC測試片的菌落總數對數值與PCA培養基的菌落總數對數值相關性(R2=0.997 7,P<0.01)最好。
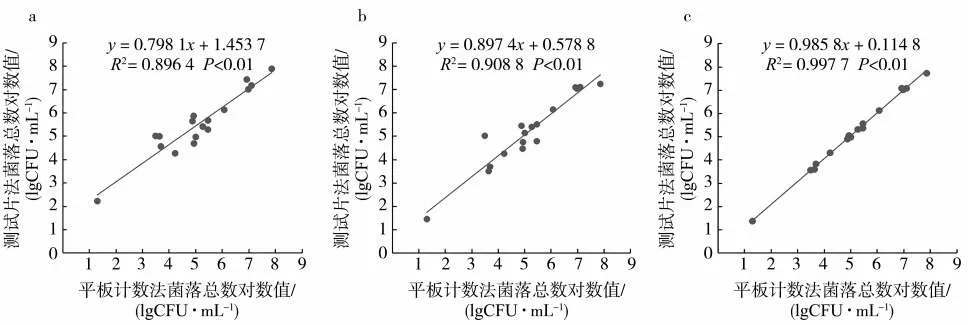
圖2 不同檢測方法標準菌株菌落總數對數值的相關性分析Fig.2 Correlation analysis between logarithmic values of aerobic plate counts of standard bacterial strains obtained by different methods
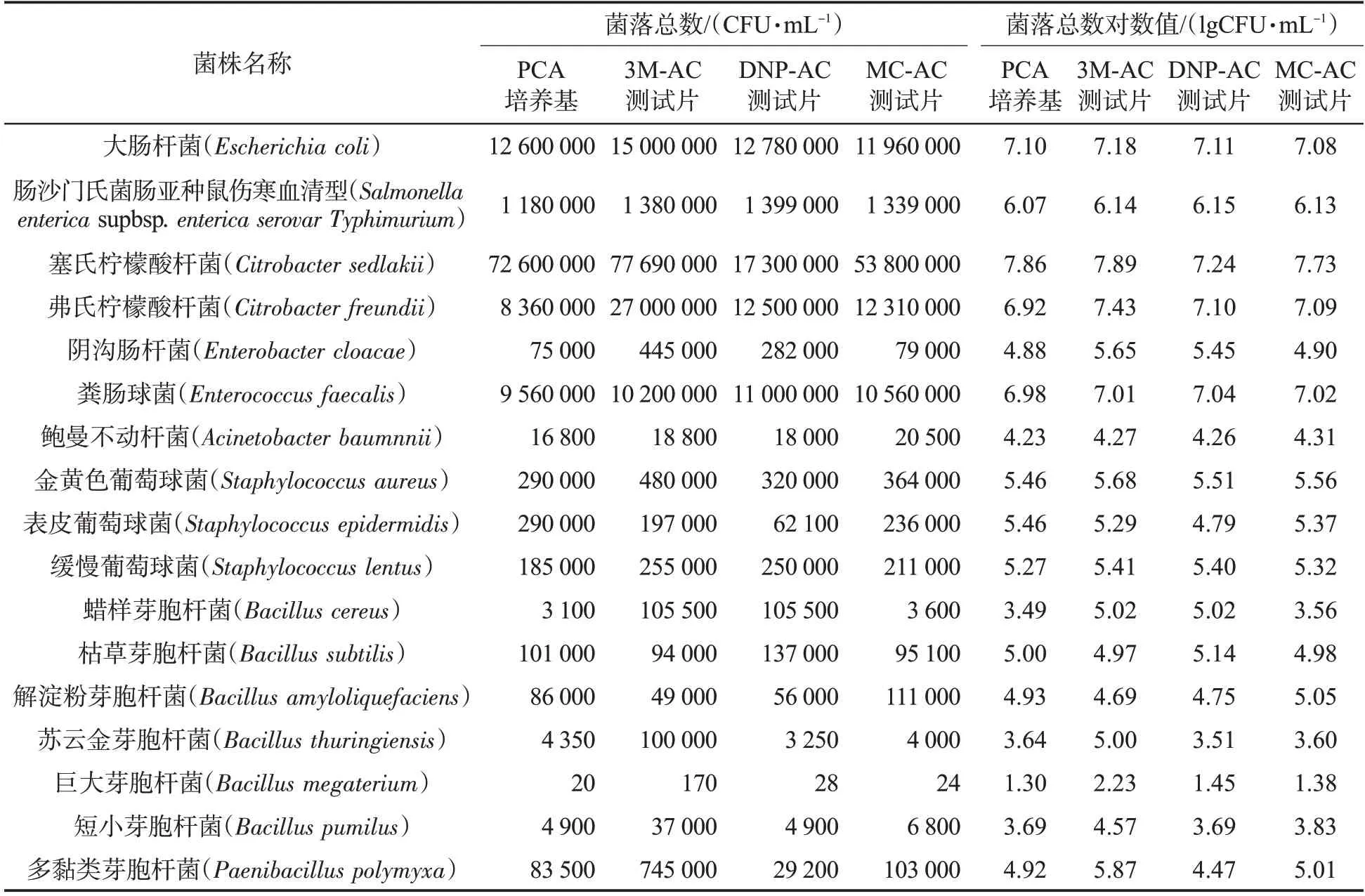
表3 標準菌株的菌落總數和菌落總數對數值Tab.3 Aerobic plate counts and the logarithmic values of aerobic plate counts of standard strains
2.2 定量質控樣品菌落總數檢測結果和評價
使用PCA培養基和3種測試片對菌落總數定量質控樣品進行檢測,PCA 培養基、3M-AC、DNP-AC和MC-AC測試片的菌落總數對數值如表4所示。Z比分數的評價結果均為“滿意”。
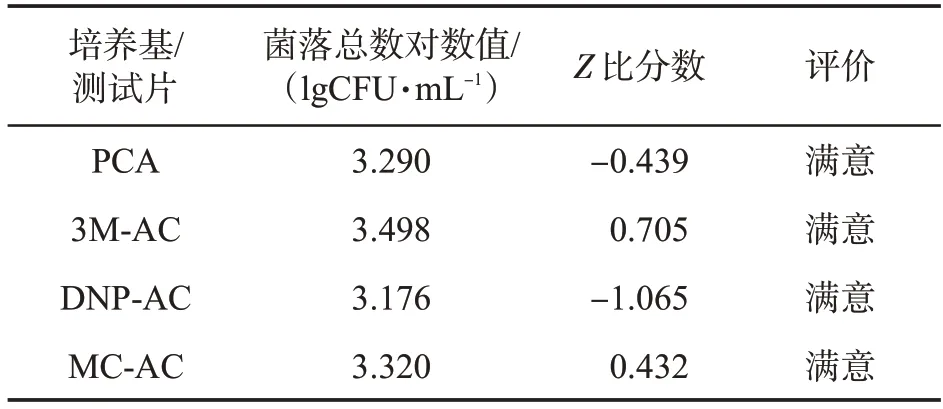
表4 菌落總數定量質控樣品檢測結果和評價Tab.4 Determination results and evaluation of quality control sample for aerobic plate count
2.3 煙用香精香料樣品菌落總數檢測結果
使用PCA培養基和3種測試片分別檢測56個煙用香精香料樣品的菌落總數,部分樣品檢測結果見表5。其中,39個樣品的菌落總數小于10 CFU/mL(g),17 個樣品的菌落總數大于10 CFU/mL(g)。由圖3可見,采用測試片法和平板計數法檢測煙用香精香料樣品菌落總數,2種方法的菌落總數對數值呈正相關。其中,MC-AC測試片與PCA培養基的菌落總數對數值相關性(R2=0.922 8,P<0.01)最好。煙用香精香料樣品菌落總數對數值配對t檢驗結果(表6)表明,PCA 培養基與3 種測試片的菌落總數對數值差異均不顯著(P>0.05)。
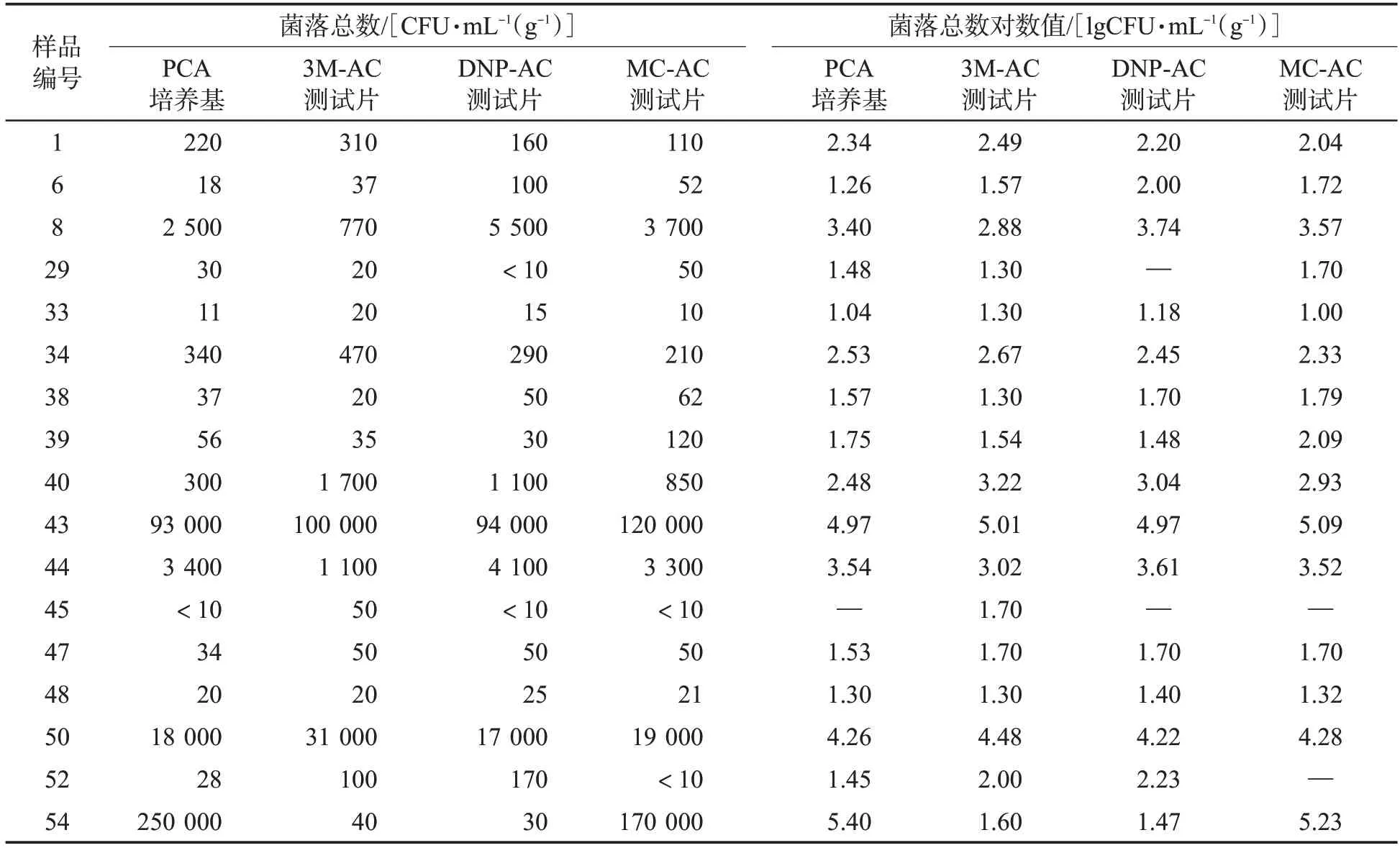
表5 煙用香精香料樣品的菌落總數和菌落總數對數值①Tab.5 Aerobic plate counts and logarithmic values of aerobic plate counts of tobacco flavor samples

表6 煙用香精香料樣品菌落總數對數值配對t檢驗①Tab.6 Paired t-test for logarithmic values of aerobic plate counts of tobacco flavor samples
2.4 平板計數法和測試片法操作過程比較
由表7可見,相比平板計數法,在前期準備時,測試片法無需清洗培養皿和配制培養基。在接種樣品勻液時,平板計數法將樣品勻液滴至培養皿后需傾注PCA培養基(46~50 ℃),而測試片法只需滴加樣品勻液即可。其中,樣品勻液滴至3M-AC測試片中央后,需用壓板將樣品勻液壓至規定大小,操作不當會導致樣品勻液接種區大小不一致,影響判讀,而樣品勻液滴至MC-AC 和DNP-AC 測試片中央后無需壓板按壓,樣品勻液因毛細管作用將自動擴散至測試片的整個接種區。在培養過程中,平板計數法使用的培養皿所占空間較大,而測試片體積小,可堆疊,移動方便;PCA 培養基、3M-AC 和DNP-AC 測試片的培養時間均為48 h,而MC-AC測試片的培養時間為24 h。在結果判讀時,PCA 培養基上的菌落顏色和培養基接近,部分菌落較小,難以觀察和計數,而測試片上的菌落為紅色,菌落清晰,便于計數,但當3M-AC測試片上出現明顯的液化現象時,可能會影響菌落計數。

表7 平板計數法和測試片法的操作過程Tab.7 Procedures of plate count method and count plate method
綜上,在進行菌落總數檢測時,測試片法比平板計數法更簡便、快速。其中,使用MC-AC 測試片進行菌落總數檢測的前期準備、樣品勻液接種和培養過程耗時均最短。
3 討論
3 種測試片與PCA 培養基的計數結果無顯著(P>0.05)差異,這與徐蕾蕊等[14]和孫霞等[15]的研究結果一致。枯草芽胞桿菌(Bacillussubtilis)、解淀粉芽胞桿菌(Bacillusamyloliquefaciens)和多黏類芽胞桿菌(Paenibacilluspolymyxa)在3M-AC 測試片上菌落邊緣模糊,液化現象明顯,這與謝范英[7]和王杰偉等[16]的研究結果一致。液化現象的產生可能是因為這些菌株的代謝能力較強,分解了測試片中的凝膠。在使用PCA 培養基和3 種測試片對煙用香精香料菌落總數進行檢測時,發現54號樣品在PCA培養基上的檢測結果比3M-AC 和DNP-AC 測試片高4 個數量級,這與張建軍等[9]報道的3M-AC 測試片和PCA 培養基檢測同一濃縮果汁樣品時,PCA 培養基上的菌落總數比測試片上菌落總數高的結果相似。
4 結論
17 株標準菌株中的枯草芽胞桿菌(Bacillus subtilis)、解淀粉芽胞桿菌(Bacillusamyloliquefaciens)和多黏類芽胞桿菌(Paenibacilluspolymyxa)在3M-AC 測試片上有明顯的液化現象,其余標準菌株在PCA 培養基和3 種測試片上的菌落形態均較清晰,便于計數。標準菌株3種測試片的菌落總數對數值與PCA 培養基的菌落總數對數值呈極顯著(P<0.01)正相關。對菌落總數定量質控樣品的PCA 培養基與3 種測試片的菌落總數對數值進行Z比分數評價,評價結果均為“滿意”。煙用香精香料樣品的3種測試片與PCA培養基的菌落總數對數值間差異不顯著(P>0.05),且MC-AC 測試片與PCA 培養基的菌落總數對數值相關性(R2=0.922 8,P<0.01)最好。測試片法比平板計數法更簡便、快速。其中,使用MC-AC測試片檢測菌落總數耗時最短。

