多囊卵巢綜合征模型大鼠卵巢中結締組織生長因子及基質金屬蛋白酶-9的表達*
張璐 劉明盛 楊旭 李蘭
(成都市第五人民醫院·成都中醫藥大學附屬第五人民醫院婦產科,四川 成都 611130)
多囊卵巢綜合征作為臨床常見的一種內分泌系統疾病,育齡期女性作為該疾病的高發群體,發病幾率高達10%,近年來有上升趨勢[1]。患者伴隨閉經、肥胖、不孕以及雙側卵巢發生多囊性增大等臨床癥狀,患者需面臨較為嚴重的身心健康壓力[2]。國內外針對該疾病的研究資料中指出,在卵泡發育、成熟、排卵、三黃體形成退化等一系列過程中,與細胞外基質(ECM)之間存在密切關聯性,其中基質金屬蛋白酶-9(Matrix metalloproteinase-9,MMP-9)作為特殊的膠原酶,發揮降解IV型膠原的功能[3],膠原又是ECM的主要組成之一。另外研究資料針對結締組織生長因子(Connective tissue growth factor,CTGF)進行分析發現,該物質對ECM的形成也發揮重要作用[4]。研究表明MMP-9和CTGF均為卵巢局部調節因子,但是目前針對多卵巢綜合征與上述兩種因子之間的關聯性的相關研究并不多見[5]。本研究擬采用Poresky試驗法制作多囊卵巢綜合征大鼠模型進行對照分析,借助測定并深度對比分析試驗對象的促黃體生成激素(Luteinizing hormone,LH)、促卵泡激素(Follicle-stimulating hormone,FSH)、雌二醇(E2)、垂體泌乳素(PRL)、睪丸素性等激素含量及CTGF和MMP-9含量來探討這兩種因子在多囊卵巢綜合征中的作用。
1 材料與方法
1.1 實驗動物 選擇52只6周齡、規律動情周期的健康SPF級SD雌性大鼠。隨機分為對照組及模型組,每組26只。進行實驗前兩組大鼠均放置在溫度以及濕度適宜的同等環境內,飲水、飲食等環境一致。實驗所有項目均符合動物倫理要求以及對應的實驗管理要求(AF/54/2020-02.3)。
1.2 主要實驗試劑 LH放免試劑盒(天津中新科炬生物制藥公司);FSH放免試劑盒(上海滬宇生物科技有限公司);E2放免試劑盒(上海滬宇生物科技有限公司);PRL放免試劑盒(天津中新科炬生物制藥有限公司);睪丸素放免試劑盒(天津中新科炬生物制藥有限公司);CTGF一抗(武漢博士德生物工程公司);CTGF二抗/三抗(北京中杉公司);MMP-9一抗/二抗/三抗(北京中杉公司);免疫組化試劑盒(PV-9000)(北京中山金橋生物科技有限公司)。
1.3 造模方法 構建滿足實驗需求的模型大鼠:對照組與模型組造模應用Poresky法進行;對照組大鼠每日灌胃濃度為1%的羧甲基纖維素,連續灌胃21 d,該段時間內每天進行陰道涂片以明確該組大鼠的動情周期是否存在變化。模型組大鼠先將來曲唑溶解至濃度為1%的羧甲基纖維素后再行灌胃給藥操作,該過程需注意給藥計量控制為1 mg/kg,精確完成操作,時間為21 d。見圖1。

圖1 大鼠灌胃示意圖
1.4 造模成功的檢測標準 模型大鼠制作期間,兩組大鼠需同等飼養環境下,自由飲食,灌胃期間需每周周六對其體重、血清LH以及胰島素情況進行測定。一旦所測定指標出現異常,并且實驗個體的空腹血糖水平出現上升趨勢(測定參照指標為>6 mM/L時),尿糖量也出現一定波動(>4.7 mM/L),則表明本次實驗所需的樣本依照相關文獻研究標準,滿足實驗要求[5],即所需要的多囊卵巢綜合征大鼠模型制作成功。
1.5 標本采集 當模型組大鼠動情周期發生變化且連續出現間期時,開始標本采集,對照組在其間期采集標本。具體方法如下:①21 d最后1次完成灌胃操作后需對所有實驗大鼠進行禁食干預,時間為12 h,隨后以缺血法處死實驗個體,完成操作后立即采集其5 mL的心臟血液,并2 000 r/min離心操作后取上層血清,在零下40 ℃保存備用。②隨后摘取各組實驗個體的子宮及卵巢,完成稱重操作,做好個體記錄后,對卵巢進行剖開操作,操作時需注意沿長徑方向,隨后以10%福爾馬林固定備用。
1.6 觀察指標及測量方法
1.6.1 放射免疫法(RIA) 測定LH、FSH、E2、PRL和睪丸素等指標對模型大鼠內分泌改變情況,并對其進行評價。切片制備和組織學觀察:修剪卵巢組織并行石蠟包埋處理,以4 μm厚度進行切片并進行HE染色,具體方法如下:①脫蠟:切片放置入烘箱中完成烘干操作,溫度調節為60 ℃,時間設定為0.5 h,完成烘干后將樣本拿出快速放置在二甲苯溶液中,浸泡15 min后將切片放置在新鮮的二甲苯溶液中完成浸泡處理,時間設定為15 min,脫蠟操作完成。②水化:切片放入無水乙醇Ⅰ后取出放置進入無水乙醇Ⅱ,并以此按照95%、90%、80%、70%的順序放置進乙醇溶液中,時間為5 min ,浸泡完成后需放入自來水中完成沖洗,沖洗時間設定為3 min。③蘇木素染色:蘇木素染料浸泡染色,15 min,自來水沖洗3 min。④伊紅染色:伊紅染料浸泡染色,2 min,自來水沖洗3 min。⑤脫水:依次放在80%乙醇中,30 s,95%(Ⅰ)、95%(Ⅱ)、100%(Ⅰ)、100%(Ⅱ)乙醇各1 min。⑥透明:切片放入二甲苯Ⅰ、Ⅱ中各5 min。⑦封片:脫水后的切片需放置在平整的桌面上,待二甲苯揮發干后,在切片上滴加適量中性樹膠進行封片。⑧拍攝:待中性樹膠完全干燥后,借助倒置顯微鏡完成切片的觀察以及拍攝操作。
1.6.2 免疫組織化學法 測定卵巢組織中MMP-9和CTGF的表達,明確為陽性的切片劃分為陽性對照組,而PBS代替一抗為陰性對照對上述含量表達進行評定,觀察到胞漿組織內有棕黃色或者棕褐色的顆粒狀物質時判定為陽性,選擇合適角度進行拍照處理后,經過Biosens Digital Imaging System分析對其影像學的灰度值進行確定,具體方法如下:①脫蠟:與1.6.1中HE染色中的方法相同。②水化:與1.6.1中HE染色中的方法相同。③內源性酶滅活:切片滴加3% H2O2,室溫條件下,避光孵育10 min,去離子水清洗5 min ,重復3次。④抗原修復:切片放在檸檬酸鹽沖洗液中浸泡,微波爐加熱至沸騰,95 ℃保溫10 min,溶液冷卻至室溫用PBS清洗5 min ,重復3次。⑤封閉:取1x羊血清封閉液滴加于肺組織切片上,隨后將切片置于濕盒中,在37 ℃條件下孵育30 min。⑥孵育一抗:棄去封閉液,向組織切片上滴加一抗200 μL,切片組織放置在濕盒中,并將濕盒置于溫度為4 ℃的環境下完成孵育過夜。⑦復溫清洗:取出切片組織放置在恒溫箱中,將溫度設定為37 ℃,完成孵育操作,時間約為30 min,使用PBST清洗10 min,重復清洗3次。⑧孵育二抗過程:向組織上滴入熒光二抗,隨后將切片組織放置在濕盒中,調節好恒溫環境,在37 ℃條件下孵育3 h。⑨清洗:吸棄熒光二抗,使用PBST清洗10 min,重復清洗3次。⑩脫水、透明、封片方法HE染色相同。拍攝:使用顯微鏡進行切片觀察。

2 結果
2.1 造模成功動物數量及過程 本實驗共收集52只SD大鼠,根據不同灌胃給藥方法分為對照組和實驗組,并采用Poresky法進行造模,兩組每周6測定大鼠體重變化,持續3周,并評定造模效果。兩組大鼠在制作過程中未發生死亡和感染,結果顯示,52只大鼠造模成功。
2.2 實驗模型的改進 應用Poresky法進行造模,在此基礎上給予胃灌藥的同時給予皮下注射,將劑量下調,確保了造模成功率和縮短了給藥時間,且SD大鼠與人類發育機制相近,已被用于臨床各種疾病的造模實驗,且Poresky法方法造模穩定性較高。
2.3 兩組大鼠內分泌改變情況比較 模型組LH、PRL、睪丸素含量明顯高于對照組(P<0.05),FSH、E2明顯低于對照組(P<0.05),見表1。
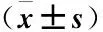
表1 兩組大鼠血清性激素分泌情況比較
2.4 兩組大鼠卵巢中CTGF的表達情況 統計切片結果顯示,CTGF在卵巢中卵泡基底膜、白膜、顆粒細胞和竇前卵泡卵泡膜胞漿中均有表達。但在多囊卵巢綜合征模型組卵巢組織中,竇前卵泡卵泡膜、卵泡基底膜中CTGF表達情況均有明顯變化,故本文只對兩者進行討論;其中模型組大鼠竇前卵泡卵泡膜胞漿中的CTGF表達量較對照組明顯偏高(t=4.260,P<0.05);在卵泡基底膜胞漿以及白膜中,模型組大鼠的CTGF表達量較對照組均有明顯升高(t=5.001,P<0.05;t=5.261,P<0.05),見圖2。

圖2 兩組大鼠卵巢組織中CTGF的表達情況
2.5 兩組大鼠卵巢組織中MMP-9的表達情況比較 研究發現MMP-9在卵巢顆粒細胞,卵泡基底膜,始基卵泡、白膜、竇前卵泡卵泡膜胞漿等組織液內均有表達,而實驗結果也顯示,PCOS大鼠模型組中并不是所有的卵巢組織內的MMP-9都會出現表達異常,只有黃體與卵泡基底膜中MMP-9表達情況均有明顯變化,故本文只對兩者進行討論;模型組MMP-9在黃體中的表達明顯高于對照組(P<0.05);卵泡基底膜內的MMP-9表達情況低于對照組(P<0.05),見表2。

表2 大鼠卵巢組織中MMP-9的表達情況分析
3 討論
多囊卵巢綜合征這一疾病在患者日常工作、生活中具有嚴重影響,不利于其正常生理活動,患者會伴隨不排卵、閉經等一些列生理變化,導致其無法正常受孕,不僅影響其身心健康,還會對其家庭和睦造成不良影響[6-8]。該病涉及廣泛病理和生理學改變,如遺傳、神經內分泌、物質代謝、卵巢局部調控等變化,因此該疾病的研究成為生殖內分泌研究人員重點關注項目[9-10]。大多數多囊卵巢綜合征患者的排卵功能異常,也有極少數患者伴隨稀少排卵,但是存在黃體功能異常等現象,因該疾病缺乏深度分析,針對疾病同卵泡發育以及排卵之間的關聯性尚處于待研究或研究狀態中[11-12]。本次實驗的主要目的就是通過構建大鼠多囊卵巢綜合征模型,深入研究樣本血清性激素水平的變化情況。有文獻報道[13-14]指出,CTGF及MMP-9在多囊卵巢綜合征中表達異常,可能是由不同分子機制引起的。本研究還深度分析CTGF、MMP-9在卵巢組織中的變化以及對應表達現狀,為該病發病機制的后續研究提供一定的參考,也可以為研究兩者背后的分子機制提供一個可以參考的實驗數據。
目前動物模型因其操作簡單、成功率高和重復性好等優點已被廣泛應用于臨床各項疾病實驗中,而使用大鼠和兔動物實驗較多[15]。本文選取52只SD雌性大鼠進行實驗,因大鼠造模較為穩定,生長速度快及繁殖能力強等優點,廣泛使用與生長發育的研究,且本文應用Poresky法有效提高了造模成功率,因此并未發現其他因素對恩賜研究數據以及研究結果的準確性產生的明顯影響[16]。研究發現,當多囊卵巢綜合癥大鼠造模成功后發現血清性激素含量發生較為明顯的變化,另外用藥期間研究對象體內的性激素水平與未用藥之前對比,也發生較為明顯的變化,因此分析研究樣本體內性激素與該疾病發生、發展存在明顯相關性[17-18]。本研究顯示模型組中PRL、LH和睪丸素等水平含量明顯較對照組升高(P<0.05),說明模型組中的睪丸素在由雄激素轉向雌激素時被阻斷,從而導致睪丸素蓄積,LH水平升高與睪丸素水平異常表達之間也可能存在一定聯系,PRL的升高會造成卵巢局部PRL水平增加,從而導致雄性激素向雌性激素的轉換變化。本研究還發現模型組中FSH和E2含量明顯較對照組下降,發生這種情況的因素可能與芳香化酶抑制劑造成雌激素合成速率降低有關[19-20]。
研究表明,神經細胞、上皮細胞和血管內皮細胞中均可分泌CTGF,此因子在成纖維細胞增殖變化以及有絲分裂過程中發揮重要的促進作用。有研究發現CTGF參與了ECM形成和多種病理過程,而這一因子的研究中,正常卵巢組織中的表達并未明了[21]。本研究發現,CTGF這一因子在黃體組織、白膜組織以及顆粒細胞組織、竇前卵泡膜等胞漿中均有不同程度的表達,竇前卵泡卵泡膜、卵泡基底膜中CTGF表達情有明顯變化,模型組各項表達含量高于對照組,說明CTGF的表達與該疾病發生、發展有聯系。且實驗發現FSH可抑制CTGF在卵巢組織中的表達,而本實驗FSH表達量明顯下降,這可能是該疾病大鼠卵巢組織中CTGF高表達的主要原因之一[22-23]。MMP-9屬于膠原酶,此指標在破骨細胞中表達量較高。研究發現MMP-9與細胞轉移和組織重建有明顯相關性,且在雌性動物體內發現MMP-9隨著生理周期的波動而變化[24-25]。本研究發現,MMP-9在竇前卵泡卵泡膜胞漿、顆粒細胞、始基卵泡和白膜中均有表達,但MMP-9在黃體和基底膜胞漿中的表達較其他細胞中的表達更加明顯,與對照組比較具有統計學意義(P<0.05)。
4 結論
卵巢中CTGF水平變化與該疾病中小卵泡過多表達或者排卵障礙之間存在一定關聯性,MMP-9則與多囊卵巢綜合征的排卵障礙之間存在關聯性。

