二氫楊梅素聯合小劑量VP16抗肺癌研究
郭娜娜,孫大永,馬明軒,張翔宇,左彥珍(.承德醫學院,河北 承德 067000;.承德市中心醫院放化療中心,河北 承德 067000)
肺癌是全世界發病率和死亡率最高的惡性腫瘤[1],五年生存率不足21.0%[2],其中非小細胞肺癌(nonsmall cell lung cancer,NSCLC)患者占85%[3]。近年來,由于吸煙、空氣污染等一系列因素的影響,肺癌的發病率還在不斷上升,每年肺癌新增病例占癌癥病例的18.74%[4],其中首診晚期肺癌的為84%[5],由于手術治療的效果欠理想,放化療成為中晚期NSCLC的首選治療手段,聯合化療是增強治療效果常用的治療方案,但存在毒副作用大、患者不耐受的缺陷,故制定減毒高效的聯合化療方案迫在眉睫。
二氫楊梅素(dihydromyricetin,DMY)又稱蛇葡萄素、白蘞素、福建茶素等,是一種二氫黃酮醇類化合物,大量存在于葡萄科蛇葡萄屬植物中,在藤茶中的量可以達到30%[6],民間常將其用于治療感冒、咳嗽。既往研究[7-9]表明DMY具有抗腫瘤、抗氧化、保護心血管、調節血糖、抗炎、保護神經系統、保護肝臟等藥理作用。現有研究[10-14]已證實:DMY 能夠通過改變細胞周期蛋白誘導細胞周期停滯在G2/M 期,抑制肝癌細胞增殖;通過SP-1 和NF-κB調節尿激酶纖溶酶原激活劑抑制人骨肉瘤細胞轉移;通過促進腫瘤細胞的凋亡,抑制腫瘤細胞的遷移和侵襲,增加腫瘤細胞對化療藥物的敏感性,從而降低化療毒副作用;DMY可下調survivin蛋白的表達,使已經對紫杉醇和阿霉素產生耐藥的卵巢癌細胞增敏,使卵巢癌細胞凋亡增加;DMY能有效調節磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路、NF-κB、p53 和內質網應激(ER應激)驅動的信號進而用于肺癌等癌癥的治療。以上研究結論提示DMY有望成為低毒高效的化療增敏劑,為抗癌聯合治療提供新思路。
本研究采用小劑量DMY 和小劑量VP16,初步探究DMY能否作為一種化療增敏劑在體外發揮增敏VP16 抗肺癌的作用及其機制,尋找低毒高效的聯合化療方案,減少化療藥物用量的同時降低其毒副作用,提高治療效果進而改善患者生存質量。
1 儀器與試藥
人非小細胞肺癌A549 細胞株(天津腫瘤醫院研究所)、RPMI1640 培養液(Gibco)、胎牛血清(Gibco)、0.25%胰酶溶液(含EDTA)(Sigma)、PBS緩沖液(HyClone);細胞培養箱(Thermo)、低速離心機(Thermo)、corning 培養皿(corning)、培養板(corning)、DMY(純度> 99%,北京恒元啟天化工技術研究院)、VP16、Tunel凋亡試劑盒(Roche)、倒置熒光顯微鏡、β-actin鼠抗人單克隆抗體(1 : 1000稀釋;華安生物)、Parp 兔抗人多克隆抗體(1 : 1000 稀釋;CST)、Caspase-3 兔抗人多克隆抗體(1 : 1000 稀釋;CST)、Cleaved Caspase-3兔抗人多克隆抗體(1 : 1000稀釋;CST)、Bax 鼠抗人單克隆抗體(1 : 1000 稀釋;Abcam)、山羊抗鼠二抗和山羊抗兔二抗(1 : 4000稀釋;Abcam)、RIPA裂解液(上海貝博)。
2 方法與結果
2.1 實驗方法
2.1.1 細胞培養取人非小細胞肺癌A549細胞加入含10%胎牛血清的1640完全培養基培養于培養皿中,置于恒溫37 ℃、5% CO2、飽和濕度的培養箱中培養。每1~2天更換一次培養基,PBS清洗,使用0.25%胰酶(含EDTA)消化傳代,取對數生長期狀態良好的細胞進行實驗。
2.1.2 檢測DMY對VP16治療A549細胞生長的影響作用MTT實驗確定單藥給藥濃度及時間(選取IC20濃度作為增敏單藥濃度),取對數生長期的A549 細胞用0.25%含EDTA胰酶消化制備細胞懸浮液,按照1×106·皿-1接種細胞,放入培養箱培養24 h,當細胞融合率達35%左右時,更換為含不同處理因素的培養基:對照組(完全培養基)、DMY 組(含DMY 80 μg·mL-1完全培養基)、VP16組(含VP16 0.06 μg·mL-1完全培養基)、聯合組(含DMY 80 μg·mL-1+ VP16 0.06 μg·mL-1完全培養基),根據細胞生長曲線,放入培養箱中繼續培養48 h后,倒置顯微鏡下觀察并記錄細胞生長情況。
2.1.3 Tunel實驗檢測各組細胞凋亡情況取對數生長期細胞同上法對細胞進行分組干預,培養48 h后取出細胞,棄培養基,PBS 清洗后加入4%多聚甲醛固定細胞1 h(室溫15~25 ℃),PBS漂洗兩次;加入細胞通透液(0.1% Triton)于冰上反應2 min,PBS漂洗2次;加入Tunel反應液,37 ℃避光濕盒反應1 h,PBS漂洗,DAPI染色處理,在熒光顯微鏡下觀察,封片拍照,隨機選取5個視野,使用軟件Image J計數并統計結果。
2.1.4 Western blot檢測各組相關凋亡蛋白表達采用上述方法對細胞進行分組干預,培養48 h 后取出細胞。先用PBS 清洗兩次,加入RIPA 裂解液(上海貝博)置于冰上,待充分裂解后用刮子將細胞輕輕刮下(要確保每個位置都刮到),收取裂解液,低溫高速離心機12 000 r·min-14 ℃離心20 min,將離心后的上清液(注意不能取到細胞團和絮狀物)分裝轉移至1.5 mL離心管(蛋白始終放置于冰上,防止降解)。按照BCA 蛋白定量試劑盒說明進行定量,按比例加入Loding進行蛋白變性。制備12%凝膠,按照30 μg 總蛋白量上樣電泳,將蛋白轉移至PVDF 膜上,放入含5%奶粉的盒子里置于搖床上封閉2 h,然后倒掉奶粉,并分別加入稀釋好的一抗,4 ℃過夜孵育(期間確保抗體充分接觸不能干膜),第2 天取出PVDF 膜,放入含TBST 液的盒子里,置于搖床上洗5 min,反復3 次,清洗完后按照一抗種屬分別加入二抗,常溫孵育1~2 h,然后取出PVDF 膜,TBST 清洗5 min,反復3 次,最后進行ECL 成像,Quntity One 4.6.2 軟件定量分析條帶灰度值,實驗重復多次后統計分析結果。
2.1.5 藥物協同作用評估及統計分析參照金氏公式:Q = Ea+b/(Ea+ Eb-Ea× Eb),評價分析藥物聯合作用是否為協同作用,Ea+b代表合并用藥抑制率,Ea代表單用A 藥的抑制率,Eb代表單用B 藥的抑制率。公式中分子代表實測合并效應,分母代表期望合并效應,Q 是實測效應和期望效應的比值。Q<0.85為拮抗,0.85≤Q≤1.15為單純相加,Q > 1.15為協同作用。所有實驗至少重復三次,單因素方差分析和t檢驗評估統計意義,以P<0.05表示差異有統計學意義。
2.2 實驗結果
2.2.1 DMY增敏VP16對A549細胞的生長抑制作用各組細胞干擾作用48 h 后,倒置顯微鏡下觀察可見,對照組細胞貼壁緊實,細胞形態勻稱,呈長梭形,邊界清楚,表面光滑,折光性強,細胞融合密度約90%;VP16組細胞形態變大,融合密度約80%~90%;DMY組細胞形態變化不明顯,融合密度約70%~80%;聯合用藥組細胞形態固縮且不規則,折光性差,明顯可見大量死亡細胞及碎片,融合率不足30%。與對照組相比,聯合組細胞顯著減少,見圖1。
2.2.2 Tunel 實驗檢測各組細胞凋亡情況結果顯示,對照組表達綠色熒光的細胞約占(1.05±0.04)%,DMY 組表達綠色熒光的細胞約占(7.15±0.31)%,VP16 組表達綠色熒光的細胞約占(3.76±0.23)%,聯合組表達綠色熒光的細胞約占(81.87±0.85)%。聯合組表達綠色熒光的細胞百分比顯著高于對照組和單獨用藥組(P<0.01),細胞凋亡情況見圖2。
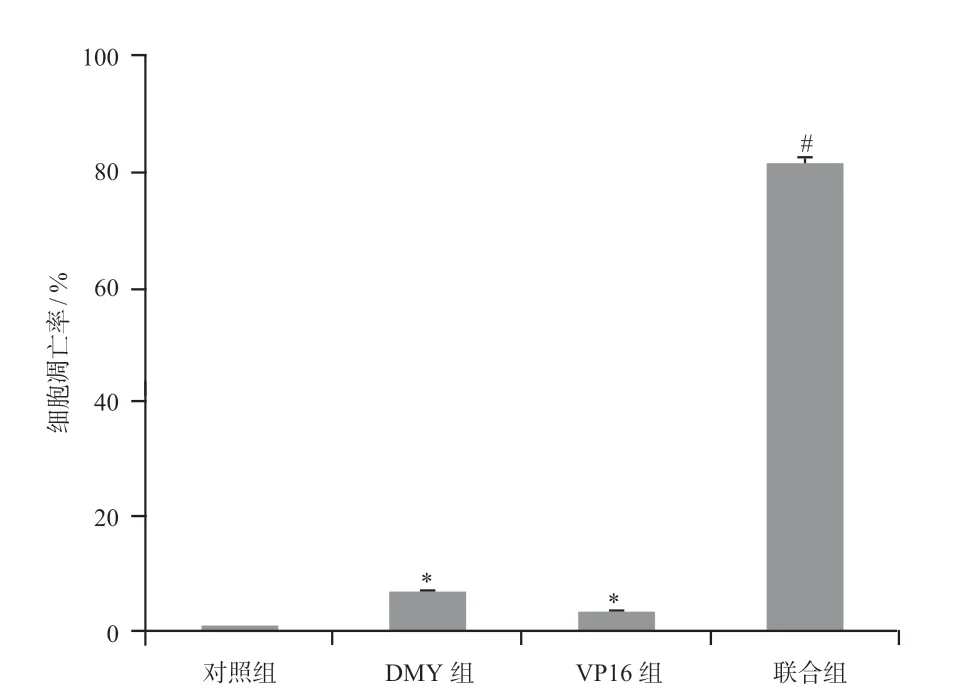
圖2 Tunel實驗檢測各組細胞凋亡情況Fig 2 Apoptosis of each group by Tunel assay
2.2.3 Western Blot檢測各組細胞相關凋亡蛋白的表達水平細胞培養48 h后Western blot結果顯示,對照組、DMY組、VP16組和聯合組β-actin條帶相對均一,證明總蛋白量一致。VP16 組、DMY 組、聯合組與對照組相比,PARP、Caspase-3 蛋白表達水平均有所降低(P<0.05);Cleaved PARP、Cleaved Caspase-3的蛋白表達水平VP16組和聯合組升高(P<0.05),DMY組無顯著差異。聯合組與VP16組、DMY組、對照組相比均可見顯著差異(P<0.01)。Bax蛋白表達水平VP16組、DMY組與對照組相比變化不大,而聯合組蛋白表達水平明顯高于對照組、VP16組和DMY組(P<0.01),見圖3。
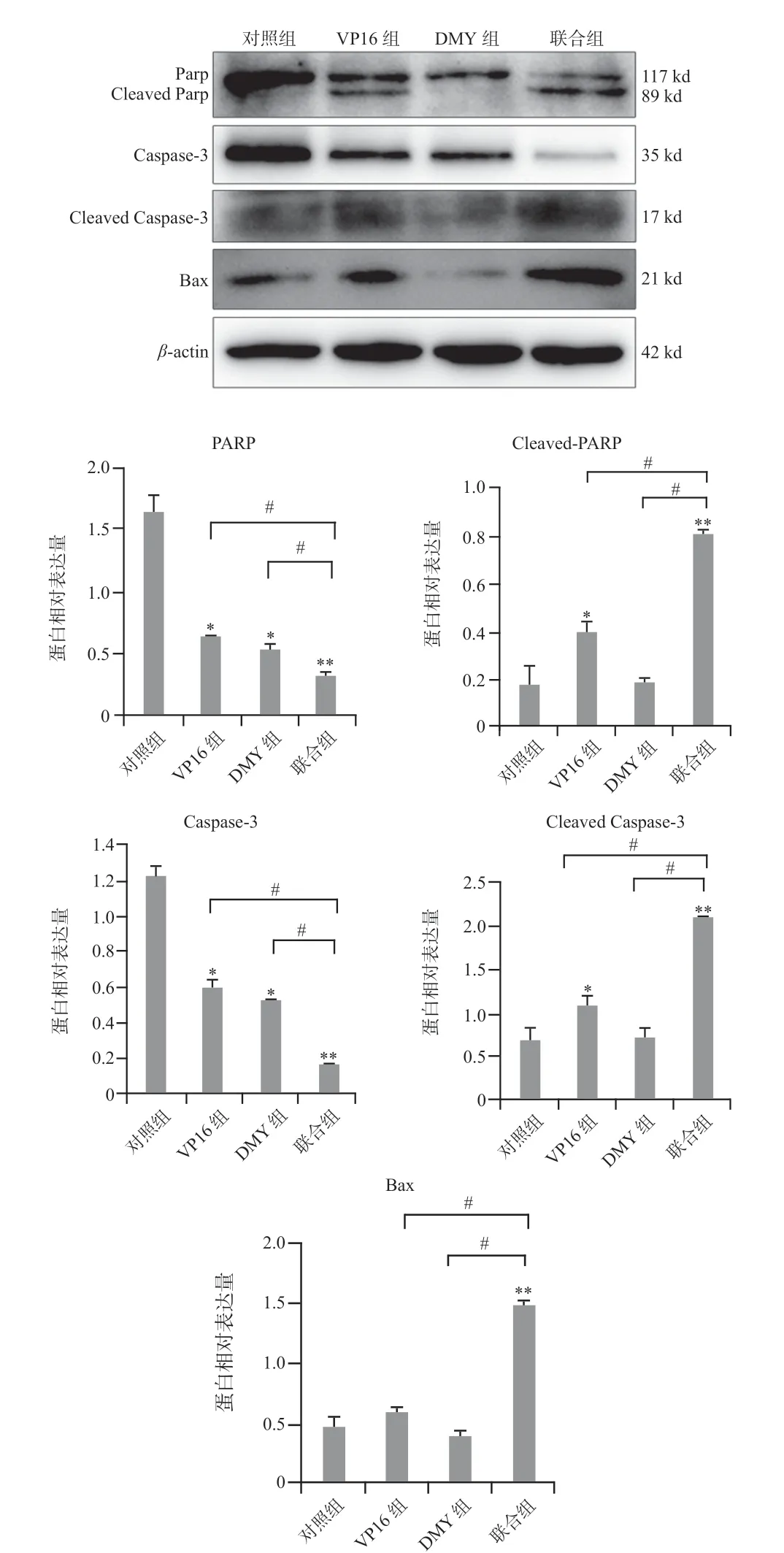
圖3 Western blot檢測各組PARP、Bcl-2、Bax蛋白表達Fig 3 Expression of PARP,Bcl-2 and Bax protein in each group by western blot assay
3 討論
3.1 肺癌細胞選擇依據
按照病理類型,肺癌分為小細胞肺癌和NSCLC,其中NSCLC占肺癌總數的85%左右[15]。由于早期臨床表現不明顯,大部分患者確診時已發展為局部晚期或晚期,化療是治療中晚期NSCLC 的主要治療手段[5],數據顯示Ⅲ期肺癌化療愈后率不足30%。探索新的化療方案,為患者減輕毒副作用同時提高治愈率成為當下急需解決的醫學問題。
3.2 藥物選擇依據
目前針對大多數晚期NSCLC患者的治療方案仍為鉑類化療[16],VP16 是一種細胞周期特異性的抗腫瘤藥物,它使細胞停止于有絲分裂中期,在臨床化療中呈現較嚴重的骨髓抑制。DMY是一種二氫黃酮醇類化合物,研究顯示存在抗腫瘤作用,并且低毒高效的同時還有保護肝臟、降低血脂等作用[11,17-18]。本研究初步探究了DMY聯合小劑量VP16對A549細胞的作用及機制,以明確聯合DMY 治療方案是否可以通過減少化療藥物的用量達到減毒高效增敏的治療效果。文獻及預實驗顯示小劑量VP16毒性作用明顯降低但對腫瘤細胞的作用也明顯減弱,甚至喪失,因此實驗選取單藥劑量時,采用了毒副作用低的小劑量藥物濃度(IC20),結果顯示小劑量DMY和小劑量VP16單藥對肺癌細胞的抑制增殖和誘導凋亡作用均不顯著,但聯合用藥作用顯著,協同作用評估結果Q >1.15,提示兩藥聯合應用存在協同作用。
3.3 聯合作用機制
細胞凋亡是在特定時間中發生的由基因控制的細胞自主有序的死亡過程,任何細胞都可以發生凋亡,所以誘導腫瘤細胞凋亡是治療腫瘤的重要方法之一。本研究從誘導細胞凋亡角度探討了DMY 協同VP16抗腫瘤作用的機制。結果顯示聯合組細胞凋亡顯著,DMY 與VP16 聯合應用存在協同誘導凋亡作用。線粒體凋亡是重要的凋亡途徑,是線粒體介導的內部凋亡通路,內外部刺激均可啟動此通路,通路啟動后,應激和DNA 損傷等促進Bax 等凋亡因子通過調控線粒體膜電位,促進細胞色素C 釋放入胞液中,觸發一系列凋亡活動,Caspase-3 位于細胞凋亡級聯反應的下游,是凋亡級聯反應的執行因子,細胞色素C 釋放后經過一系列作用會將Caspase-3 激活成Cleaved Caspase-3,使細胞修復和細胞周期相關的酶失活,從而誘導細胞凋亡[18-20];PARP 是一類蛋白質翻譯后修飾酶,以高濃度存在于真核細胞中,對于正常或DNA 輕度受損的細胞,PARP 幫助修復DNA維持基因組穩定,但這一過程是大量消耗ATP 的過程,當DNA損傷過強時,PARP大量被激活成Cleaved PARP,ATP 耗竭,細胞最終死亡[21],同時Cleaved Caspase-3 可使PARP 分裂而失去活性,從而抑制DNA修復,使細胞凋亡[22]。因此本研究選取Cleaved PARP、Cleaved Caspase-3、Bax、PARP、Caspase-3 作為檢測指標,進而檢測聯合用藥作用機制,Western blot 結果顯示聯合組與其他組相比,Cleaved PARP、Cleaved Caspase-3、Bax蛋白表達量顯著增加,PARP、Caspase-3 蛋白表達下降,提示DMY 增強VP16 抗肺癌A549細胞的作用與誘導線粒體途徑凋亡有關。
綜上,本研究顯示小劑量VP16 及DMY 對A549細胞的抑制增殖和誘導凋亡作用均不顯著,但兩藥聯合應用可產生協同作用,抑制增殖和誘導凋亡作用顯著增加,進一步的研究顯示其機制與上調Bax蛋白表達,增強Caspase-3和PARP蛋白活化誘發的一系列線粒體凋亡密切相關。但是DMY 是否可與VP16 一起協同抑制A549 細胞的遷移侵襲及其在體內的作用尚未探究,后續筆者將進一步研究,為開發我國減毒增效抗癌植物新藥以及肺癌聯合化療新方案提供參考。

