不同感覺通道在應激傳染中的作用及其神經機制*
趙 榮 黃鈺杰 克麗比努爾·艾爾肯 李晶晶 高 軍
不同感覺通道在應激傳染中的作用及其神經機制*
趙 榮 黃鈺杰 克麗比努爾·艾爾肯 李晶晶 高 軍
(西南大學心理學部; 認知與人格教育部重點實驗室, 重慶 400715)
應激傳染是指個體在觀察或接觸到另一個處于急性應激狀態下的個體時, 不自覺地受到對方負面情緒的影響, 在生理與心理上將自己的狀態與對方匹配。應激傳染的實驗范式分為替代應激與交叉應激兩種類型。在替代應激范式中, 觀察者通過隔板觀察, 接受來自示范者單一或多個感覺通道傳遞的應激信息。在交叉應激中, 觀察者在示范者受到應激之后直接與示范者接觸, 通過多種感覺通道接受示范者傳遞的應激信息。不同感覺信息引發應激傳染的行為反應具有相似性, 都伴隨自主活動減少、焦慮行為增加以及皮質醇水平升高, 其背后的神經環路與關鍵腦區并不完全一致。相比單一感覺通道(視覺、聽覺與嗅覺), 多感覺通道引發的應激傳染效應更強。杏仁核是應激傳染的熱點腦區, 在不同的應激傳染實驗范式中均觀察到顯著激活。未來的研究需要在重視應激傳染實驗范式的基礎上, 根據不同感覺通道影響應激傳染的神經機制確定研究需要關注的腦區。
應激傳染, 生理同步, 感覺通道, 應激反應, 杏仁核
1 引言
應激通常被定義為個體面對具有威脅性的事件時, 產生的一系列認知、生理與行為反應的變化(Habib et al., 2001)。在社會生活中, 人們經常會面對來自經濟、人際與心理等多方面的應激, 應對應激事件引起的應激反應已經成為個體生存與社會發展的重要課題(Pfeifer et al., 2021)。應激傳染(stress contagion)也被稱為應激傳遞(stress transmission)、替代應激(vicarious stress)或恐懼轉移(social transfer of fear), 是指當個體在觀察或接觸到另一個處于急性應激狀態下的個體時, 不自覺受到對方負面情緒的影響, 在生理與心理上將自己的狀態與對方匹配, 并體驗到對方的應激感受(Engert et al., 2019)。應激傳染對生物適應環境有重要生存價值, 具有跨物種一致性(Perez- Manrique & Gomila, 2022)。Park等人(2021)提出的理論認為, 觀察他人經歷應激時, 會促進觀察者自身心理模型的形成并對未來遭遇到相同刺激時產生適應性反應。這一觀點與心理模擬理論相一致(Gallese & Goldman, 1998), 心理模擬理論假定理解他人的行為及其潛在意圖需要對觀察到的行為進行心理模擬。同時, 應激傳染也會引發應激相關疾病, 如疼痛敏感、抑郁、焦慮等(Carnevali et al., 2017; Ueda & Neyama, 2017)。因此, 了解應激傳染引發的行為反應及背后的神經機制, 對于現代生活具有重要的指導意義。
目前, 關于應激傳染的研究與共情和情緒感染有所重疊, 但是應激傳染并不等于共情與情緒感染。在共情與情緒感染的研究中, 既包括了對積極情緒的研究, 也包含了對消極情緒的研究(Panksepp & Lahvis, 2011), 且消極情緒也包含如憤怒、惡心等多種非應激的負面情緒(Hess & Blairy, 2001; Vermeulen & Mermillod, 2010)。應激傳染是特指個體感受到另一個被試的應激狀態并引發了相應的生理反應, 本文僅關注引發被試應激狀態的相關研究。
應激傳染過程受到多種因素的影響, 包括過往經驗、熟悉性、接受應激刺激的不同感覺通道等。嚙齒類動物的急性應激研究發現, 相比沒有電擊經歷的小鼠, 被電擊過的小鼠在看到同類經歷電擊時會表現出明顯的應激反應(Carrillo et al., 2015)。應激傳染現象在社會關系緊密的個體之間更容易出現。相比起單獨飼養的大鼠, 成對飼養的大鼠在看到同伴經歷藥物刺激或社會刺激后更容易出現僵直行為(Langford et al., 2006; Lidhar et al., 2017)。最新研究發現, 感覺通道是影響應激傳染過程的重要因素(Perez-Manrique & Gomila, 2022), 不同感覺通道傳遞信息的方式在個體傳遞社會信息的過程中并不一致(Sliwa et al., 2022)。應激傳染現象通常在同種動物之間產生, 僅呈現應激同伴的氣味信號(Kiyokawa et al., 2009)、聽覺信號(Bussey et al., 2007)或視覺信號(Nakashima et al., 2015)給觀察者, 就足以引發應激傳染現象。動物容易捕捉到視覺傳遞的信息, 但是會受到物體遮擋和視線限制。嗅覺感受器可以捕捉空氣中殘留的化學分子, 并且傳遞社會信息的化學分子會隨著時間的推移持續存在(Pause, 2012)。此外, 不管是人類還是動物, 都會使用聲音傳遞自己的情緒狀態(Concina et al., 2019)。更重要的是, 不同感覺信息之間相互作用可以促進個體對社會信息的處理(Damon et al., 2021)。例如, 在人類研究中同時呈現嗅覺信息和語義一致的視覺信息, 會促進對氣味的識別(Gottfried & Dolan, 2003), 與恐懼相關的嗅覺線索可以加快對情緒面孔的分類速度(Kamiloglu et al., 2018), 聲音線索對情緒面孔的識別有著促進作用(Vesker et al., 2018)。這些結論與動物研究是一致的(Hernandez-Lallement et al., 2022)。
本文通過對應激傳染的實驗范式分類, 總結了視覺、聽覺、嗅覺與多感覺通道影響應激傳染的研究, 探討不同感覺通道背后的神經機制。本文旨在明確感覺通道對應激傳染現象的中介效應, 以進一步了解不同感覺信息如何引發應激傳染。
2 應激傳染的實驗范式
在應激傳染的研究中, 被試成對出現, 研究者將經歷應激事件的被試稱為示范者(demonstrator),觀察示范者接受應激過程的被試稱為觀察者(observer)。觀察者在目擊示范者經歷應激事件(例如:電擊、疼痛、社交挫敗等)時會激活應激系統, 產生與直接受到應激時相似的生理與情緒反應(White & Buchanan, 2016)。根據觀察者直接觀察示范者經歷應激事件, 還是接觸已經遭受過不良事件的示范者, 可以將應激傳染范式分為替代應激(vicarious stress)和交叉應激(stress crossover)兩種類型(Carnevali et al., 2020; Peen et al., 2021)。人類與動物研究中都會使用這兩種范式, 但動物模型的范式可視化程度更高, 因此我們選擇使用動物研究模型來介紹這兩種實驗范式。
旁觀者應激范式(witness stress)是替代應激的經典范式, 示范者與觀察者在同一籠內用隔板隔開, 示范者可以通過透明隔板向觀察者傳遞信息(Warren et al., 2020)。在經典的旁觀者應激范式中, 帶孔的透明隔板允許視覺、聽覺、嗅覺信息通過隔板傳遞(圖1a)。為了探究單一感覺通道在應激傳染中的作用, 研究者向觀察者呈現單一感覺信息(視覺、聽覺或嗅覺), 或單獨阻斷某種感覺信息。在視覺通道的研究中, 研究者通過黑色隔板阻斷觀察者接收視覺信息, 證明視覺信息對于應激傳染具有重要作用(圖1b) (Jeon et al., 2010)。Langford等人(2006)通過單獨破壞視覺、聽覺、嗅覺感覺通道的方式, 證明感覺通道對應激傳染具有調節作用。在嗅覺與聽覺通道的研究中, 研究者通過單獨向觀察者呈現示范者的聲音信息或信息素(嗅覺信息), 直接研究聽覺與嗅覺通道的作用(圖1c, d) (Chen et al., 2009; Lee et al., 2021)。
交叉應激范式同樣可以引發應激傳染。觀察者與示范者被放置在兩個互不干擾的獨立籠子里, 在示范者受到應激時, 觀察者不能直接接收示范者所傳遞出的信息。示范者結束應激任務后, 實驗者將觀察者與示范者合籠(圖1e), 觀察者會受到示范者的應激傳染(Carnevali et al., 2017)。研究者可以使用交叉應激范式探究多感覺通道對應激傳染的影響。兩種研究范式都可以通過觀察者的皮質酮水平, 僵直行為, 焦慮, 抑郁情緒等指標評估應激傳染效應。
3 視覺信息對應激傳染的影響和相關腦機制
3.1 視覺信息引發應激傳染過程中的行為和生理變化
動物研究表明, 阻斷視覺信息會降低甚至阻斷應激傳染效應。在應激傳染的研究中, 研究者使用黑色不透明隔板阻斷了示范者向觀察者傳遞視覺信息(圖1b)。相比起透明隔板, 不透明隔板條件下觀察者觀察示范者接受電擊過程時表現出的僵直行為顯著降低(Ueno et al., 2020), 觀察經歷社交挫敗的示范者后觀察者的社交回避行為下降(Iniguez et al., 2018)。Guzman等人(2009)在使用黑色隔板阻斷視覺信息后, 觀察者的應激系統沒有在示范者受到電擊時激活。有趣的是, 當示范者表現出對社會應激的抵抗行為時, 觀察者暴露于相同應激刺激下也會表現出應激抵抗能力, 并且這個效應必須在觀察者接收到視覺信息時才會出現(Iniguez et al., 2018)。為了證明視覺信息在應激傳染中的獨特性, 研究者逐一移除示范者的視覺、聽覺與嗅覺信息, 研究結果表明, 只有阻斷視覺的實驗組其應激水平顯著下降(Langford et al., 2006)。
以人類為被試的研究也同樣表明視覺信息可以引發應激傳染效應。人類研究常用心跳變異率以及HPA軸分泌的皮質醇水平上升作為急性應激的指標(von Dawans et al., 2021)。作為旁觀者時, 他人的痛苦可以喚起個體自身的應激體驗, 包括皮質醇升高與心跳上升(Davis, 1980; Eisenberg, 2000; Engert et al., 2014)。研究者們通過攝像機記錄被試感到疼痛時的面部表情, 將記錄到的視頻(2秒鐘的無聲短視頻)或圖片呈現給觀察者, 成功誘發了被試的應激反應(Benuzzi et al., 2018; Botvinick et al., 2005; Lamm et al., 2007; Lamm et al., 2010; Olsson & Phelps, 2007)。一項研究表明, 僅僅觀看示范者在中性刺激與應激刺激之間建立聯結的訓練視頻, 就足以讓觀察者對中性刺激同樣表現出厭惡反應(P?rnamets et al., 2020)。相比直接受到應激刺激, 在觀察他人經歷應激后出現的應激刺激具有泛化效應(Dou et al., 2023)。此外, 有研究者要求被試隔著玻璃或通過電腦觀察示范者受到社會應激或生理應激。結果發現, 觀察者與示范者的關系對應激傳染有重要影響, 約40%的觀察者在觀看親密伴侶接受社會應激時出現應激反應(Engert et al., 2014), 僅有17%的觀察者在觀看陌生人接受社會應激時出現應激傳染(Erkens et al., 2019)。應激方式可能同樣是影響視覺應激傳染的重要因素。在生理應激的研究中, 觀看示范者接受疼痛刺激的痛苦圖片時, 觀察者的主觀痛苦感受上升, 但實驗者并沒有報告觀察者中出現應激的比例(Saarela et al., 2006)。因此, 目前尚不能直接對比生理應激和社會應激范式哪種造成的視覺應激傳染更強。前人研究可以發現, 親密關系會提高視覺誘發觀察者應激傳染的比例, 但是尚不能總結出社會應激與生理應激之間的關系。
3.2 視覺信息引發應激傳染的相關腦區
根據“雙路徑模型”, 視覺情緒信息可以在傳遞到枕葉皮層之前, 先將視覺信息傳遞至前情感系統(anterior affective system) (包括:杏仁核、顳極、眶額葉皮層)進行加工處理, 從而完成對視覺注意自上而下的調控(Rudrauf et al., 2008)。前情感系統通過神經投射將視覺情感信息傳遞至前扣帶皮層(anterior cingulate cortex, ACC)與島葉(insula cortex, IC)做進一步的認知處理與調控(Markovic et al., 2014; Rabinak et al., 2011; Seo et al., 2014) (圖2)。
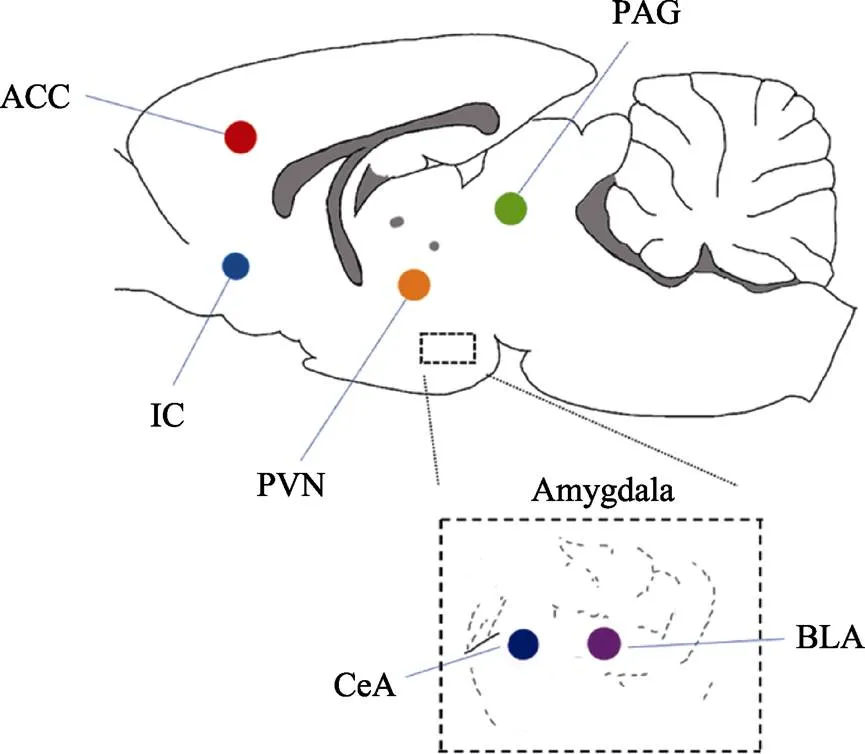
圖2 應激傳染過程中的關鍵腦區:BLA (basolateral amygdala, 基底外側杏仁核); CeA (central amygdala, 中央杏仁核); PVN (paraventricular nucleus, 室旁核); ACC (anterior cingulate cortex, 前扣帶皮層); IC (insular cortex, 島葉); PAG (periaqueductal gray matter, 導水管周圍灰質)。
動物研究表明, ACC與疼痛情感或情緒行為以及疼痛感覺有關(Xiao et al., 2019), IC與觀察疼痛有關(Zhang et al., 2022)。Jeon等人(2010)在觀察者的ACC中注射利多卡因(一種局部麻醉及抗心率失常的藥)使ACC失活, 與對照組相比, 注射利多卡因的小鼠沒有表現出與示范者相同的生理或行為反應。之后, Jeon使用Cacna1c條件性敲除小鼠, 這種小鼠的Cav1.2 Ca2+被敲除, 使ACC的突觸傳遞和神經元興奮受損。結果表明, Cacna1c條件性敲除的觀察者難以發生應激傳染。為了驗證ACC是視覺應激傳染的關鍵腦區, Jeon抑制了腹后外側與后內側丘腦核團以及杏仁核外側核, 這些腦區被證明是恐懼學習的重要腦區(Keum & Shin, 2019)。結果發現, 破壞這些腦區并不會引起上述效應。此外, ACC可以通過基底外側杏仁核(basolateral amygdala, BLA)調控負性情緒的傳遞過程。抑制ACC-BLA環路會改變杏仁核對厭惡線索的實時表征, 選擇性抑制ACC到BLA的投射會損害應激傳染效應(Hernandez- Lallement et al., 2022)。此外, 研究人員發現, 從IC到BLA的谷氨酸能投射對于觀察性疼痛的形成至關重要。IC-BLA投射環路的選擇性激活或抑制分別加強或減弱觀察鼠出現觀察疼痛的強度, 揭示了該神經環路調節小鼠的觀察性疼痛(Zhang et al., 2022)。
人類的腦成像研究表明, 在觀察他人經歷恐懼或恐懼的面部表情時, ACC的神經元活動會發生變化(Fallon et al., 2020)。功能性磁共振成像(functional magnetic resonance imaging, fMRI)研究發現, 觀察者觀看伴侶接受疼痛應激時, ACC被顯著激活(Singer et al., 2004)。相比起觀看中性表情的短視頻, 觀看痛苦表情短視頻時被試會出現更多IC與ACC的激活(Benuzzi et al., 2018)。同樣, 相比起中性圖片, 觀看一系列可能導致疼痛的靜態照片(例如:被刀割到的手、被針刺的臉頰等), 會更多誘發被試ACC與IC的激活(Jackson et al., 2005; Akitsuki & Decety, 2009; Cao et al., 2019; Christov-Moore & Iacoboni, 2019; Lassalle et al., 2019)。Saarela等人(2006)的研究進一步發現, 當被試看到示范者的疼痛面孔圖片時, ACC不僅編碼了被試的應激情緒, 還進一步編碼了被試表達疼痛的強度。同時, 一項元分析總結了32篇以人類為被試的fMRI實驗結果, 發現ACC與IC對于疼痛誘發的應激傳染起到重要的作用(Lamm et al., 2011)。雖然動物研究與人類研究都支持ACC與IC是視覺引發應激傳染的重要腦區, 但值得注意的是, 有很多研究發現個體在觀看自身受到應激的圖片或視頻時同樣會激活ACC與IC, 并且激活程度更強(Benuzzi et al., 2018; Singer et al., 2004; Zaki et al., 2016)。這些結果說明ACC可能并不具備對視覺誘發應激傳染的特異性, 而是編碼了所有與疼痛應激有關的刺激并做出反應。
綜上, 動物與人類研究表明視覺通道信息可以引發應激傳染效應, 從外界獲取的視覺情緒信息通過ACC傳輸到BLA調控應激傳染過程。目前相關研究證據較少, 是否有其他腦區與神經環路參與視覺應激傳染過程還有待進一步研究。
4 聽覺信息對應激傳染的影響和相關腦機制
4.1 聲音信息引發應激傳染
聲音可以有效傳遞情緒信息, 人類和動物都可以通過聲音的強度、頻率與音調表達不同的情緒(Laukka et al., 2008; Swain et al., 2018)。動物研究發現, 在表達積極情緒和負面情緒時, 嚙齒動物所發出的超聲波頻率不同, 22 kHz超聲波代表了應激、恐懼等信息(W?hr, 2018), 并且僅在需要警示同伴存在危險時才會發出這種聲音(W?hr & Schwarting, 2008)。在動物模型的實驗中, 研究者通過記錄示范者在應激時發出的聲音, 再以錄音播放給觀察者的方式探究聽覺信息對應激傳染的影響(圖1c)。在電擊引發應激的實驗中, 觀察者僅僅是聽到示范者發出22 kHz聲音, 就足以引發典型的應激反應(Chen et al., 2009), 這種聲音刺激引發的應激傳染受到觀察者與示范者之間熟悉性的調節(Kim et al., 2010)。研究者收集了示范者接受電擊刺激時的聲音, 并與頻率類似的人造聲音進行對比, 結果表明觀察者可以分辨真實的應激聲音與人造聲音, 表現出對真實聲音的特異性應激反應(Ouda et al., 2016)。除了22 kHz的聲音外, 嚙齒類動物將活動聲音停止也知覺為一種危險信息, 將活動聲音恢復知覺為安全信息。示范者在經過電擊刺激后出現僵直行為, 活動聲音會消失, 這一線索會有效引起觀察者的僵直行為, 出現應激傳染效應。在使用錄音設備播放提前錄制好的大鼠活動聲音后, 觀察者的應激反應也會消失(Pereira et al., 2012)。此外, 使用化學刺激引發應激的研究發現, 僅僅是聽覺受損并不足以阻斷應激傳染的出現(Langford et al., 2006), 說明聽覺信息并不是引發應激傳染的必要條件。
聲音信息對于人類也同樣重要, 人類可以通過聲音強度的改變傳遞情緒信息。個體在經歷應激事件后, 說話時的聲音強度會明顯上升(Feldman, 2007)。研究表明, 具有焦慮特質的母親在面臨應激事件時聲音強度會提高, 引發嬰兒的喚醒水平提高, 這種喚醒水平的改變可以認為是母親將應激情緒傳遞給了嬰兒(Smith et al., 2021)。
4.2 聲音信息引發應激傳染的相關腦區
在聲音信息引發應激傳染過程中, BLA與導水管周圍灰質(periaqueductal gray matter, PAG)起到重要作用。以往研究證明, 聽覺皮層與BLA和PAG有著緊密的連接(Ouda et al., 2016)。當杏仁核損傷時會阻止聲音信息引發觀察者的僵直行為(Choi & Brown, 2003), BLA可以促進聽覺皮層針對負性聲音編碼的可塑性(Concina et al., 2019), 聽覺皮層投射至PAG的神經環路直接控制聲音誘發的防御行為(Wang et al., 2019) (圖2)。
示范者發出的22 kHz聲音可以有效激活觀察者與負面情緒相關的腦區, 包括BLA, 外側杏仁核(lateral amygdala), 下丘腦(hypothalamus), 而誘發積極情緒的50 kHz超聲波則會激活額葉關聯皮層、伏隔核、丘腦旁束(Sadananda et al., 2008)。研究表明, 在聽覺信息引發應激傳染過程中, 觀察者暴露在示范者發出的22 kHz聲音時會激活聽覺皮層、導水管周圍灰質和BLA。BLA和外側杏仁核約有37%的神經元對22 kHz的聲音做出反應, 該部位的放電頻率有所增加(Parsana et al., 2012)。為了更加精確的找到大鼠對于聲音信息產生應激反應的關鍵腦區, 研究者設置了三個實驗組:觀察者直接接收示范者應激時的聲音信息; 觀察者接收示范者應激時的聲音錄音; 觀察者接收人工合成的22 kHz聲音。對比前兩組觀察者的腦激活發現, 所有腦區的腦激活模式與腦激活水平均沒有區別, 這說明大鼠不能區分現場聲音與錄音中應激傳染的聲音。但是, 將前兩組與最后一個實驗組進行對比時發現, 聽覺皮層、BLA以及PAG的激活模式和激活程度均有所區別, 說明大鼠可以分辨人工合成的22 kHz聲音與傳遞應激信息的聲音之間的區別。綜上所述, BLA和PAG是參與分辨有關應激的聽覺線索的重要腦區。
5 嗅覺信息對應激傳染的影響和應激信息素受體
5.1 嗅覺信息引起應激傳染過程中的行為與生理改變
嚙齒類動物有著高度發達的嗅覺系統, 可以在距離很遠的情況下捕捉到空氣中低濃度的信息素分子, 提前躲避危險。在嚙齒類動物辨別同伴的過程中, 嗅覺信息的重要性甚至超過視覺(Corridi et al., 1993)。與應激相關信息的傳遞是嗅覺系統的主要功能之一(Stevenson, 2010), 應激動物會從須墊與肛門腺釋放具有警告作用的社交信息素(alarm pheromones, APs), 以警告或吸引附近的同種動物(Kiyokawa et al., 2018; Kiyokawa et al., 2013)。
單獨呈現嗅覺信息可以誘發應激傳染效應。研究者發現雄性大鼠在受到電擊時, 須墊區域分泌的睪酮會引起大鼠的主動行為反應, 而肛門區域分泌的信息素會引發大鼠的自主神經系統的反應(Kiyokawa et al., 2004)。用拭子擦拭經歷社交挫敗的示范者肛門部位后放置在觀察者籠內, 觀察者表現出皮質酮水平上升以及與應激相關的突觸可塑性的變化, 并且應激傳染程度與觀察者直接嗅聞示范者肛門區的時間呈正相關(Lee et al., 2021) (圖1d)。小鼠或草原田鼠與受到應激的同種動物安置在同一飼養籠內后, 小鼠(Smith et al., 2017)和草原田鼠(Walcott et al., 2018)對化學、熱和機械誘發的疼痛敏感性增強。在這兩項實驗中, 疼痛敏感性的誘導是通過嗅覺線索產生的, 觀察者僅僅是接觸示范者使用過的墊料, 就會表現出與示范者相類似的疼痛敏感性增加。
當嗅覺受損時, 應激傳染效應會減弱。在觀察者與示范者互動過程中, 可以通過嗅覺信息辨別應激狀態, 觀察者嗅聞了受到電擊應激和無應激大鼠的氣味后, 會選擇避開應激鼠的氣味(Mackay-Sim & Laing, 1981)。有趣的是, 將觀察者與示范者同籠飼養后, 這一現象發生了反轉, 觀察者會花費更多的時間去嗅聞示范者的肛門區, 并且觀察者通常會表現出長期抑郁的現象。如果在觀察者與應激鼠進行社會互動前, 通過化學試劑消融了觀察小鼠的嗅上皮層, 破壞觀察者的嗅覺功能, 無論是躲避效應還是親近效應都會消失(Lee et al., 2021)。
在人類研究中, 研究者收集了被試觀看恐懼電影時的眼淚, 再將其呈現給情緒狀態為中性的被試嗅聞。相比起控制組, 實驗組對于負性面孔的反應速度更快, 面部反應更加強烈(Kamiloglu et al., 2018)。這項研究表明, 人類同樣可以通過嗅覺信息傳遞情緒狀態。
5.2 識別應激信息素的受體
嗅覺系統可以分為兩個通路, 主要嗅覺系統(MOS)和犁鼻/輔助嗅覺系統(Tirindelli et al., 2009), 信息素由主嗅覺通路和副嗅覺通路共同處理。已有研究揭示了社交信息素的三個神經元靶點, 分別是GG細胞(Grueneberg ganglion)、梨鼻上皮細胞和主嗅覺上皮細胞, 并且證明激活GG細胞是信息素引發應激傳染的必要條件(Brechbühl et al., 2008)。GG細胞位于鼻尖處, 會表達多種類型的MS4A受體, 這種受體會被2, 6-二甲基吡嗪(小鼠傳遞厭惡信息的信息素)所激活(Greer et al., 2016)。研究發現, 2-叔丁基-4, 5-二氫噻唑是激活GG細胞的警報信息素, 會引發嚙齒動物的回避行為(Brechbühl et al., 2013)。捕食者氣味、狐貍糞便中的TMT (2, 4, 5-trimethylthiazoline)以及來自白鼬肛門腺的2-PT都激活GG細胞, 產生與APs類似的作用。因此, 同物種傳遞危險信息的信息素和傳遞捕食者威脅信息的感覺通路高度重合(Brechbühl et al., 2013)。除了上述兩種激素外, 4-甲基戊醛和己醛也是肛門周圍分泌的警報信息素,其受體同樣分布在梨鼻器和主嗅覺上皮細胞, 當這兩種信息素同時分泌時, 會引發嚙齒動物的防御行為(Inagaki et al., 2014)。Aps和捕食者氣味誘導的c-Fos表達, 揭示了參與厭惡反應的大腦區域激活, 包括BLA和下丘腦室旁核(paraventricular nucleus, PVN) (Kiyokawa et al., 2005), 杏仁核對正性和負性的氣味都進行了編碼(Jin et al., 2015), 但對于負性氣味的反應更加強烈(Gottfried et al., 2002)。綜上所述, GG細胞是嗅覺系統接受應激信息素的主要受體, 而BLA與PVN是重要腦區。
6 多感覺通道信息引發應激傳染和相關腦機制
6.1 多感覺信息引發應激傳染的行為和生理改變
單一感覺通道信息足以引起應激傳染, 但在現實生活中, 信息通常是通過多感覺通道進行傳遞。探究多感覺通道在應激傳染過程中的作用, 對理解現實生活中的應激傳染現象具有重要意義。在傳遞社會信息的過程中, 不同的感覺通道會相互影響。例如, 母親有關的嗅覺線索會在行為與神經水平上影響嬰兒對面部表情的處理, 增加嬰兒對熟悉面孔的觀察時長(Durand et al., 2020), 減少對恐懼面孔的神經反應(Jessen, 2020)。在一項人類研究中, 通過呈現示范者經歷社會應激視頻的方式, 讓觀察者接收到來自示范者的視覺與聽覺信號, 成功誘發了觀察者心跳加速(Dimitroff et al., 2017)。在動物模型中, 多感覺通道引發應激傳染既可以使用旁觀者應激范式(圖1a), 又可以使用交叉應激范式(圖1e)。
以往研究發現, 相比單一感覺信息, 多感覺信息引發的應激傳染效應更強也更加穩定。不同感覺通道的信息相互疊加可以增加對危險的知覺, 從而引起更強的應激傳染效果。一項有關情緒感染的元分析表明, 與多感覺通道相比, 嗅覺或視覺障礙會減少大鼠恐懼與疼痛的情緒感染。與使用非情緒線索相比, 僅嗅覺或視覺可以傳遞負面情緒反應, 但相比起多通道信息較弱(Hernandez- Lallement et al., 2022)。Warren等人(2013)在研究中結合了旁觀者應激范式與社交挫敗范式, 將觀察者與示范者用帶孔的分隔板隔開, 觀察者可以接受示范者傳遞的視覺、嗅覺、聽覺信息。觀察者在觀看示范者經歷社交挫敗過程后, 與另一只攻擊鼠放在中間用透明隔板隔開的籠子里。結果發現觀察者在應激后24小時和1個月都表現出一系列典型的抑郁和焦慮樣行為, 同時出現體重減輕, 血漿皮質酮水平升高的現象, 并表現出社交回避。之后使用不透明的非穿孔分隔器來阻止小鼠的嗅覺和視覺信息傳遞, 降低了聲音信息傳遞, 成功阻斷了應激傳染效應。在使用社交挫敗作為應激源的研究中發現, 觀察者在與示范者首次接觸后表現出了更高的心率和更強的交感神經激活等典型應激反應, 并且表現出了社交回避行為(Carnevali et al., 2017)。這說明在多感覺通道的應激傳染過程中, 觀察者不僅接收到示范者的應激信號, 還可以進一步分辨應激源。在Allsop等人(2018)的實驗中, 示范者經歷應激刺激與中性刺激的聯結訓練, 觀察者通過多孔隔板觀察示范者經歷應激的過程。研究結果發現, 在示范者出現對中性刺激應激反應后, 觀察者也出現了同樣的反應, 說明示范者應激聯結學習的結果可以通過多感覺通道傳遞給觀察者。
6.2 多感覺通道引發應激傳染的相關腦區
在多感覺通道引發應激傳染的研究中發現, 下丘腦內的PVN分泌促腎上腺皮質激素釋放激素(corticotropin releasing hormone, CRH)與催產素(oxytocin, OT), 這兩種激素對于應激傳染具有重要作用。CRH分泌是個體在受到外界急性應激時出現的初始激素反應, 負責傳遞化學信息到丘腦釋放促腎上腺素, 再進一步促進腎上腺皮質激素的分泌(Tsigos & Chrousosb, 2002)。OT不僅參與女性的泌乳和養育行為, 也促進社會安慰行為的發生(Chun et al., 2022)。研究表明, 示范者PVN中CRH神經元上的谷氨酸突觸重塑過程可以傳遞給觀察者, 導致觀察者的PVN中CRH神經元上的谷氨酸突觸的再可塑性(Sterley et al., 2018)。同時, 激活PVN中OT神經元, 會增加觀察者的應激反應(Pisansky et al., 2017)。在使用電擊作為應激源的多感覺通道研究中發現, 觀察者檢測到示范者釋放的警報信息素時, 觀察者的PVN CRH神經元激活(Sterley et al., 2018)。
此外, Allsop等人(2018)使用電擊作為無條件刺激, 聲音刺激作為條件刺激, 在多次反復呈現電擊與聲音的配對后, 示范者在聽到聲音刺激時就會出現應激反應。而觀察者通過透明有孔的隔板觀察了示范者習得這一應激反應的過程, 并同樣對配對的聲音刺激出現應激反應。在這一過程中, BLA投射到ACC的神經環路起到重要作用, 抑制這一環路會阻斷應激傳染出現, 并發現應激信息是從ACC向BLA進行傳遞(Allsop et al., 2018)。Knapska等人(2006)將受到電擊的雄性大鼠放入籠內后, 觀察者接近并嗅聞示范者身上的氣味后激活了BLA腦區。一項研究使用電擊作為應激刺激, 觀察者與示范者直接接觸傳遞應激信號的研究發現, 應激傳染與直接應激都會激活外側杏仁核(Jones & Monfils, 2016)。另一項同樣使用電擊的研究發現, 應激傳染會引發觀察者海馬突觸的改變, 而這種神經機制的改變被看做抑郁的前兆(Lee et al., 2021)。一項使用交叉應激范式的研究選擇一夫一妻制的草原田鼠為研究對象, 示范者是雄鼠, 觀察者是雌鼠。在示范者經歷束縛應激時, 觀察者與示范者進行接觸或單獨活動。研究結果表明, 相比起單獨活動的觀察者, 觀察者與示范者進行接觸后, 觀察者反而出現了更低的焦慮行為, 且伴隨著PVN中OT水平的升高(Chun et al., 2022)。這可能是因為, OT分泌會增加雌鼠的親社會行為, 引發了另一種應激反應——“友好”。但是這種解釋存在爭議, Pisansky等人(2017)的研究結果并不支持上述結論。相比控制組,通過鼻內給藥方式吸入催產素的觀察者在應激傳染出現時, 表現出更強的僵直反應。這種應激傳染的增強, 是由于催產素被投射到ACC并增強了ACC內的細胞活動, 且長期給藥會下調杏仁核中催產素受體表達。研究者同時還表明, 這種鼻內吸入催產素僅僅影響應激傳染效應, 并不會影響直接的恐懼反應(Pisansky et al., 2017)。兩項研究結果不一致, 可能是因為Pisansky等人(2017)使用的觀察者是雄鼠且示范者是陌生的鼠, 而Chun等人(2022)使用的觀察者是雌鼠且示范者是伴侶鼠。前人研究表明, 性別是影響應激反應的重要因素(von Dawans et al., 2021), 而熟悉性是影響應激傳染效應的重要因素(Hernandez-Lallement et al., 2022)。
7 不同感覺通道誘發應激傳染的共同神經機制
通過對前人使用不同應激源與不同感覺通道研究的總結, 我們發現不管是視覺、聽覺或嗅覺信息(Benuzzi et al., 2018; Dou et al., 2023; Kiyokawa et al., 2005; Parsana et al., 2012; Sadananda et al., 2008), 或是讓觀察者與示范者直接接觸都會激活杏仁核(Allsop et al., 2018; Jones & Monfils, 2016)。在嚙齒動物和人類中, 杏仁核與觀察性恐懼學習和社會認知有關(Allsop et al., 2018; Olsson et al., 2007; Olsson & Phelps, 2007)。研究發現, 與社會威脅相關的信號可以通過不同的感覺通道到達杏仁核, 這表明杏仁核在應激傳染過程中起到重要作用(Debiec & Sullivan, 2014; Knapska et al., 2006; Lidhar et al., 2017; Olsson et al., 2007)。杏仁核在功能上可以進一步區分為中央杏仁核(central amygdala, CeA)、皮質杏仁核(cortical amygdala, CoA)與BLA (Knapska et al., 2007; Spampanato et al., 2011)。BLA被認為是編碼負性情緒和正性情緒最基本的神經結構之一, 在信息的社會傳遞過程中表現出激活(Debiec & Sullivan, 2014; Knapska et al.,2006), 參與行為和生理應激反應的調節(Bhatnagar et al., 2004)。中央杏仁核在面對應激源的生理反應中起重要作用, 是整合不同刺激的重要場所(Gilpin et al., 2015; Kong & Zweifel, 2021) (圖2)。
過往研究證明, 20 kHz超聲波刺激誘發應激傳染的過程中, 激活了中央杏仁核與BLA (Beckett et al., 1997; Parsana et al., 2012; Sadananda et al., 2008)。視覺刺激誘發應激傳染激活外側杏仁核(Allsop et al., 2018; Jeon et al., 2010), 但目前并沒有激活中央杏仁核的證據。而在嗅覺的研究中, 研究者使用束縛應激作為應激源, 僅報告嗅覺誘發應激傳染會引起杏仁核的激活, 但沒有嚴格區分杏仁核的亞區(Chun et al., 2022)。在應激后允許觀察者直接接觸示范者的研究中發現, 示范者的中央杏仁核被激活(Knapska et al., 2006)。同樣, 不管是使用電擊、疼痛還是社交挫敗范式, 觀察者的杏仁核都會被激活(Finnell et al., 2018; Ouda et al., 2016; Smith et al., 2017)。使用社交挫敗應激范式, 觀察者的中央杏仁核被激活(Finnell et al., 2018)。使用電擊應激或疼痛應激, 觀察者BLA和中央杏仁核都被激活(Knapska et al., 2006; Ouda et al., 2016; Smith et al., 2017)。綜上所述, 不同的應激實驗范式都會激活杏仁核腦區, 但不同實驗范式可能會激活杏仁核不同亞區。
8 總結與展望
不管是視覺、聽覺還是嗅覺, 單一感覺信息都可以引發應激傳染效應, 但多感覺通道引發的應激傳染效應更強。不同感覺信息引發的應激傳染行為反應具有相似性, 通常會伴隨探索活動減少、僵直時間增加, 但背后的神經通路與關鍵腦區不同。杏仁核是應激傳染的關鍵腦區, 所有感覺通道與應激源都在應激傳染過程中激活了杏仁核。應激傳染既有生存價值, 也會給個體帶來負面影響。雖然這個領域已經積累了很多證據, 但仍有很多未知需要探索。基于當前的研究現狀, 未來研究可以關注的研究方面如下:
第一, 觸覺在傳遞情緒的過程中起到重要作用, 但關于觸覺引發應激傳染的研究較少, 現有研究并不能說明觸覺信息引發應激傳染后出現的行為反應及神經機制。Waters等人(2017)嘗試使用母嬰分離范式研究觸覺在人類的應激傳染過程中有重要的作用, 但這項研究并不是向嬰兒呈現單一的觸覺信息, 母親撫摸嬰兒的過程中還伴隨著嗅覺信息與面部表情傳遞的視覺信息。對于Waters的研究結果需要謹慎解釋, 母嬰之間出現的應激傳染可能是觸覺與其他感覺通道之間的交互作用引發的。未來研究需要單獨呈現觸覺信息, 探究觸覺引發應激傳染的行為反應與神經機制。
第二, 個體如何通過不同感覺通道之間的信息疊加識別應激信息, 是未來研究需要突破的問題。雖然本文總結了單一感覺通道與多感覺通道的現有研究, 并在多感覺通道的部分進行比對, 但現有證據尚不能將單通道、雙通道與多感覺通道信息進行對比。此外, 不同感覺的疊加效應可能不同, 如視覺與嗅覺的效應和視覺與聽覺的效應可能有所不同, 未來也需要進一步探索。
Akitsuki, Y., & Decety, J. (2009). Social context and perceived agency affects empathy for pain: An event- related fMRI investigation.,(2), 722?734.
Allsop, S. A., Wichmann, R., Mills, F., Burgos-Robles, A., Chang, C.-J., Felix-Ortiz, A. C., ... Tye, K. M. (2018). Corticoamygdala transfer of socially derived information gates observational learning.,(6), 1329?1342 e1318.
Beckett, S. R., Duxon, M. S., Aspley, S., & Marsden, C. A. (1997). Central c-fos expression following 20kHz/ultrasound induced defence behaviour in the rat.,(6), 421?426.
Benuzzi, F., Lui, F., Ardizzi, M., Ambrosecchia, M., Ballotta, D., Righi, S., Pagnoni, G., Gallese, V., & Porro, C. A. (2018). Pain mirrors: Neural correlates of observing self or others’ facial expressions of pain.,, 1825.
Bhatnagar, S., Vining, C., & Denski, K. A. I. (2004). Regulationof chronic stress-induced changes in hypothalamic-pituitary- adrenal activity by the basolateral amygdala.,(1), 315?319.
Botvinick, M., Jha, A. P., Bylsma, L. M., Fabian, S. A., Solomon, P. E., & Prkachin, K. M. (2005). Viewing facial expressions of pain engages cortical areas involved in the direct experience of pain.,(1), 312?319.
Brechbühl, J., Klaey, M., & Broillet, M. C. (2008). Grueneberg ganglion cells mediate alarm pheromone detection in mice.,(5892), 1092?1095.
Brechbühl, J., Moine, F., Klaey, M., Nenniger-Tosato, M., Hurni, N., Sporkert, F., ... Broillet, M.-C. (2013). Mouse alarm pheromone shares structural similarity with predator scents.,(12), 4762?4767
Cao, Y., Yusri, N. M., Powell, T., & Cunnington, R. (2019). Neural and behavioral markers of observed pain of older adults.,, 84?90.
Carnevali, L., Montano, N., Statello, R., Coude, G., Vacondio, F., Rivara, S., ... Sgoifo, A. (2017). Social stress contagion in rats: Behavioural, autonomic and neuroendocrine correlates.,, 155?163.
Carnevali, L., Montano, N., Tobaldini, E., Thayer, J. F., & Sgoifo, A. (2020). The contagion of social defeat stress: Insights from rodent studies.,, 12?18.
Carrillo, M., Migliorati, F., Bruls, R., Han, Y., Heinemans, M., Pruis, I., ... Keysers, C. (2015). Repeated witnessing of conspecifics in pain: Effects on emotional contagion.,(9), e0136979.
Chen, Q., Panksepp, J. B., & Lahvis, G. P. (2009). Empathy is moderated by genetic background in mice.,(2), e4387.
Choi, J.-S., & Brown, T. H. (2003). Central amygdala lesions block ultrasonic vocalization and freezing as conditional but not unconditional responses.,(25), 8713?8721.
Christov-Moore, L., & Iacoboni, M. (2019). Sex differences in somatomotor representations of others’ pain: A permutation-based analysis.,(2), 937?947.
Chun, E. K., Donovan, M., Liu, Y., & Wang, Z. (2022). Behavioral, neurochemical, and neuroimmune changes associated with social buffering and stress contagion.,, 100427.
Concina, G., Renna, A., Grosso, A., & Sacchetti, B. (2019). The auditory cortex and the emotional valence of sounds.,, 256?264.
Corridi, P., Chiarotti, F., Bigi, S., & Alleva, E. (1993). Familiarity with conspecific odor and isolation-induced aggressive behavior in male mice (Mus domesticus).,(3), 328?335.
Damon, F., Mezrai, N., Magnier, L., Leleu, A., Durand, K., & Schaal, B. (2021). Olfaction in the multisensory processing of faces: A narrative review of the influence of human body odors.,, 750944.
Davis, M. H. (1980). A multidimensional approach to individual differences in empathy., 85.
Debiec, J., & Sullivan, R. M. (2014). Intergenerational transmission of emotional trauma through amygdala- dependent mother-to-infant transfer of specific fear.,(33), 12222?12227.
Dimitroff, S. J., Kardan, O., Necka, E. A., Decety, J., Berman, M. G., & Norman, G. J. (2017). Physiological dynamics of stress contagion.,(1), 6168.
Dou, H., Lei, Y., Pan, Y., Li, H., & Astikainen, P. (2023). Impact of observational and direct learning on fear conditioning generalization in humans.,, 110650.
Durand, K., Schaal, B., Goubet, N., Lewkowicz, D. J., & Baudouin, J.-Y. (2020). Does any mother's body odor stimulate interest in mother's face in 4-month-old infants?,(2), 151?164.
Eisenberg, N. (2000). Emotion, regulation, and moral development.,(1), 665?697.
Engert, V., Linz, R., & Grant, J. A. (2019). Embodied stress: The physiological resonance of psychosocial stress.,, 138?146.
Engert, V., Plessow, F., Miller, R., Kirschbaum, C., & Singer, T. (2014). Cortisol increase in empathic stress is modulated by emotional closeness and observation modality.y,, 192?201.
Erkens, V. A., Nater, U. M., Hennig, J., & Hausser, J. A. (2019). Social identification and contagious stress reactions.,, 58?62.
Fallon, N., Roberts, C., & Stancak, A. (2020). Shared and distinct functional networks for empathy and pain processing: A systematic review and meta-analysis of fMRI studies.,(7), 709?723.
Feldman, R. (2007). Parent-infant synchrony and the construction of shared timing: Physiological precursors, developmental outcomes, and risk conditions.,(3-4), 329?354.
Finnell, J. E., Muniz, B. L., Padi, A. R., Lombard, C. M., Moffitt, C. M., Wood, C. S., Wilson, L. B., Reagan, L. P., Wilson, M. A., & Wood, S. K. (2018). Essential role of ovarian hormones in susceptibility to the consequences of witnessing social defeat in female rats.,(5), 372?382.
Gallese, V., & Goldman, A. (1998). Mirror neurons and the simulation theory of mind-reading.,(12), 493?501.
Gilpin, N. W., Herman, M. A., & Roberto, M. (2015). The central amygdala as an integrative hub for anxiety and alcohol use disorders.,(10), 859?869.
Gottfried, J. A., Deichmann, R., Winston, J. S., & Dolan, R. J. (2002). Functional heterogeneity in human olfactory cortex: An event-related functional magnetic resonance imaging study.,(24), 10819? 10828.
Gottfried, J. A., & Dolan, R. J. (2003). The nose smells what the eye sees: Crossmodal visual facilitation of human olfactory perception.,(2), 375?386.
Greer, P. L., Bear, D. M., Lassance, J.-M., Bloom, M. L., Tsukahara, T., Pashkovski, S. L., ... Datta, S. R. (2016). A family of non-GPCR chemosensors defines an alternative logic for mammalian olfaction.,(7), 1734?1748.
Guzman, Y. F., Tronson, N. C., Guedea, A., Huh, K. H., Gao, C., & Radulovic, J. (2009). Social modeling of conditioned fear in mice by non-fearful conspecifics.,(1), 173?178.
Habib, K. E., Gold, P. W., & Chrousos, G. P. (2001). Neuroendocrinology of stress.,(3), 695?728.
Hernandez-Lallement, J., Gomez-Sotres, P., & Carrillo, M. (2022). Towards a unified theory of emotional contagion in rodents: A meta-analysis.,, 1229?1248.
Hess, U., & Blairy, S. (2001). Facial mimicry and emotional contagion to dynamic emotional facial expressions and their influence on decoding accuracy.,(2), 129?141.
Inagaki, H., Kiyokawa, Y., Tamogami, S., Watanabe, H., Takeuchi, Y., & Mori, Y. (2014). Identification of a pheromone that increases anxiety in rats.,(52), 18751?18756.
Iniguez, S. D., Flores-Ramirez, F. J., Riggs, L. M., Alipio, J. B., Garcia-Carachure, I., Hernandez, M. A., ... Castillo, S. A. (2018). Vicarious social defeat stress induces depression- related outcomes in female mice.,(1), 9?17.
Jackson, P. L., Meltzoff, A. N., & Decety, J. (2005). How do we perceive the pain of others? A window into the neural processes involved in empathy.,(3), 771? 779.
Jeon, D., Kim, S., Chetana, M., Jo, D., Ruley, H. E., Lin, S.-Y., ... Shin, H.-S. (2010). Observational fear learning involves affective pain system and Cav1.2 Ca2+channels in ACC.,(4), 482?488.
Jessen, S. (2020). Maternal odor reduces the neural response to fearful faces in human infants.,, 100858.
Jin, J., Zelano, C., Gottfried, J. A., & Mohanty, A. (2015). Human amygdala represents the complete spectrum of subjective valence.e,(45), 15145? 15156.
Jones, C. E., & Monfils, M.-H. (2016). Dominance status predicts social fear transmission in laboratory rats.,(6), 1051?1069.
Kamiloglu, R. G., Smeets, M. A. M., de Groot, J. H. B., & Semin, G. R. (2018). Fear odor facilitates the detection of fear expressions over other negative expressions.,(6), 419?426.
Keum, S., & Shin, H.-S. (2019). Neural basis of observational fear learning: A potential model of affective empathy.,(1), 78?86.
Kim, E. J., Kim, E. S., Covey, E., & Kim, J. J. (2010). Social transmission of fear in rats: The role of 22-kHz ultrasonic distress vocalization.,(12), e15077.
Kiyokawa, Y., Kawai, K., & Takeuchi, Y. (2018). The benefits of social buffering are maintained regardless of the stress level of the subject rat and enhanced by more conspecifics.,, 177?183.
Kiyokawa, Y., Kikusui, T., Takeuchi, Y., & Mori, Y. (2004). Alarm pheromones with different functions are released from different regions of the body surface of male rats.,(1), 35?40.
Kiyokawa, Y., Kikusui, T., Takeuchi, Y., & Mori, Y. (2005). Mapping the neural circuit activated by alarm pheromone perception by c-Fos immunohistochemistry.,(1-2), 145?154.
Kiyokawa, Y., Kodama, Y., Kubota, T., Takeuchi, Y., & Mori, Y. (2013). Alarm pheromone is detected by the vomeronasal organ in male rats.,(8), 661?668.
Kiyokawa, Y., Takeuchi, Y., Nishihara, M., & Mori, Y. (2009). Main olfactory system mediates social buffering of conditioned fear responses in male rats.,(4), 777?785.
Knapska, E., Nikolaev, E., Boguszewski, P., Walasek, G., Blaszczyk, J., Kaczmarek, L., & Werka, T. (2006). Between-subject transfer of emotional information evokes specific pattern of amygdala activation.,(10), 3858?3862.
Knapska, E., Radwanska, K., Werka, T., & Kaczmarek, L. (2007). Functional internal complexity of amygdala: Focus on gene activity mapping after behavioral training and drugs of abuse.,(4), 1113? 1173.
Kong, M. S., & Zweifel, L. S. (2021). Central amygdala circuits in valence and salience processing.,, 113355.
Lamm, C., Batson, C. D., & Decety, J. (2007). The neural substrate of human empathy: Effects of perspective-taking and cognitive appraisal.,(1), 42?58.
Lamm, C., Decety, J., & Singer, T. (2011). Meta-analytic evidence for common and distinct neural networks associated with directly experienced pain and empathy for pain.,(3), 2492?2502.
Lamm, C., Meltzoff, A. N., & Decety, J. (2010). How do we empathize with someone who is not like us? A functional magnetic resonance imaging study.,(2), 362?376.
Langford, D. J., Crager, S. E., Shehzad, Z., Smith, S. B., Sotocinal, S. G., Levenstadt, J. S., ... Mogil, J. S. (2006). Social modulation of pain as evidence for empathy in mice.,(5782), 1967?1970.
Lassalle, A., Zürcher, N. R., Porro, C. A., Benuzzi, F., Hippolyte, L., Lemonnier, E., ... Hadjikhani, N. (2019). Influence of anxiety and alexithymia on brain activations associated with the perception of others’ pain in autism.,(3), 359?377.
Laukka, P., Linnman, C., ?hs, F., Pissiota, A., Frans, ?., Faria, V., ... Furmark, T. (2008). In a nervous voice: Acoustic analysis and perception of anxiety in social phobics’ speech.,(4), 195?214.
Lee, I. C., Yu, T.-H., Liu, W.-H., & Hsu, K.-S. (2021). Social transmission and buffering of hippocampal metaplasticity after stress in mice.,(6), 1317? 1330.
Lidhar, N. K., Insel, N., Dong, J. Y., & Takehara-Nishiuchi, K. (2017). Observational fear learning in degus is correlated with temporal vocalization patterns.,, 362?371.
Mackay-Sim, A., & Laing, D. G. (1981). The sources of odors from stressed rats.,(3), 511?513.
Markovic, J., Anderson, A. K., & Todd, R. M. (2014). Tuning to the significant: Neural and genetic processes underlying affective enhancement of visual perception and memory.,, 229?241.
Nakashima, S. F., Ukezono, M., Nishida, H., Sudo, R., & Takano, Y. (2015). Receiving of emotional signal of pain from conspecifics in laboratory rats.,(4), 140381.
Olsson, A., Nearing, K. I., & Phelps, E. A. (2007). Learning fears by observing others: The neural systems of social fear transmission.,(1), 3?11.
Olsson, A., & Phelps, E. A. (2007). Social learning of fear.,(9), 1095?1102.
Ouda, L., Jilek, M., & Syka, J. (2016). Expression of c-Fos in rat auditory and limbic systems following 22-kHz calls.,, 196?204.
Panksepp, J. B., & Lahvis, G. P. (2011). Rodent empathy and affective neuroscience.,(9), 1864?1875.
Park, J., Carrillo, B., & Mendes, W. B. (2021). Is vicarious stress functionally adaptive? Perspective-taking modulates the effects of vicarious stress on future firsthand stress.,(6), 1131?1143.
P?rnamets, P., Espinosa, L., & Olsson, A. (2020). Physiological synchrony predicts observational threat learning in humans.,(1927), 20192779.
Parsana, A. J., Li, N., & Brown, T. H. (2012). Positive and negative ultrasonic social signals elicit opposing firing patterns in rat amygdala.,(1), 77?86.
Pause, B. M. (2012). Processing of Body Odor Signals by the Human Brain.,(1), 55?63.
Peen, N. F., Duque-Wilckens, N., & Trainor, B. C. (2021). Convergent neuroendocrine mechanisms of social buffering and stress contagion.,, 104933.
Pereira, A. G., Cruz, A., Lima, S. Q., & Moita, M. A. (2012). Silence resulting from the cessation of movement signals danger.,(16), R627?628.
Perez-Manrique, A., & Gomila, A. (2022). Emotional contagion in nonhuman animals: A review.,(1), e1560.
Pfeifer, L. S., Heyers, K., Ocklenburg, S., & Wolf, O. T. (2021). Stress research during the COVID-19 pandemic and beyond.,, 581?596.
Pisansky, M. T., Hanson, L. R., Gottesman, II, & Gewirtz, J. C. (2017). Oxytocin enhances observational fear in mice.,(1), 2102.
Rabinak, C. A., Angstadt, M., Welsh, R. C., Kenndy, A. E., Lyubkin, M., Martis, B., & Phan, K. L. (2011). Altered amygdala resting-state functional connectivity in post-traumatic stress disorder.,, 62.
Rudrauf, D., David, O., Lachaux, J.-P., Kovach, C. K., Martinerie, J., Renault, B., & Damasio, A. (2008). Rapid interactions between the ventral visual stream and emotion-related structures rely on a two-pathway architecture.,(11), 2793?2803.
Saarela, M. V., Hlushchuk, Y., Williams, A. C. d. C., Schurmann, M., Kalso, E., & Hari, R. (2006). The compassionate brain: Humans detect intensity of pain from another's face.,(1), 230?237.
Sadananda, M., Wohr, M., & Schwarting, R. K. (2008). Playback of 22-kHz and 50-kHz ultrasonic vocalizations induces differential c-fos expression in rat brain.,(1), 17?23.
Seo, D., Olman, C. A., Haut, K. M., Sinha, R., MacDonald, A. W., 3rd, & Patrick, C. J. (2014). Neural correlates of preparatory and regulatory control over positive and negative emotion.,(4), 494?504.
Singer, T., Seymour, B., O'Doherty, J., Kaube, H., Dolan, R. J., & Frith, C. D. (2004). Empathy for pain involves the affective but not sensory components of pain.,(5661), 1157?1162.
Sliwa, J., Mallet, M., Christiaens, M., & Takahashi, D. Y. (2022). Neural basis of multi-sensory communication in primates.,(3), 322?343.
Smith, C. G., Jones, E. J. H., Charman, T., Clackson, K., Mirza, F. U., & Wass, S. V. (2021). Vocalization and physiological hyperarousal in infant-caregiver dyads where the caregiver has elevated anxiety.,(2), 459?470.
Smith, M. L., Walcott, A. T., Heinricher, M. M., & Ryabinin, A. E. (2017). Anterior cingulate cortex contributes to alcohol withdrawal-induced and socially transferred hyperalgesia.,(4), doi: 10.1523/ENEURO.0087- 17.2017
Spampanato, J., Polepalli, J., & Sah, P. (2011). Interneurons in the basolateral amygdala.,(5), 765?773.
Sterley, T. L., Baimoukhametova, D., Füzesi, T., Zurek, A. A., Daviu, N., Rasiah, N. P., ... Bains, J. S. (2018). Social transmission and buffering of synaptic changes after stress.,(3), 393?403.
Stevenson, R. J. (2010). An initial evaluation of the functions of human olfaction.,(1), 3?20.
Swain, M., Routray, A., & Kabisatpathy, P. (2018). Databases, features and classifiers for speech emotion recognition: A review.,(1), 93?120.
Tirindelli, R., Dibattista, M., Pifferi, S., & Menini, A. (2009). From pheromones to behavior.,(3), 921?956.
Tsigos, C., & Chrousos, G. P. (2002). Hypothalamic? pituitary?adrenal axis, neuroendocrine factors and stress. J,(4), 865?871.
Ueda, H., & Neyama, H. (2017). LPA1 receptor involvement in fibromyalgia-like pain induced by intermittent psychological stress, empathy.,, 16?25.
Ueno, H., Suemitsu, S., Murakami, S., Kitamura, N., Wani, K., Takahashi, Y., ... Ishihara, T. (2020). Conformity-like behaviour in mice observing the freezing of other mice: A model of empathy.,(1), 1?16.
Vermeulen, N., & Mermillod, M. (2010). Fast emotional embodiment can modulate sensory exposure in perceivers.,(2), 184?187.
Vesker, M., Bahn, D., Kauschke, C., Tschense, M., Dege, F., & Schwarzer, G. (2018). Auditory emotion word primes influence emotional face categorization in children and adults, but not vice versa.,, 618.
von Dawans, B., Strojny, J., & Domes, G. (2021). The effects of acute stress and stress hormones on social cognition and behavior: Current state of research and future directions.,, 75?88.
Walcott, A. T., Smith, M. L., Loftis, J. M., & Ryabinin, A. E. (2018). Social transfer of alcohol withdrawal-induced hyperalgesia in female prairie voles.,(6), 710?717.
Wang, H., Chen, J., Xu, X., Sun, W.-J., Chen, X., Zhao, F., ... Zhang, Z. (2019). Direct auditory cortical input to the lateral periaqueductal gray controls sound-driven defensive behavior.,(8), e3000417.
Warren, B. L., Mazei-Robison, M. S., Robison, A. J., & Iniguez, S. D. (2020). Can I get a witness? Using vicarious defeat stress to study mood-related illnesses in traditionally understudied populations.,(5), 381?391.
Warren, B. L., Vialou, V. F., I?iguez, S. D., Alcantara, L. F., Wright, K. N., Feng, J., ... Bolanos-Guzman, C. A. (2013). Neurobiological sequelae of witnessing stressful events in adult mice.,(1), 7?14.
Waters, S. F., West, T. V., Karnilowicz, H. R., & Mendes, W. B. (2017). Affect contagion between mothers and infants: Examining valence and touch.(7), 1043?1051.
White, C. N., & Buchanan, T. W. (2016). Empathy for the stressed.,(4), 311?324.
W?hr, M. (2018). Ultrasonic communication in rats: Appetitive 50-kHz ultrasonic vocalizations as social contact calls.,(1), 14.
W?hr, M., & Schwarting, R. K. (2007). Ultrasonic communication in rats: can playback of 50-kHz calls induce approach behavior?.(12), e1365.
W?hr, M., & Schwarting, R. K. W. (2008). Ultrasonic calling during fear conditioning in the rat: No evidence for an audience effect.,(3), 749?760.
Xiao, Z., Martinez, E., Kulkarni, P. M., Zhang, Q., Hou, Q., Rosenberg, D., ... Chen, Z. S. (2019). Cortical pain processing in the rat anterior cingulate cortex and primary somatosensory cortex.,, 165.
Zaki, J., Wager, T. D., Singer, T., Keysers, C., & Gazzola, V. (2016). The anatomy of suffering: Understanding the relationship between nociceptive and empathic pain.,(4), 249?259.
Zhang, M.-M., Geng, A.-Q., Chen, K., Wang, J., Wang, P., Qiu, X.-T., ... Chen, T. (2022). Glutamatergic synapses from the insular cortex to the basolateral amygdala encode observational pain.,(12), 1993?2008.
The role of different sensory channels in stress contagion and its neural mechanisms
ZHAO Rong, HUANG Yujie, KE Libinuer·aierken, LI Jingjing, GAO Jun
(Faculty of Psychology, Southwest University; Key Laboratory of Cognition and Personality, Ministry of Education, Chongqing 400715, China)
Stress contagion refers to the phenomenon where people unconsciously absorb stress reactions from another individual in the stressed state, through observation or direct contact, and match their own physiological and psychological state to that individual. The experimental paradigm for stress contagion can be categorized into two types: vicarious stress and stress crossover. In vicarious stress paradigms, observers witness through a partition and receive stress information transmitted through one or more sensory channels from a demonstrator. In stress crossover paradigms, the observer comes into direct contact with the demonstrator after they have experienced stress, receiving stress information through multiple sensory channels. The behavioral responses elicited by different sensory information exhibit similarities, such as decreased autonomic activity, increased anxiety-like behavior and elevated cortisol levels. The neural circuit and key brain regions involved are not entirely consistent across all sensory channels. However, stress contagion effects tend to be stronger when multiple sensory channels are involved compared to single sensory channels (visual, auditory, or olfactory). The amygdala has been identified as a central brain region for stress contagion, consistently demonstrating significant activation across various stress contagion paradigms. In future studies, it is crucial for researchers to carefully consider the experimental paradigms employed in studying stress contagion and identify specific brain regions of interest based on the underlying neural mechanisms associated with stress contagion effects induced by different sensory channels.
stress contagion, synchronization, sensory channel, stress response, amygdala
2023-04-24
* 國家自然科學基金(32071059); 重慶市自然科學基金(cstc2020jcyj-msxmX0209); 中央高校基本科研業務費(SWU2109223); 重慶市社科規劃項目(2020PY64)。
高軍, E-mail: gaojunscience@126.com
B845

