Rab25 沉默對轉化生長因子-β誘導的前列腺癌LNCaP 細胞上皮-間充質轉化的影響△
胡春暉,于磊,趙先誠,郁全勝,劉豪
宿遷市第一人民醫院泌尿外科,江蘇 宿遷 223800
前列腺癌是男性泌尿生殖系統常見的惡性腫瘤之一,在全球男性惡性腫瘤發病和死亡譜中,前列腺癌分別居第2 位和第5 位[1]。近年來,隨著中國人口老齡化的加劇,前列腺癌的發病率和病死率均呈明顯上升趨勢[2]。2020 年全球癌癥統計數據顯示,中國前列腺癌發病例數占全球8.2%,死亡例數占全球13.6%[3]。前列腺癌的確切病因尚未闡明,因此,積極篩選前列腺癌侵襲轉移的關鍵分子,對于尋求前列腺癌治療新策略具有非常重要的意義。Rab 蛋白家族是Ras 超家族中最大的亞家族,由小分子鳥苷三磷酸(guanosine triphosphate,GTP)結合蛋白組成,參與細胞內吞作用和細胞囊泡轉運中的許多關鍵過程,主要調節細胞中囊泡轉運和蛋白質交換,Rab 表達失調被證實與包括惡性腫瘤在內的多種疾病關系密切[4]。Rab25 是Rab蛋白家族成員,在細胞內作為轉運蛋白發揮關鍵作用,能夠與GTP 結合后將GTP 水解,對細胞囊泡轉運的各個階段進行調控[5]。Rab25 表達水平與多種腫瘤的發生發展密切相關,其在頭頸部腫瘤、胃癌、卵巢癌、宮頸癌、膀胱癌和腎癌中高表達并發揮致癌作用,但在食管鱗狀細胞癌、三陰性乳腺癌和結直腸癌中低表達并發揮抑癌作用[6]。上皮-間充質轉化(epithelial-mesenchymal transition,EMT)被認為是導致腫瘤轉移的重要機制[7],也是致癌的關鍵標志[8]。轉化生長因子-β(transforming growth factor-β,TGF-β)通路是激活腫瘤EMT 的一條關鍵通路[9]。研究表明,TGF-β通過誘導EMT 加速腫瘤轉移[10]。已有研究表明,Rab25 在乳腺癌EMT 過程中具有至關重要的作用[11],然而Rab25 在前列腺癌中的功能和作用機制尚不清楚。本研究探討Rab25沉默對TGF-β誘導的前列腺癌LNCaP 細胞EMT 的影響,現報道如下。
1 材料與方法
1.1 細胞及主要試劑
LNCaP 細胞株購自上海吉凱基因科技有限公司,293T 細胞購自南京科佰生物科技有限公司,DNA 內切酶和DNA marker 均購自美國Thermo Fisher Scientific 公司,DNA 連接酶購自日本Takara公司,DNA 凝膠回收試劑盒購自北京全式金生物技術股份有限公司,質粒抽提試劑盒購自美國Axygen 公司,反轉錄試劑盒和SYBR Green Mix 均購自南京諾唯贊生物科技股份有限公司,TRIzol 購自美國Invitrogen 公司,RPMI1640 培養基購自美國Corning 公司,結晶紫購自生工生物工程(上海)股份有限公司,聚凝胺(Polybrene)購自上海吉瑪制藥技術有限公司,Rab25 一抗購自美國CST 公司,辣根過氧化物酶標記的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗購自上海碧云天生物技術有限公司。
1.2 PLKO.1-puro-Rab25-短發夾RNA(short hairpin RNA,shRNA)重組干擾質粒的構建及鑒定
1.2.1 shRNA 干擾序列的設計和合成本研究共設計3條靶向Rab25基因的干擾序列,干擾靶點見表1,過表達質粒是PLKO.1 質粒。載體PLKO.1 帶有EcoRⅠ和AgeⅠ酶切位點。應用EcoRⅠ和AgeⅠ對載體PLKO.1 進行酶切后,使用T4 連接酶將經過雙酶切的質粒和干擾靶點連接到一起,構建PLKO.1-puro-Rab25-shRNA-1、PLKO.1-puro-Rab25-shRNA-2、PLKO.1-puro-Rab25-shRNA-3 重組質粒,分別作為shRab25-1 組、shRab25-2 組、shRab25-3 組,并設置空白對照NC 組。
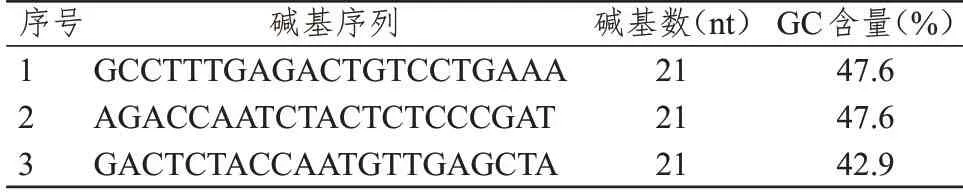
表1 針對Rab25基因的3個干擾靶點
1.2.2 細胞培養、慢病毒包裝及病毒感染細胞培養:使用含10%胎牛血清(fetal bovine serum,FBS)的RPMI1640 培養基(含1.5 mg/L 谷氨酰胺、100 U/ml青霉素、100 μg/ml 鏈霉素)常規培養LNCaP 細胞,置于37 ℃、5% CO2飽和濕度培養箱中。慢病毒包裝:培養293T 細胞,培養至80%~90%融合時,傾去培養液,采用3 ml 磷酸鹽緩沖液(phosphate buffered saline,PBS)洗滌細胞2 次,加入1 ml 胰蛋白酶-乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)溶液,再加入1 ml DMEM 培養液,平均鋪到2 個10 cm2皿中。待細胞培養至60%~70%融合時進行轉染:2 個1.5 ml 管中分別加入5 μg shRab25和5 μg NC 質粒,再加入包裝質粒5 μg psPAX2 和2.5 μg pMD2.G,用1 ml 無血清RPMI1640 培養基稀釋質粒,再加入20 μl Lipofectamine 2000 轉染試劑,混勻。室溫靜置20 min 后加入細胞。轉染8 h后換新鮮的DMEM 培養基,37 ℃、5% CO2培養箱中繼續培養。48 h 后收集培養基上清,分裝,感染LNCaP 細胞。
1.2.3 穩篩株構建將LNCaP 細胞按1×105/孔的濃度接種于6 孔板中,培養24 h,待細胞30%~40%融合時加入慢病毒2 ml,并加入終濃度為5 μg/ml的聚凝胺。待細胞80%~90%融合時加入嘌呤霉素,終濃度為2 μg/ml,同時設立空白對照組。維持嘌呤霉素濃度,隔天換液,連續觀察4 天,至空白對照組細胞全部死亡后,可認為已經獲得穩篩株。穩篩株細胞擴增收樣。
1.3 定量逆轉錄聚合酶鏈反應(quantitation reverse transcription- polymerase chain reaction,qRT-PCR)檢測Rab25 mRNA 相對表達量
收集各組細胞,TRIzol法提取總RNA,瓊脂糖電泳檢查RNA的完整性,采用逆轉錄試劑盒將總RNA逆轉錄合成互補DNA(complementary DNA,cDNA)。Rab25上游引物5'-GGGAATGGAACTGAGGAAGATTA-3',下游引物5'-CGTGAATCGGGAGAGTAGATTG-3';甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物5'-CTGGGCTACACTGAGCACC-3',下游引物5'-AAGTGGTCGTTGAGGGCAATG-3'。逆轉錄反應體系為20 μl,其中2×SYBR Green Mix 10 μl,總RNA 1 μg,加焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水至20 μl。逆轉錄反應條件:37 ℃15 min,85 ℃5 s。PCR 反應體系為20 μl,其中2×PCR Master Mix 10 μl,上游引物1 μl,下游引物1 μl,cDNA 模板0.5 μl,加ddH2O 至20 μl。PCR 反應條件:95 ℃5 min,95 ℃10 s,60 ℃30 s,共40 個循環。60~95 ℃緩慢升溫,產生Rab25和GAPDH的溶解曲線。
1.4 蛋白質印跡法(Western blot)檢測細胞中Rab25 蛋白表達水平
十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分離蛋白后,電轉移至硝酸纖維素膜(350 mA 恒流1.5 h);用5%脫脂奶粉封閉液封閉1 h;加入一抗(1∶2000),室溫孵育1.5 h;用TBST緩沖液沖洗3 次,每次5~10 min;加入相應的二抗,室溫孵育30 min;用TBST 緩沖液沖洗3 次,每次5~10 min;用TBST 緩沖液潤洗2 次;加入適量的電化學發光(electrochemiluminescence,ECL)液,借助凝膠成像系統顯影。
1.5 Rab25 沉默對TGF-β介導的前列腺癌LNCaP細胞EMT 影響的實驗研究
培養NC 組和shRab25-1 組細胞,加入TGF-β(5 ng/ml)或不加入TGF-β,分別作為NC 組、NC+TGF-β組、shRab25-1 組、shRab25-1+TGF-β組,使用相差顯微鏡觀察各組LNCaP 細胞的形態學變化,采用Western Blot 檢測EMT 生物標志物E-鈣黏蛋白(E-cadherin)、N-鈣黏蛋白(N-cadherin)的表達情況。具體實驗步驟同1.4。
1.6 統計學方法
采用SPSS 21.0、Graphpad Prism9.0 軟件對數據進行統計分析。計量資料以均數±標準差(±s)表示,兩組間比較采用t檢驗,多組間比較采用方差分析,多組間兩兩比較采用LSD-t檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 重組shRNA 表達質粒的DNA 測序結果
本研究設計了針對Rab25基因的3 個干擾靶點,并成功地將目的基因片段克隆到載體PLKO.1中。測序結果顯示,插入的堿基序列與設計的干擾靶點完全一致。PLKO.1-puro-Rab25-shRNA-1、PLKO.1-puro-Rab25-shRNA-2、PLKO.1-puro-Rab25-shRNA-3 插入序列部分測序圖見圖1~圖3。
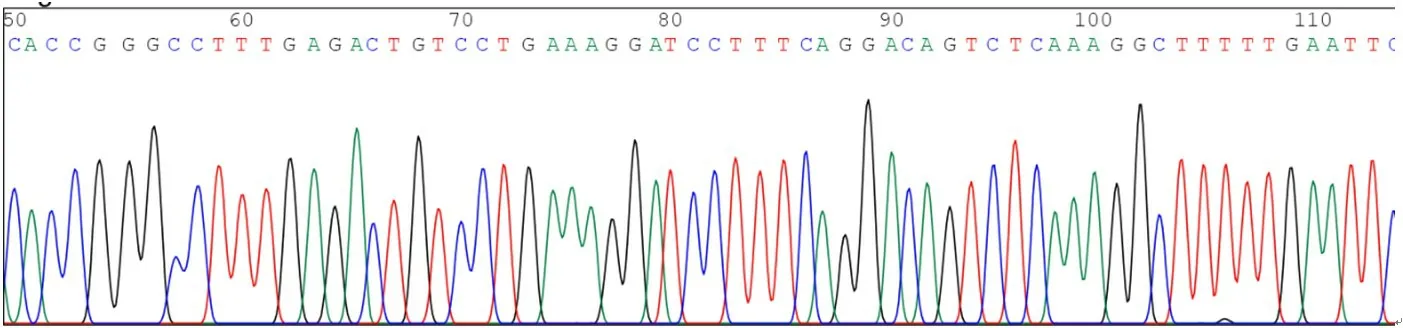
圖1 PLKO.1-puro-Rab25-shRNA-1插入序列部分測序圖
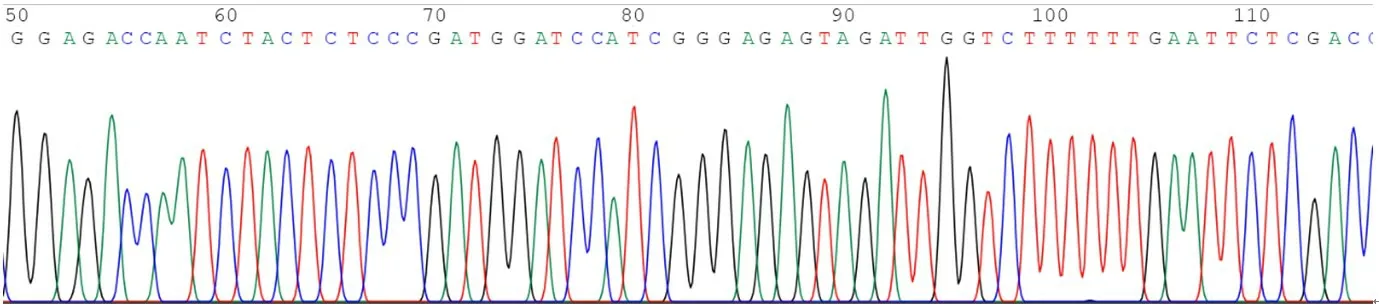
圖2 PLKO.1-puro-Rab25-shRNA-2插入序列部分測序圖
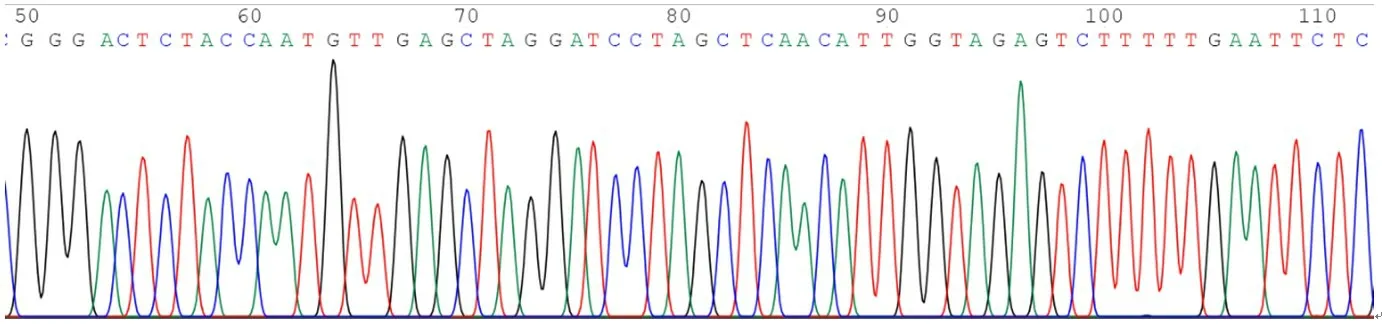
圖3 PLKO.1-puro-Rab25-shRNA-3插入序列部分測序圖
2.2 Rab25 mRNA 相對表達量的比較
RNA 電泳28S rRNA、18S rRNA 條帶清晰可見,說明RNA 未降解(圖4);Rab25和GAPDH擴增曲線呈現平滑S形狀,熔解曲線主峰清晰,無雜峰出現,提示本次PCR 擴增產物較純,并無非特異性擴增(圖5)。shRab25-1 組、shRab25-2 組、shRab25-3組細胞中Rab25mRNA 相對表達量均低于NC 組,差異均有統計學意義(P<0.05),其中shRab25-1 細胞中Rab25mRNA 相對表達量最低(表2)。
圖4 RNA提取質量檢測結果
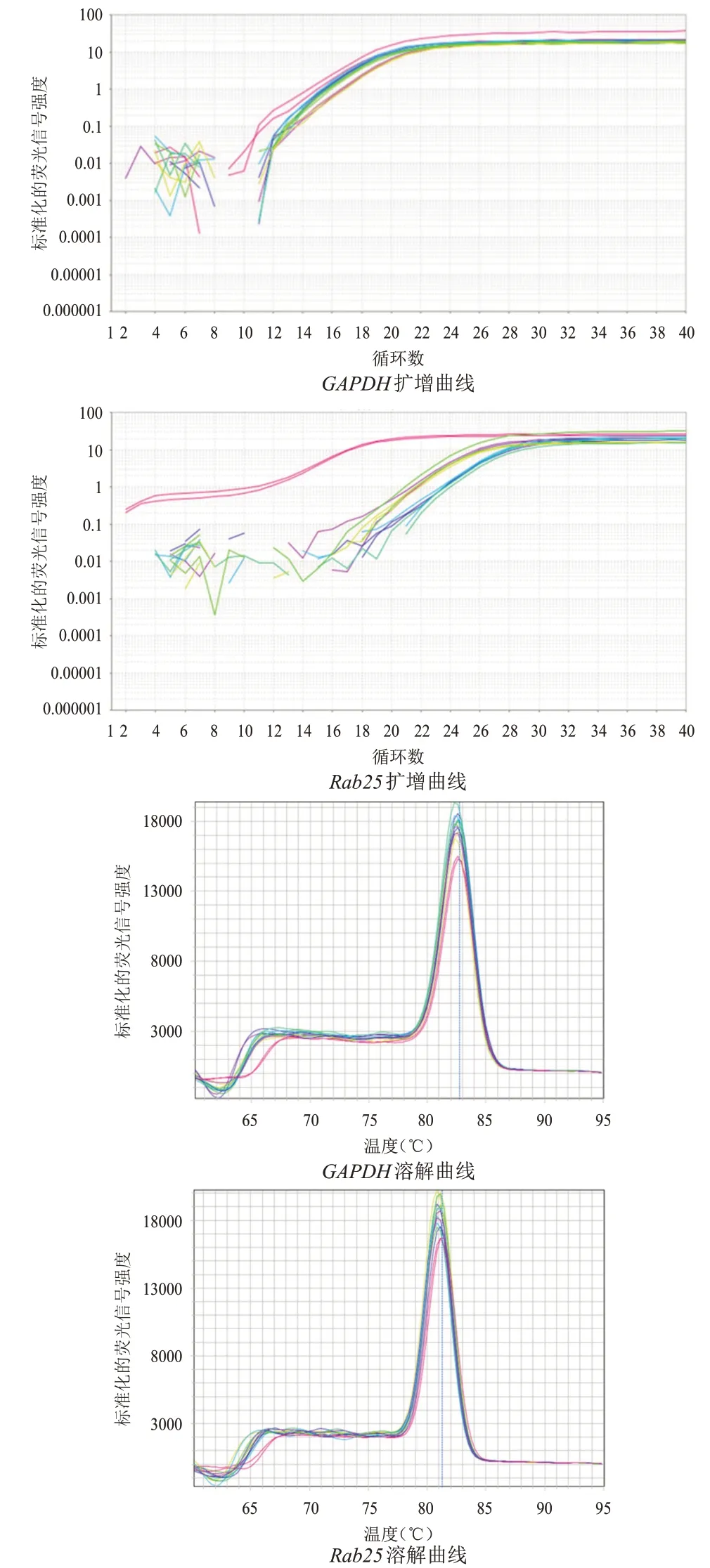
圖5 Rab25和內參GAPDH擴增曲線及熔解曲線
表2 各組細胞中Rab25 mRNA 相對表達量的比較(±s)
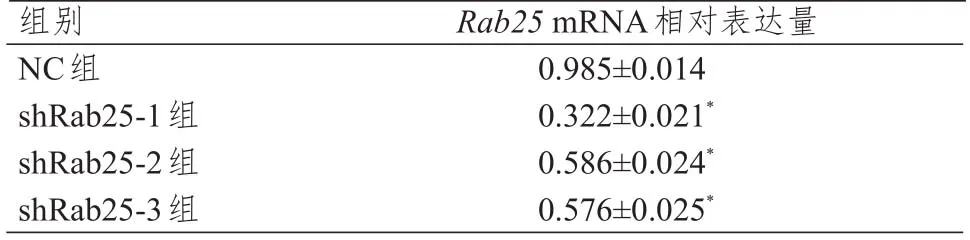
表2 各組細胞中Rab25 mRNA 相對表達量的比較(±s)
注:*與NC組比較,P<0.05
組別NC組shRab25-1組shRab25-2組shRab25-3組Rab25 mRNA相對表達量0.985±0.014 0.322±0.021*0.586±0.024*0.576±0.025*
2.3 Rab25 蛋白表達水平的比較
shRab25-1 組、shRab25-2 組、shRab25-3 組中Rab25 蛋白相對表達量均低于NC 組,差異均有統計學意義(P<0.05),其中shRab25-1 組Rab25 蛋白表達水平最低(圖6、表3),故選取shRab25-1 作為后續實驗用的干擾載體。

圖6 Western blot檢測各組細胞中Rab25蛋白表達情況
表3 各組細胞中Rab25 蛋白相對表達量的比較(±s)
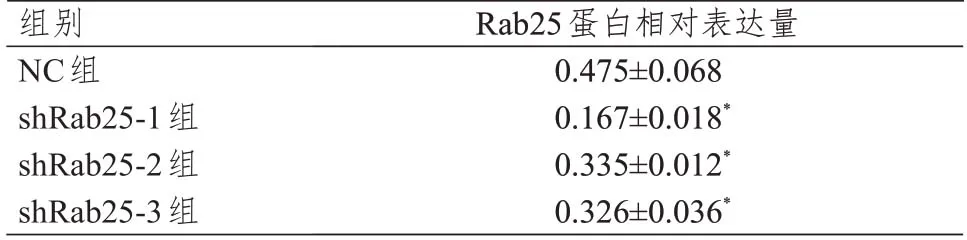
表3 各組細胞中Rab25 蛋白相對表達量的比較(±s)
注:*與NC組比較,P<0.05
組別NC組shRab25-1組shRab25-2組shRab25-3組Rab25蛋白相對表達量0.475±0.068 0.167±0.018*0.335±0.012*0.326±0.036*
2.4 Rab25 沉默對TGF-β介導的前列腺癌細胞EMT 的影響
Rab25沉默后會降低細胞密度,加入TGF-β會部分逆轉這種抑制作用,同時各組細胞形態結構未見明顯破壞(圖7)。shRab25-1 組細胞中E-cadherin 蛋白相對表達量高于NC 組,N-cadherin 蛋白相對表達量低于NC 組,差異均有統計學意義(P<0.05);NC+TGF-β組細胞中E-cadherin 蛋白相對表達量低于NC 組,N-cadherin 蛋白相對表達量高于NC 組,差異均有統計學意義(P<0.05);shRab25-1+TGF-β組細胞中E-cadherin 蛋白相對表達量低于shRab25-1 組,N-cadherin 蛋白相對表達量低于NC+TGF-β組,差異均有統計學意義(P<0.05)。(圖8、表4)

圖7 相差顯微鏡觀察LNCaP細胞經相應處理后的細胞形態學變化(×200)
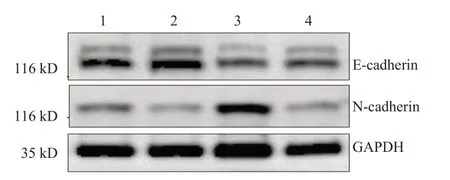
圖8 Western blot檢測各組細胞中E-cadherin、N-cadherin蛋白表達情況
表4 各組細胞中E-cadherin、N-cadherin蛋白相對表達量的比較(±s)
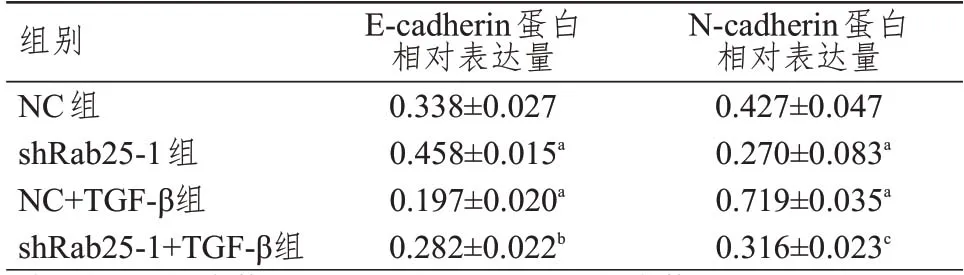
表4 各組細胞中E-cadherin、N-cadherin蛋白相對表達量的比較(±s)
注:a與NC組比較,P<0.05;b與shRab25-1組比較,P<0.05;c與NC+TGF-β組比較,P<0.05
E-cadherin蛋白相對表達量0.338±0.027 0.458±0.015a 0.197±0.020a 0.282±0.022b N-cadherin蛋白相對表達量0.427±0.047 0.270±0.083a 0.719±0.035a 0.316±0.023c組別NC組shRab25-1組NC+TGF-β組shRab25-1+TGF-β組
3 討論
Rab25 是囊泡轉運和膜動力學的主要調節因子,在細胞轉運這一正常生理過程中發揮重要作用,其與配體相互作用的改變及其活性的改變均能引起細胞轉導發生異常,從而影響腫瘤細胞生長、增殖、凋亡、遷移和侵襲[12]。目前的研究表明,Rab25 參與腫瘤細胞遷移和侵襲,在多種腫瘤細胞的轉移過程中具有重要作用[13]。體外沉默Rab25可抑制高級別非小細胞肺癌[14]、成膠質細胞瘤[15]、腎細胞癌[16]和前列腺癌[17]細胞遷移和侵襲。在胃癌細胞中可以觀察到沉默Rab25可以抑制腫瘤細胞侵襲[18]。在膀胱癌的研究中,沉默Rab25不僅能夠抑制體外腫瘤細胞遷移,還能減少體內腫瘤轉移[19]。
EMT是一種進化上保守的發育程序,與致癌有關,通過增強侵襲能力和對凋亡刺激的抵抗力賦予腫瘤細胞轉移特性,被認為是腫瘤惡性轉化中的一個基本事件[20]。隨著對Rab25 及EMT 的不斷深入研究,Rab25 被證實與多種腫瘤的EMT 密切相關。Yin等[21]研究報道,微小RNA(microRNA,miRNA)-577通過抑制乳腺癌中Rab25 的表達來抑制EMT。Jeong 等[22]研究報道,Rab25 可以通過血管內皮生長因子A(vascular endothelial growth factor A,VEGFA)/血管內皮細胞生長因子受體1(vascular endothelial growth factor receptor 1,VEGFR1)信號通路誘導snail家族轉錄抑制因子1(snail family transcriptional repressor 1,SNAIL)表達,導致腫瘤細胞發生轉移和EMT。Calvo等[23]在體外對前列腺癌小鼠模型的研究表明,Rab25的過表達與腫瘤細胞生長、侵襲和新生血管生成有關,并在體外保留了具有增加腫瘤進展的致瘤性特征。既往研究表明,Rab25在前列腺癌中表達升高,體外研究發現Rab25表達下調可抑制前列腺癌細胞增殖、遷移和侵襲,然而Rab25在前列腺癌侵襲轉移過程中的作用機制尚無深入研究[17]。
在前列腺癌的發展過程中,上皮細胞可以發生EMT,其特點是表型從立方體到紡錘形的形態變化,導致細胞與細胞間黏附力喪失,從而使細胞遷移或轉移到不同器官[24]。這種生物行為與生化改變有關,其中上皮細胞標志物如E-cadherin 表達下調,而間質標志物如波形蛋白和N-cadherin 表達上調[25]。上皮性腫瘤中最有效的EMT 誘導劑是TGF-β[26],TGF-β誘導腫瘤細胞發生EMT 常通過SMAD 介導或非SMAD 信號轉導通路,并導致侵襲轉移的發生[27]。TGF-β誘導的EMT 在多種腫瘤中已被證實可被一些特異的分子靶標通過靶向EMT 信號通路抑制[26]。因此,抑制EMT 過程是一種有希望的治療腫瘤轉移的策略。
本研究成功完成了沉默Rab25的PLKO.1-puro-Rab25-shRNA 重組干擾質粒的構建,并成功篩選出能夠高效抑制LNCaP 細胞中Rab25 表達的重組干擾質粒。本研究發現,Rab25沉默后可以減少TGF-β介導的LNCaP 細胞的EMT,表明Rab25 是TGF-β誘導前列腺癌LNCaP 細胞EMT 的一個關鍵中間因子,目前的證據證明Rab25沉默后可以部分逆轉TGF-β介導的前列腺癌細胞的EMT,具體機制有待進一步研究。
綜上所述,Rab25沉默可逆轉TGF-β介導的前列腺癌LNCaP細胞的EMT,這為Rab25成為評估前列腺癌發生發展的重要生物標志物提供了理論依據,Rab25可能成為治療前列腺癌的新型分子靶標。

