補體C3對兒童膿毒癥患者預后的預測價值
彭智慧 顏海鵬 盧秀蘭 張新萍 黃嬌甜 肖政輝
(1.南華大學兒科學院,湖南長沙 410007;2.湖南省兒童醫院重癥醫學科,湖南長沙 410007;3.湖南省兒童醫院急診綜合病房,湖南長沙 410007)
膿毒癥是機體對感染反應失調導致的危及生命的器官功能障礙,是兒科重癥監護病房常見的危急重癥,也是導致危重癥患兒死亡的主要原因之一[1]。膿毒癥患兒可出現免疫功能紊亂[2],研究發現,膿毒癥免疫紊亂在疾病進展中發揮重要作用,深入了解膿毒癥免疫指標變化情況及其機制對膿毒癥疾病診治具有重要作用[3]。補體系統是固有免疫的重要組成部分,膿毒癥發生時,機體產生損傷相關分子模式和病原體相關分子模式,誘導補體系統激活,進一步刺激中性粒細胞和淋巴細胞產生免疫應答,分泌抗體及腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)、γ-干擾素(γ-interferon, IFN-γ)等炎癥因子,對抗病原體入侵。但補體系統的過度活化會導致炎癥反應失調,使膿毒癥疾病進展惡化。研究表明,補體C3水平降低是膿毒癥患兒進展為多器官功能障礙和死亡的危險因素[4],膿毒癥期間補體C3消耗與病情嚴重程度及預后相關[5],但以上研究[4-5]均只是定性地表明補體C3改變與膿毒癥預后的關系。本研究進一步分析補體C3在膿毒癥中的作用,并探討早期判斷膿毒癥嚴重程度及預后的界值,為臨床提供參考。
1 資料與方法
1.1 研究對象
收集2019年11月—2021年9月湖南省兒童醫院重癥醫學科收治的529例膿毒癥患兒為研究對象,所有患兒符合兒童膿毒癥休克(感染性休克)診治專家共識[6]中的診斷標準。排除標準:(1)年齡小于28 d或大于18歲;(2)本次起病接受免疫抑制治療;(3)患有自身免疫性疾病;(4)化療或血液系統疾病和實體腫瘤緩解期患兒;(5)臨床資料不完整者。
1.2 分組
根據患兒入院診斷膿毒癥24 h內補體C3的中位數(0.77 g/L)水平分為C3正常組和C3降低組。根據診斷膿毒癥后28 d預后情況分為存活組和死亡組。死亡組包括搶救無效死亡或積極搶救無法恢復自主呼吸和心跳而放棄治療的患兒。
本研究經湖南省兒童醫院倫理委員會批準(HCHLL-2020-04),并獲得患兒家屬的知情同意。
1.3 資料收集
回顧性收集529例膿毒癥患兒的病例資料。(1)人口學資料:性別、年齡、體重指數;(2)入院24 h內的生命體征、呼吸機使用情況,并進行病情嚴重程度評分[包括兒童快速序貫器官衰竭評分(pediatric Sequential Organ Failure Assessment, p-SOFA)和兒童器官功能障礙評分2(Pediatric Logistic Organ Dysfunction 2, PELOD 2)];(3)診斷膿毒癥24 h內淋巴細胞亞群、體液免疫、補體C3、補體C4、血常規、降鈣素原(procalcitonin, PCT)、C反應蛋白(C reactive protein, CRP)、白細胞介素(interleukins, IL)-6、IL-10、肝功能、腎功能、心肌酶、凝血功能等檢查結果。
1.4 統計學分析
采用SPSS 25.0軟件進行統計學分析。非正態分布的計量資料采用中位數(四分位數間距)[M(P25,P75)]表示,兩組間比較采用Mann-WhitneyU檢驗;計數資料以例數和率(%)表示。Spearman秩相關分析補體C3與臟器損傷指標的相關性。采用logistic回歸分析影響膿毒癥預后的因素。采用受試者操作特征曲線(receiver operating characteristic curve, ROC曲線)評價預后相關危險因素對膿毒癥預后的預測價值。使用PASS 11.0軟件進行樣本量估算。使用MedCalc v19.2.6軟件Z檢驗對預測指標的曲線下面積(area under the curve,AUC)進行比較。P<0.05認為差異具有統計學意義。
2 結果
2.1 存活組和死亡組一般臨床資料比較
529例膿毒癥患兒中,存活組471例(89.0%),死亡組58例(11.0%)。死亡組呼吸機使用率、PCT水平、病情嚴重程度評分(p-SOFA評分及PELOD 2評分)均高于存活組,差異均有統計學意義(P<0.05)。見表1。
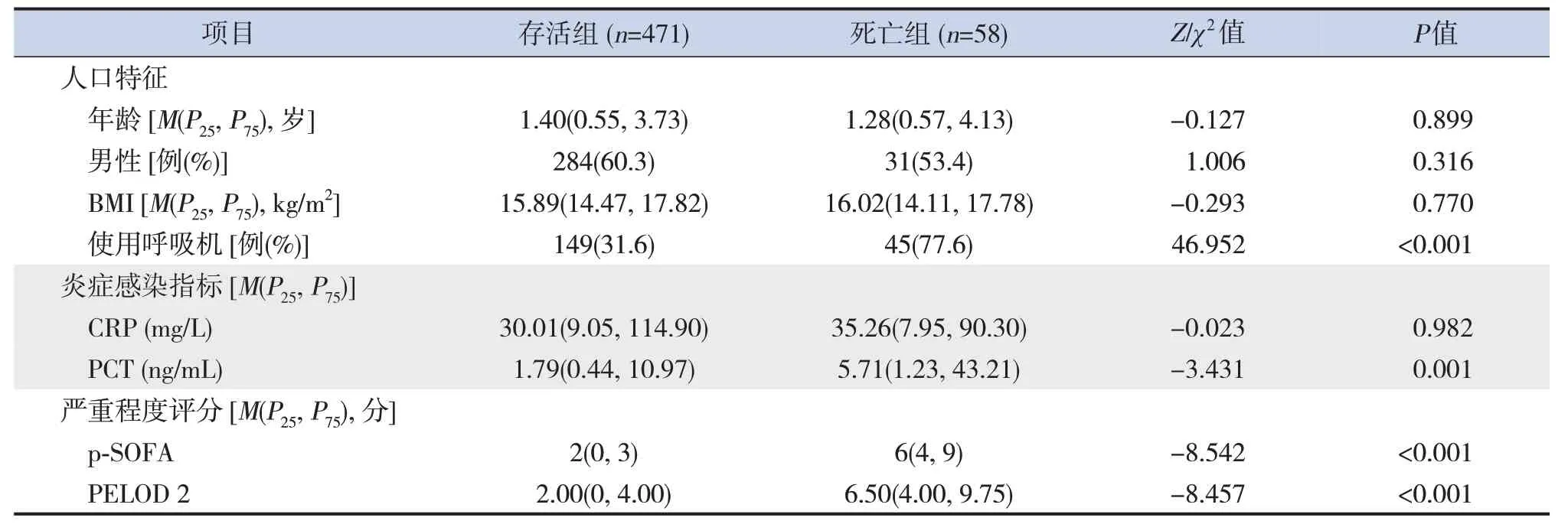
表1 存活組和死亡組一般臨床資料比較
2.2 存活組和死亡組免疫學相關指標比較
死亡組補體C3、補體C4、IgM、輔助性T細胞/抑制性T細胞、輔助/誘導性T淋巴細胞、總T淋巴細胞、T淋巴細胞+B淋巴細胞+NK細胞、單核細胞比值低于存活組,IL-6和IL-10水平高于存活組(P<0.05),見表2。
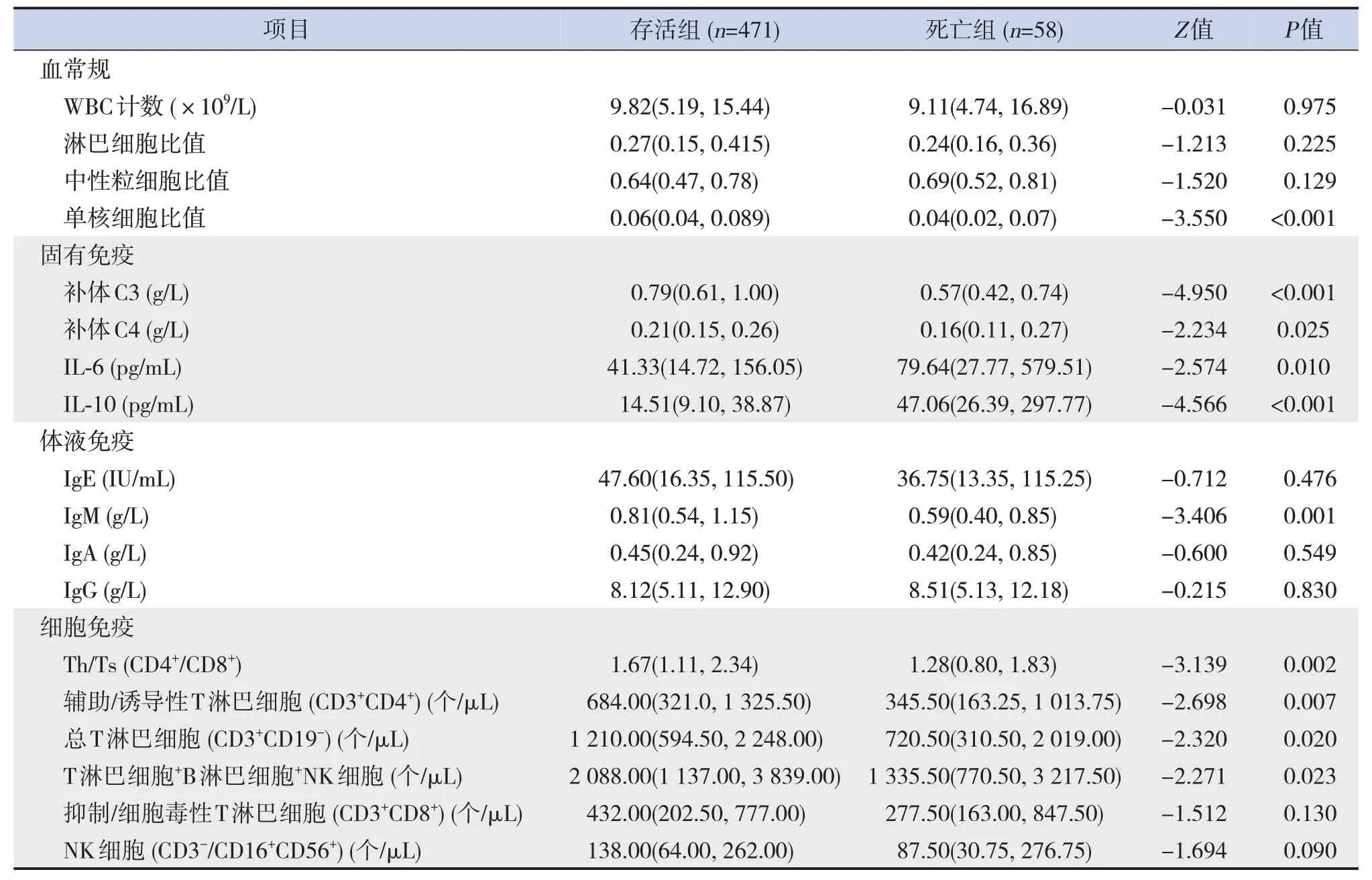
表2 存活組和死亡組免疫學相關指標比較 [M(P25,P75)]
2.3 C3降低組和C3正常組一般臨床資料比較
C3降低組呼吸機使用率、PCT水平,以及p-SOFA及PELOD 2評分高于正常組(P<0.05),CRP水平低于C3正常組(P<0.05),見表3。

表3 C3降低組和C3正常組一般臨床資料比較
2.4 補體C3與膿毒癥患兒臟器損傷指標的相關分析
補體C3與p-SOFA評分、PCT水平呈負相關(分別rs=-0.26、-0.41,P<0.001)。在臟器損傷指標中,補體C3與谷草轉氨酶、谷丙轉氨酶、尿素氮、肌酸激酶同工酶均呈負相關(分別rs=-0.42、-0.35、-0.20、-0.46,P<0.001)。在凝血功能指標中,補體C3與凝血酶原時間、凝血酶時間、國際標準化比值均呈負相關(分別rs=-0.24、-0.36、-0.24,P<0.001),與纖維蛋白原、抗凝血酶Ⅲ及血小板計數呈正相關(分別rs=0.52、0.37、0.28,P<0.001)。
2.5 膿毒癥患兒死亡的危險因素分析
對C3正常組與C3降低組間基線差異有統計學意義的指標(年齡、性別、體重指數)進行單因素logistic回歸分析,結果顯示3個因素與死亡均無顯著關聯(均P>0.05),因此未納入多因素logistic回歸模型。多因素logistic回歸分析結果顯示,p-SOFA得分高(OR=1.504,95%CI:1.351~1.673,P<0.001)、補體C3低(OR=0.261,95%CI:0.082~0.833,P=0.023)與膿毒癥患兒死亡密切相關。見表4。
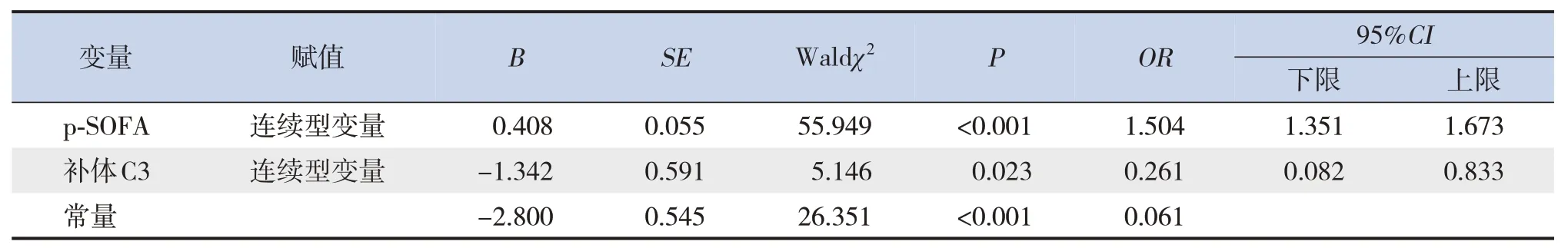
表4 膿毒癥死亡危險因素的多因素logistic回歸分析
2.6 p-SOFA和補體C3對膿毒癥患兒死亡的預測價值
當p-SOFA的截斷值取3.5分時,AUC為0.839(95%CI:0.787~0.891),靈敏度為75.9%,特異度為76.0%,約登指數為0.519;當補體C3的截斷值取0.685 g/L時,AUC為0.699(95%CI:0.623~0.775),靈敏度為66.2%,特異度為69.0%,約登指數為0.352;p-SOFA和補體C3聯合的AUC為0.852(95%CI:0.801~0.902),靈敏度為77.6%,特異度為83.2%,約登指數為0.608。p-SOFA和補體C3聯合的AUC顯著高于p-SOFA及補體C3單項指標的AUC(分別Z=3.193、4.245,分別P=0.003、P<0.05)。見圖1。
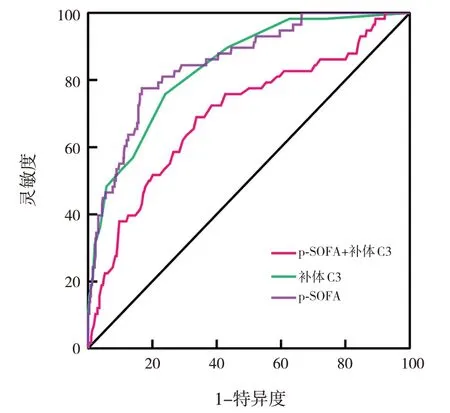
圖1 p-SOFA和補體C3預測膿毒癥患兒死亡的ROC曲線
3 討論
膿毒癥是全世界兒童死亡的主要原因之一[7],可能會導致休克和多器官功能障礙[8],膿毒癥存在全身炎癥反應和免疫抑制,但目前對于膿毒癥機體免疫功能紊亂的機制及具體作用認識不足,缺乏有效的免疫監測和治療措施[9]。
免疫系統在膿毒癥疾病過程中發揮重要作用,膿毒癥患兒免疫學指標有明顯改變,可作為評估病情和預后的參考指標[10]。補體系統的激活途徑均形成C3轉化酶,將補體C3轉化為C3a和C3b,發揮促炎作用,可見補體C3在補體系統中的核心地位[11]。研究發現,與野生型小鼠相比,補體C3缺陷的小鼠無法形成膜攻擊復合物,導致無法進一步介導靶細胞壞死凋亡,使得膿毒癥組小鼠病死率明顯升高,證明補體C3在膿毒癥發病機制和病情進展中發揮重要作用[12]。
在本研究中,死亡組補體C3、C4水平低于存活組,而IL-6和IL-10水平高于存活組,表明在膿毒癥早期,補體系統活化可能參與了膿毒癥炎癥反應和免疫抑制過程,導致不良預后。Lei等[13]研究結果顯示,在診斷膿毒癥的第1天和第2天,死亡組補體C3水平均顯著低于存活組,并發現補體C3降低是膿毒癥患者死亡的危險因素。也有學者研究發現革蘭氏陰性桿菌感染所致的膿毒癥患者,補體C3降低和IL-10升高往往預示著不良預后[14]。
本研究結果提示膿毒癥中補體消耗與疾病嚴重程度有關。PCT被認為是細菌感染的特異標志物,補體C3消耗與PCT水平呈負相關,與Ren等[15]研究結果一致。同時,本研究結果也顯示補體C3參與了膿毒癥器官功能損傷,與孫杭等[4]研究結果一致。其機制可能是膿毒癥期間補體系統的強烈激活,活化的中性粒細胞和巨噬細胞,以及補體激活產物C5b-9等刺激炎癥因子過度釋放,導致全身炎癥反應綜合征,使得正常組織器官受損[16]。
本研究發現,膿毒癥補體活化與凝血功能異常存在相關性。研究證實,補體消耗與膿毒癥凝血功能障礙密切相關[15,17],補體系統和凝血系統有著復雜的關聯[18]。凝血系統可影響補體的轉化,凝血酶、纖溶酶和凝血因子可以作為補體C3、C5的天然轉化酶,將補體C3、C5裂解成C3a和C5a,介導后續炎癥反應的發生[19],過度的炎癥反應可能損傷血管內皮細胞,進一步激活凝血系統。而補體在膿毒癥凝血功能障礙中也發揮重要作用,使用補體C3轉化酶抑制劑可以有效防止膿毒癥誘導的補體激活,并減少凝血酶的激活,阻斷凝血激活的級聯反應[20]。有學者對膿毒癥并發彌散性血管內凝血的患者血標本進行檢測,發現合并彌散性血管內凝血的患者體內補體C3水平更低[21]。C5a也被認為可直接誘導凝血系統激活[22]。
在許多嚴重的疾病如膿毒癥、休克、創傷等疾病中常常伴隨有補體活化,在重癥監護室住院患者中監測補體水平有利于及時對病情進行判斷[23],甚至可通過干預補體水平對疾病進行治療。研究發現,對缺血性腦卒中小鼠使用補體C3轉化酶抑制劑可減小梗死面積,改善神經功能和提高生存率[24]。但有學者對209例膿毒癥患者補體C3水平進行分析,發現在重癥膿毒癥患者中,SOFA得分、膿毒癥休克發生率及病死率均與補體水平無相關性,認為當疾病進展到嚴重膿毒癥或膿毒癥休克時,補體系統已被深度激活,與失調的炎癥反應不再相關,對臨床結局影響甚微,提示重癥膿毒癥患者體內的補體激活對臨床結局沒有預測價值[25]。
本研究尚存在一些不足之處:為單中心研究,僅關注補體C3在一個時間點的改變情況,但補體系統激活程度會隨膿毒癥疾病進展發生改變,后續可對補體系統其他指標進行檢驗,并針對不同時間點進行分析。
綜上所述,膿毒癥患兒存在補體消耗,聯合補體C3與p-SOFA對膿毒癥患兒死亡結局有良好的預測價值,補體C3降低可作為膿毒癥患兒死亡結局的風險預測因子,并確定補體C3截斷值為0.685 g/L,該截斷值有待于在更大規模數據中進一步驗證,有助于臨床識別高風險患者,并在臨床決策時提供參考價值。
利益沖突聲明:所有作者均聲明無利益沖突。

