全懸浮培養LMH細胞制備FAdV-4滅活疫苗的研究
秦紅剛,韓 興,秦 偉,李晶梅,熊 亮,余繼欽,謝紅玲,漆世華,李凌峰,石寶蘭
(國藥集團動物保健股份有限公司,武漢 430075)
禽腺病毒(Fowl Adenovirus,FAdV)屬于腺病毒科禽腺病毒屬,根據特異性抗原的不同,分為Ⅰ、Ⅱ和Ⅲ三個群,其中Ⅰ群主要分為5個種(A~E),包含12個血清型[1]。近年來,Ⅰ群血清4型禽腺病毒(FAdV-4)持續流行,給養雞業造成嚴重經濟損失[2]。FAdV-4感染主要引起發病雞的心包積液、包涵體肝炎等癥狀[1-2],疫苗免疫可有效防控FAdV-4感染[3]。制備疫苗用到的FAdV-4抗原,可通過雞胚、原代雞胚肝細胞或雞肝癌細胞系(LMH)培養FAdV-4獲得[1],有研究顯示FAdV-4在LMH細胞上增殖效果較好[4-5]。LMH細胞是1981年由T Kawaguchi等,利用患肝細胞癌的白萊航雞肝細胞經二乙基亞硝胺致突變培育而成[6]。LMH為貼壁依賴性細胞,大規模培養常采用轉瓶、細胞工廠或者微載體懸浮培養,限制了生產規模快速放大。將貼壁生長的ST[7]、BHK-21[8]等細胞馴化為可以全懸浮培養的細胞用于疫苗生產能顯著提高生產效率。本研究成功將LMH細胞馴化為全懸浮培養的細胞,并研究了培養FAdV-4的工藝參數,為FAdV-4疫苗的大規模工業化生產提供依據。
1 材料和方法
1.1 細胞、病毒和培養基 LMH細胞、FAdV-4 CPHB03株、FAdV-4瓊擴抗原為國藥集團動物保健股份有限公司保存;DMEM培養基為Hyclone公司產品;103B培養基為深圳壹生科生物科技公司產品;新生牛血清(NBS)為內蒙古金源康公司產品。
1.2 主要儀器和耗材 搖瓶為康寧公司產品;搖床CO-06型為美國精騏公司產品;3L、10L、100L生物反應器為廣州齊志生物工程設備有限公司產品。
1.3 LMH細胞全懸浮培養的馴化 將貼壁生長的LMH細胞從DMEM培養基逐步更換至103B培養基,同時降低牛血清的比例,讓其適應103B培養。
1.3.1 培養液的配制 按表1配制培養液。
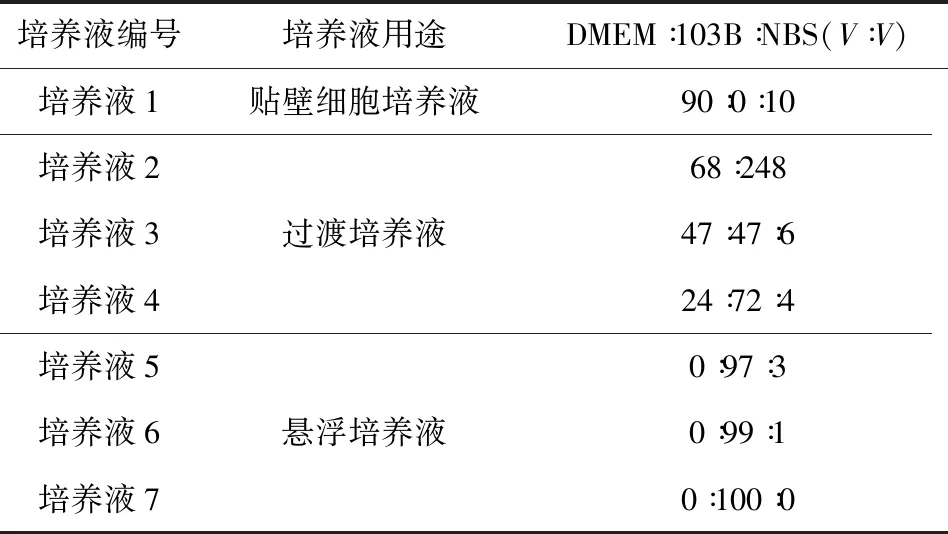
表1 培養液配制表Tab 1 Preparation of culture medium
1.3.2 細胞馴化 取T75方瓶貼壁培養的LMH細胞,胰酶消化分散后接種于搖瓶并加入培養液2,使細胞密度為1.5×106/mL,置于37 ℃,5% CO2130 r/min搖床培養2日,取樣觀察細胞形態和計數細胞密度;1000 r/min,離心5 min,棄上清,加入培養液2重懸細胞,使細胞密度為1.5×106/mL,繼續培養數代,待細胞生長穩定后,采用相同的方法適應培養液3~培養液7。待細胞完全適應懸浮培養后,擴大培養并凍存細胞,將其命名為LMH-S。將LMH-S細胞連續傳代25代,觀察細胞狀態、計數細胞密度和細胞活率,確定細胞傳代穩定性。
1.4 LMH-S細胞接種密度的確定及生物反應器培養 將LMH-S細胞分別以0.2×106/mL、0.5×106/mL和1.0×106/mL的初始密度接種于搖瓶,進行懸浮培養。取樣計數細胞密度和活性,確定細胞的最佳接種密度。按確定的細胞最佳初始密度接種3個3 L生物反應器,分別設置攪拌轉速為50 r/min、75 r/min、100 r/min,其他培養參數均為:37 ℃、pH7.0和DO 50%,每天取樣計數細胞密度和活性,確定生物反應器懸浮培養LMH-S細胞的可行性和最適攪拌轉速。
1.5 LMH-S細胞懸浮培養FAdV-4
1.5.1 接毒時最佳細胞密度、接毒量和收獲時間將對數生長中后期的LMH-S細胞分別稀釋成2.0×106/mL、3.0×106/mL和4.0×106/mL,每種密度的細胞分別接種3個125 mL搖瓶,20 mL/瓶,然后每個密度的細胞分別按0.01 MOI、0.1 MOI、1 MOI接種FAdV-4。將細胞置于37 ℃,5% CO2130 r/min搖床培養,每12 h取樣一次,測定樣品的病毒含量。根據病毒含量確定接毒時細胞最佳密度、接毒量和培養時間。
1.5.2 生物反應器懸浮培養FAdV-4 用 100L生物反應器及1.5.1項確定的工藝參數培養FAdV-4。將搖瓶培養的LMH-S細胞接種到10L生物反應器,待細胞密度達到4.5×106/mL時,接種到100L生物反應器,接種FAdV-4病毒,適時收獲細胞培養物,測定病毒含量。
1.6 懸浮培養的FAdV-4免疫原性研究 將懸浮培養的FAdV-4病毒液滅活后,制備成油乳劑滅活疫苗,將疫苗頸部皮下接種3 周齡SPF雞,每只接種劑量分別為0.3 mL、0.1 mL、0.05 mL、0.02 mL,每個劑量接種10 只。免疫后21 日,每組雞分別采血,測定血清的瓊擴效價。同時連同對照組雞10只,每只雞經肌肉注射FAdV-4 CPHB03株強毒,每只0.5 mL(含5×105.0TCID50)。攻毒后觀察7 d,記錄雞的臨床癥狀和死亡情況,觀察期結束后剖檢存活雞,觀察是否有心包積液、肝臟壞死等病變,以此確定疫苗的有效性。
2 結果與分析
2.1 LMH細胞全懸浮培養的馴化 轉入搖瓶懸浮培養的LMH細胞,F1~F3代有結團,結團細胞占總細胞數的比例高(圖1A),活率60%~75%;F6~F9代以單個細胞為主,結團細胞占總細胞數的比例低(圖1B),活率70%~85%;F12代細胞均為單個細胞(圖1C),密度4.1×106/mL,活率92%。說明通過逐步降低牛血清含量并更換懸浮培養基,已將LMH細胞馴化為適應無血清懸浮培養的細胞,命名為LMH-S細胞。將LMH-S連續傳代培養25代,各代次細胞大小均一、飽滿,培養3~4 d,細胞密度穩定在4×106~6×106/mL,活率90%以上(圖2),細胞傳代穩定性良好。
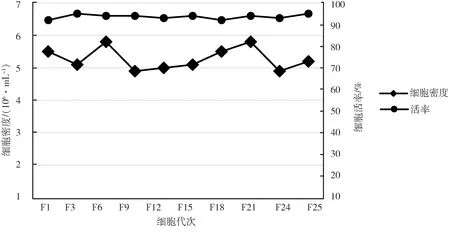
圖2 LMH-S細胞傳代生長穩定性Fig 2 The stability of LMH-S cells through passage
2.2 LMH-S細胞接種密度的確定及生物反應器培養 將LMH-S以不同的初始細胞密度接種搖瓶進行懸浮培養,初始細胞密度為0.2×106/mL時,細胞生產緩慢,活率下降較快;初始細胞密度為0.5×106/mL和1×106/mL,培養3~4 d細胞密度5×106/mL~6×106/mL(圖3)。以0.5×106/mL的密度接種3 L生物反應器,攪拌轉速100 r/min,細胞生長慢、活率低;攪拌轉速50 r/min,部分細胞結團影響細胞的生長和活率;攪拌轉速75 r/min,96 h~144 h細胞密度為6.0×106/mL以上,活率90%以上(圖4)。確定生物反應器懸浮培養LMH-S細胞最佳條件為:初始細胞密度0.5×106/mL~1×106/mL,攪拌轉速75 r/min。

圖3 不同初始密度接種時LMH-S細胞增殖曲線Fig 3 Growth curves of LMH-S cells inoculated with different cell densities
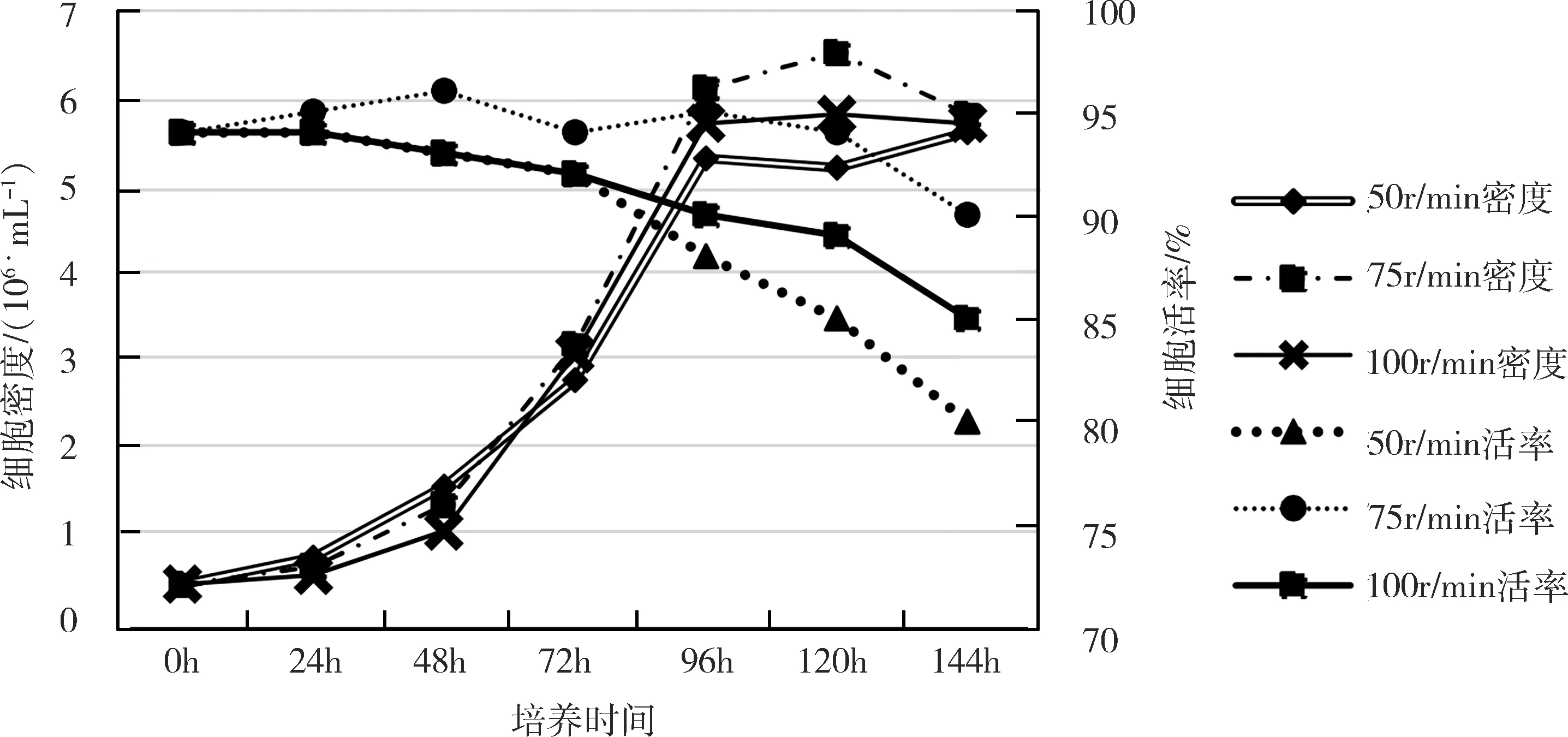
圖4 生物反應器懸浮培養攪拌速度對LMH-S細胞生長的影響Fig 4 Effect of stirring rate in suspension culture of bioreactor on growth of LMH-S cells
2.3 FAdV-4懸浮培養工藝研究 以病毒含量為最優參數的篩選標準,接毒量0.1MOI和1MOI優于0.01MOI;細胞密度2.0×106/mL和3.0×106/mL優于4.0×106/mL。細胞密度2.0×106/mL和3.0×106/mL、接毒量0.1MOI和1MOI培養抗原,所獲病毒含量均不低于109.5TCID50/mL。接毒后隨著培養時間的延長,病毒含量逐漸升高,至60 h達到高峰,隨后降低(表2)。因此確定接毒時細胞密度為2.0×106/mL~3.0×106/mL,接毒量為0.1~1 MOI,接毒后48~72 h收獲。
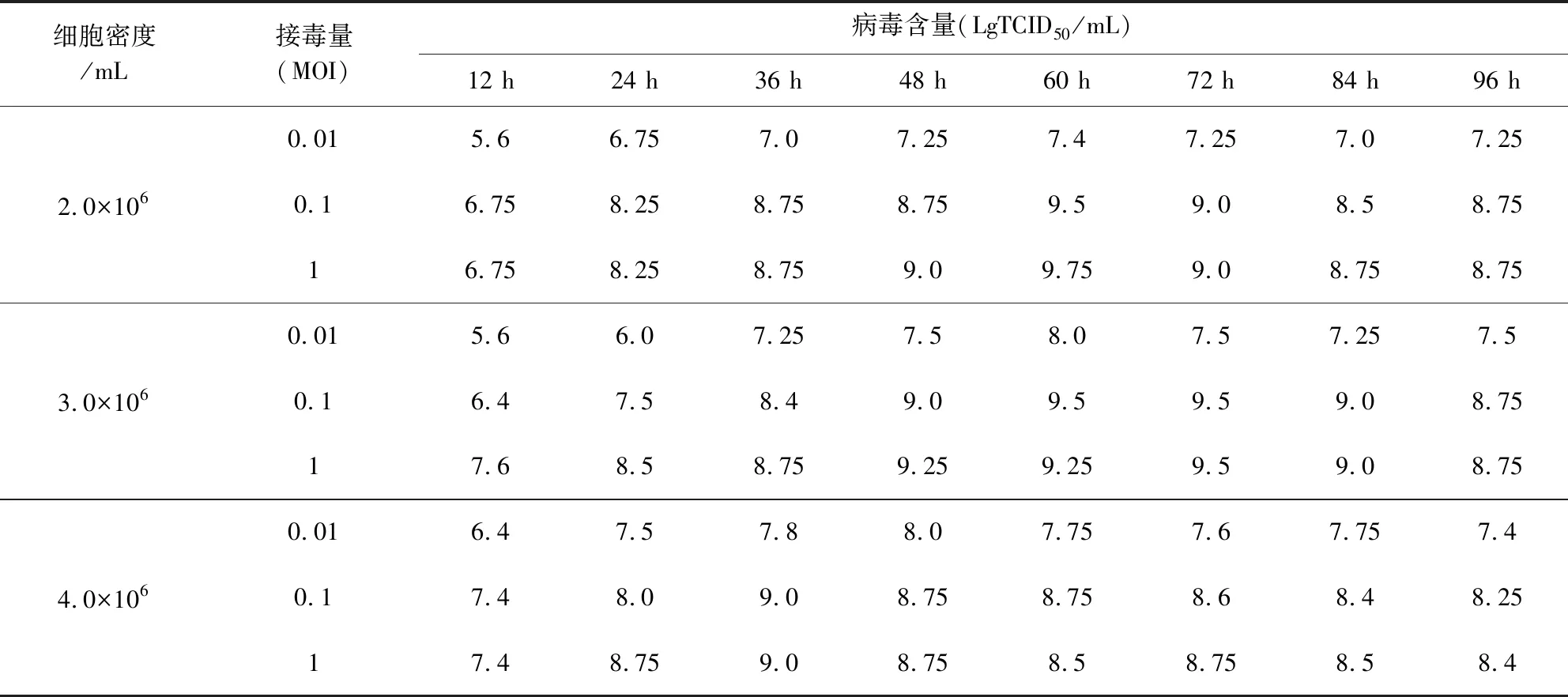
表2 接毒時不同細胞密度和接毒量對病毒增殖的影響Tab 2 Effects of different cell density and MOI on virus proliferation
2.4 生物反應器培養FAdV-4 用100L生物反應器及2.2項確定的工藝參數懸浮培養FAdV-4。結果顯示,接毒后60 h病毒含量均不低于109.25TCID50/mL,最高達到1010TCID50/mL(圖5)。
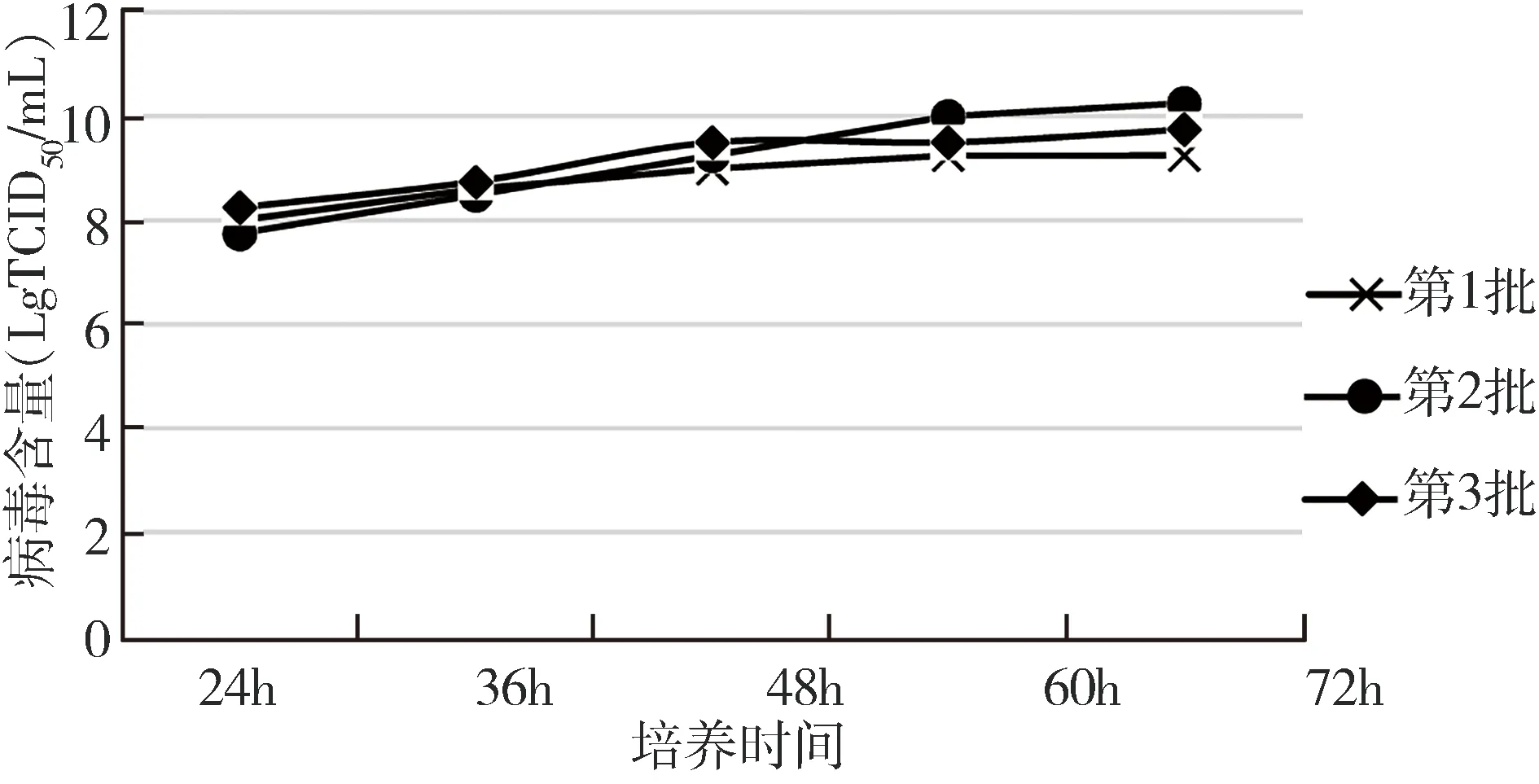
圖5 生物反應器培養病毒增殖曲線Fig 5 Virus proliferation curve in bioreactor culture
2.5 FAdV-4疫苗的有效性研究 血清檢測結果顯示,免疫后21日0.02 mL組 8/10抗體陽性,其他三組均10/10抗體陽性;攻毒結果顯示,0.02 mL組9/10保護,其他三組均10/10保護,攻毒對照全部發病且8/10死亡(表3)。說明懸浮培養制備的FAdV-4抗原具有良好的免疫原性。
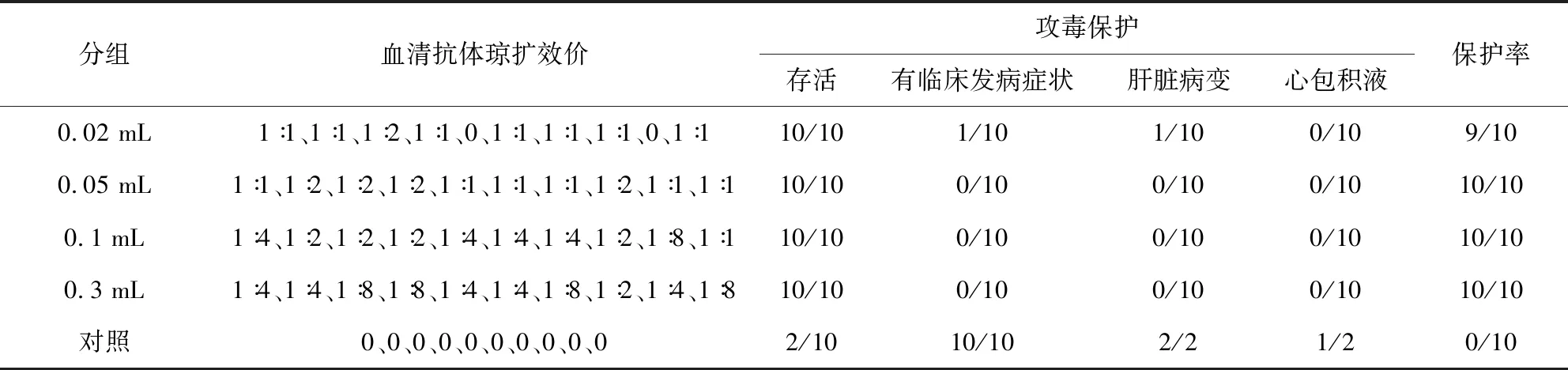
表3 FAdV-4疫苗免疫雞攻毒保護情況Tab 3 FAdV-4 vaccine challenge protection of chickens
3 討論與結論
目前FAdV-4的防控主要是滅活疫苗免疫,其抗原生產多采用轉瓶和紙片載體懸浮培養LMH細胞[9]擴繁FAdV-4,這是基于LMH細胞的貼壁特性,培養過程中需要為細胞的生長提供有效的貼附表面。LMH細胞的傳代和擴大培養采用胰酶消化分散細胞,操作繁瑣,制約了生產規模的快速放大。單細胞全懸浮培養以其無需載體、操作簡單、易于放大,成為當前懸浮培養的主流技術[10]。將LMH細胞馴化成單細胞全懸浮培養細胞,建立簡單、高效的FAdV-4滅活疫苗抗原生產工藝,意義重大。
將貼壁培養的細胞馴化為全懸浮培養的細胞,常用方法是逐步降低培養液中的血清含量,使細胞適應無血清貼壁培養,再用搖瓶懸浮培養并優化培養條件,實現細胞懸浮培養[11-12]。本研究嘗試將降低血清含量和懸浮培養馴化同步進行,此方法能否成功的關鍵是LMH細胞經胰酶分散后能否直接適應搖瓶懸浮培養。結果顯示,未適應無血清貼壁培養LMH細胞可直接轉入搖瓶中懸浮培養,雖然細胞有結團但活率可達60%~75%。分析是培養液中添加的用于細胞懸浮培養的103B培養基對LMH細胞在懸浮狀態下生長提供了營養和支撐。后續逐步增加103B培養基比例并降低血清和DMEM比例,經過12代的傳代培養馴化,獲得一株可在無血清培養基中懸浮培養的LMH細胞(命名為LMH-S)。相對常規馴化方法,本研究通過將適應無血清和懸浮培養馴化同步進行的方式,縮短了細胞傳代馴化的時間。貼壁培養的LMH細胞密度一般為1.3×106/mL~2.2×106/mL[13],而LMH-S細胞經過細胞接種密度的優化,懸浮培養3 d~4 d細胞密度5×106/mL~6×106/mL,比貼壁細胞有顯著提升;連續傳代25代,細胞生長穩定;且可在生物反應器中高密度懸浮培養。
在滅活疫苗研制中,抗原效價的高低不僅影響免疫效果,而且直接影響疫苗成本。本研究對LMH-S全懸浮培養FAdV-4的工藝進行優化,確定接毒時細胞的密度為2.0×106/mL~3.0×106/mL,接毒量為0.1~1MOI,接毒后培養48~72 h收獲,病毒含量最高可達109.75TCID50/mL,相對于紙片載體懸浮培養,病毒含量提高10倍以上[9],為高效FAdV-4滅活疫苗的研制奠定了基礎。在懸浮培養放大工藝研究中,采用10 L和100 L生物反應器逐級放大培養,連續培養3批,接毒后60 h,病毒含量均不低于109.25TCID50/mL,最高達到1010TCID50/mL,工藝穩定,且可放大。將懸浮培養的FAdV-4病毒液滅活后,制備疫苗,免疫0.02 mL、0.05 mL、0.1 mL、0.3 mL疫苗的試驗雞的攻毒保護率分別為9/10、10/10、10/10、10/10,達到良好的免疫保護效果。
綜上所述,建立了LMH全懸浮培養細胞株,確定了FAdV-4抗原的生物反應器懸浮培養工藝,生物反應器懸浮培養制備的FAdV-4滅活疫苗有效性良好。本研究確定的生產工藝培養的抗原病毒含量高,全懸浮培養無需載體,生產放大無需胰酶,操作簡潔,生產效率高生產成本低。以上研究為高效FAdV-4滅活疫苗的研制奠定了基礎。另外,建立的LMH全懸浮培養細胞株也可嘗試應用于其他禽用疫苗抗原培養研究。

