棉花NLP(Nin-Like Protein)基因家族的全基因組鑒定及表達分析
丁國華,肖光輝,竺麗萍
棉花NLP(Nin-Like Protein)基因家族的全基因組鑒定及表達分析
丁國華,肖光輝,竺麗萍
陜西師范大學生命科學學院,西安 710119
【目的】全基因組范圍內探究棉花NLP轉錄因子的結構特點及進化特征,深入了解棉花NLP轉錄因子表達模式,為后續NLP的功能研究和利用奠定基礎。【方法】采用blastp和HMMsearch 2種策略進行搜索,鑒定亞洲棉、雷蒙德氏棉、海島棉、陸地棉4種棉花全基因組范圍內的NLP轉錄因子家族成員。對確認后的棉花NLP家族成員進一步展開生物信息學分析,利用在線軟件Expasy對分子量、理論等電點等理化性質進行預測;使用MEGA 7軟件構建系統進化樹;通過網站MEME進行蛋白保守基序分析;運用在線軟件GSDS 2.0分析基因結構;TBtools進行染色體定位繪制;McscanX進行棉花NLP家族復制基因分析;利用PlantCARE網站預測棉花NLP基因家族啟動子元件;通過TBtools繪制不同組織及非生物脅迫下棉花NLP基因表達熱圖,分析組織表達特性和響應非生物脅迫的特征。通過RT-qPCR分析缺氮和復氮處理后棉花NLP基因的表達情況。【結果】從亞洲棉、雷蒙德氏棉、海島棉、陸地棉蛋白數據庫中分別篩選出11、11、21和22個NLP轉錄因子成員,家族蛋白序列長度為693—996個氨基酸,相對分子質量為76.92—110.02 kDa,理論等電點為5.13—7.77,亞細胞定位幾乎均定位于細胞核中,NLP基因啟動子區發現大量激素響應和逆境響應順式作用元件。系統進化分析將棉花NLP蛋白分為Ⅰ、Ⅱ和Ⅲ組,基因復制分析發現片段復制是NLP基因在棉花中擴張的主要方式。Ka/Ks均小于1顯示棉花中NLP基因進化主要經歷純化選擇。表達分析結果也證實棉花響應氮饑餓和復氮過程。【結論】從亞洲棉、雷蒙德氏棉、海島棉、陸地棉中分別鑒定獲得11、11、21和22個NLP轉錄因子成員,它們之間具有較高的保守性,又有一定程度的差異。陸地棉在缺氮及復氮處理過程中表達量發生顯著變化,可能在棉花響應硝酸鹽過程中具有一定作用。
棉花;NLP轉錄因子;氮信號;生物信息學
0 引言
【研究意義】棉花是世界上重要的天然纖維作物及油籽作物,作為世界紡織工業的重要支柱,在全球80多個國家均有種植[1]。隨著全球氣候和生態環境的變化,棉花的生長受到低溫、高溫、干旱、鹽堿脅迫等多種環境壓力的影響,這些逆境脅迫影響作物生理和代謝過程,從而影響其生長發育,最終影響作物產量及質量,降低經濟效益[2-3]。干旱脅迫影響植物對氮素的吸收和利用[4],而氮素作為一種大量元素,在維持植物的發芽、生長發育、開花結果、抗逆性及產量等方面均有著必不可少的作用[5]。硝酸鹽是土壤中氮元素存在的主要形態之一,對植物的生長發育具有關鍵的生理及營養作用[5]。氮信號通路基因和轉錄因子(包括硝酸鹽轉運蛋白基因(nitrate transporter,NRT)、硝酸還原酶基因(nitrate reductase,NR)、亞硝酸還原酶基因(nitrite reductase,NiR)等)在硝酸鹽吸收和同化過程中發揮關鍵作用[6-10]。NLP(NIN-like protein)轉錄因子在植物氮信號中有著重要的作用[11],通過研究棉花NLP家族可以進一步了解棉花氮素調節相關基因,對探究棉花的氮素吸收與同化的調控機制具有重要意義,為進一步提高棉花氮肥利用效率提供參考。【前人研究進展】擬南芥中鑒定的第一個感應硝酸鹽轉運蛋白NRT1.1,可以被CIPK23和CIPK8磷酸化,以調節高親和力或低親和力的硝酸鹽反應[6]。NRT1.1是細胞外質膜硝酸鹽轉運傳感器,而NLP7被證實是細胞內硝酸鹽傳感器[11]。NLP是一類植物特異性轉錄因子家族,在硝酸鹽信號轉導和同化過程中發揮重要作用[12]。NIN(nodule inception)蛋白最早在豆科模式植物百脈根中被鑒定,起初作為調控共生根瘤早期發育的調節因子[13]。之后在非豆科植物(包括擬南芥[14]、水稻[14]、小麥[15]、玉米[12]、毛果楊[9]、枳[10]、甘藍型油菜[16]、番茄[17]等)中鑒定到Nin同源蛋白Nin-like蛋白。研究發現NLP轉錄因子均具有2個典型的特征結構域,氨基端具有高度保守的RWP-RK結構域,可以與啟動子上響應硝酸鹽的順式作用元件(nitrate-responsive-element,NRE)結合,激活和調控下游基因的表達[18-20]。羧基端具有PB1結構域,能與其他含有該結構域的蛋白形成二聚體[14]。此外,在其序列的氨基端還有一個GAF-like結構域,在維管植物中,GAF結構域存在于植物色素和與乙烯信號相關的蛋白質中[21-23],但在NLP蛋白中,其功能尚不明確[18]。在模式植物擬南芥中,已對NLP轉錄因子功能進行了大量研究,擬南芥NLPs可以結合硝酸鹽響應順式元件在初級氮響應調節中起重要作用[20, 24-25]。AtNLP7可與一些氮通路關鍵基因(包括、、、、等)結合,激活或抑制下游基因來調控氮同化和氮代謝[26-27]。過表達擬南芥可增強氮和碳的同化,在缺氮和氮充足的條件下均能夠促進植物生長[28]。AtNLP8被證實可以直接與脫落酸分解代謝酶基因()的啟動子結合,是硝酸鹽促進種子萌發的主要調節因子[29]。研究發現,在持續的硝酸鹽和氮饑餓條件下,AtNLP6和AtNLP7可與另一個關鍵轉錄調控因子TCP20相互作用,在調控硝酸鹽響應基因的表達過程中發揮重要作用[30]。在硝酸鹽環境中,硝酸鹽觸發Ca2+信號偶聯鈣依賴性蛋白激酶CPK10/CPK30/CPK32,并在S205位點磷酸化NLP7以確保其定位在核中,并激活初級硝酸鹽響應,該信號在營養生長網絡中對形成組織器官結構和生物量至關重要[31]。過量表達促進水稻生長,提高水稻氮素利用率和產量[32]。在中等氮水平條件下,過量表達株系的氮利用效率顯著提高47%,產量較野生型顯著提高30%[33]。另外,研究發現,敲除擬南芥比野生型表現出較強的抗旱能力[24],可見NLP轉錄因子不僅在調控氮素信號中具有非常重要的作用[18],而且對調節植物抗旱性有一定作用。【本研究切入點】雖然在一些植物中對NLP轉錄因子家族進行了鑒定,但有關棉花NLP的相關研究尚未見報道。四倍體陸地棉(,(AD)1)和海島棉(,(AD)2)起源于100萬—150萬年前[34]。棉花基因組學的發展為棉花基因家族的鑒定提供了必需的資源,多個高質量的基因組數據庫(包括2個二倍體棉花——雷蒙德氏棉(,(D5))[35]和亞洲棉(,(A2))[36],以及2個異源四倍體棉花——陸地棉(,(AD1))[37-39]和海島棉(,(AD2))[38])為鑒定棉花NLP基因及其潛在功能奠定基礎。【擬解決的關鍵問題】本研究基于已發表的4種棉花基因組,采用生物信息學手段,對亞洲棉、陸地棉、海島棉及雷蒙德氏棉全基因組范圍內NLP轉錄因子成員進行鑒定,并從基因和蛋白水平上對其進行系統地分析,此外,還分析了陸地棉NLP基因組織表達、纖維發育過程、非生物脅迫下的表達情況,以及通過實時熒光定量PCR對氮饑餓和復氮過程的表達進行分析,為棉花NLP轉錄因子特點與功能的進一步探究提供依據。
1 材料與方法
1.1 植物材料與處理
將飽滿、均一的陸地棉種子(徐州142)播種于蛭石,置于30 ℃ 16 h光照/28 ℃ 8 h黑暗條件下。待種子萌發后,挑選長勢一致的幼苗,用去離子水洗凈根后置于營養液(2.14 mmol·L-1KH2PO4、3 mmol·L-1MgSO4、1.3 mmol·L-1Ca(NO3)2、1.5 mmol·L-1KNO3、25 μmol·L-1H3BO3、2 μmol·L-1ZnSO4、2 μmol·L-1MnCl2、0.5 μmol·L-1CuSO4、0.5 μmol·L-1Na2MoO4和20 μmol·L-1Fe-EDTA)中培養3周后,將營養液替換為缺氮營養液[17]進行缺氮處理,分別于0、6、12、24和48 h取根系。缺氮處理72 h后,用5 mmol·L-1硝酸鹽(KNO3)進行復氮處理,于0、0.5、1、2和4 h取植株根系,液氮速凍后,-80 ℃保存,用于RNA提取及RT-qPCR試驗。
1.2 棉花NLP轉錄因子家族成員的鑒定
從Tair網站(http://www.arabidopsis.org/)下載擬南芥()9個NLP成員蛋白序列,亞洲棉基因組數據來源于CottonMD網站(http:// yanglab.hzau.edu.cn/CottonMD)[40],海島棉數據庫來源于MagenDB網站(http://magen.whu.edu.cn)[41],陸地棉下載于CottonFGD(https://cottonfgd.org/),雷蒙德氏棉數據下載于Phytozome(https://phytozome- next.jgi.doe.gov/)數據庫,以擬南芥NLP蛋白序列為查詢序列,在4種棉花全基因組蛋白數據庫中進行本地blastp搜索,e值小于1×e-15;同時,從Pfam數據庫[42](http://pfam.xfam.org/)下載保守結構域RWP-RK(PF02042)及PB1(PF00564)的HMM文件,基于隱馬爾可夫模型策略,進行HMMsearch搜索,e值小于1×e-15。2種方法得到的NLP蛋白整合后刪除重復及冗余轉錄本,進一步通過EMBL的SMART(http://smart.embl-heidelberg.de/)及NCBI的Batch CD-search(https://www.ncbi.nlm.nih.gov/Structure/ bwrpsb/bwrpsb.cgi)確認結構域,獲得4種棉花NLP轉錄因子家族成員。
1.3 棉花NLP蛋白理化特征及亞細胞定位預測
使用EXPASY網站中的在線程序ProtParam(http://web.expasy.org/protparam/)計算棉花NLP蛋白氨基酸長度、分子量大小、等電點、總平均親水性(grand average of hydropathicity,GRAVY)等信息。使用網站WoLF PSORT[43](https://www.genscript.com/ wolf-psort.html)進行亞細胞定位預測,生物類型選擇植物。
1.4 棉花NLP的系統進化分析
從Tair數據庫下載擬南芥()NLP成員蛋白序列,從Phytozome數據庫下載甘藍型油菜()、水稻()、玉米()及二穗短柄草()NLP成員蛋白序列,用于構建系統發生樹。首先使用Clustalx軟件對9個物種NLP蛋白序列進行多序列比對,之后使用軟件MEGA7[44],選擇Neighbor-joining方法進行建樹,檢驗方法選擇bootstrap method,重復1 000次,置換模型選擇Jones-Taylor-Thornton (JTT) Model。
1.5 棉花NLP染色體定位分析
根據棉花NLP基因ID在陸地棉、海島棉、亞洲棉和雷蒙德氏棉基因組的注釋,提取NLP家族成員位置信息及所在染色體的全長信息,利用TBtools[45](https://github.com/CJ-Chen/TBtools)進行染色體定位分析。
1.6 棉花NLP保守基序,基因結構分析及蛋白質結構分析
調取陸地棉、海島棉、亞洲棉和雷蒙德氏棉的NLP蛋白序列,提交至在線網站MEME(http://meme- suite.org/tools/meme)進行保守基序分析[46]。調取棉花NLP家族成員的基因組注釋信息,在基因結構可視化網站GSDS2.0[47](http://gsds.cbi.pku.edu.cn/)中進行棉花NLP家族成員基因結構特征分析。利用SOPMA網站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma. Html)進行NLP蛋白質二級結構預測。
1.7 棉花NLP共線性分析
使用MCScanX進行棉花NLP家族復制基因分析。使用Dual Systeny Plotter程序進行共線性分析(https://github.com/CJ-Chen/TBtools)[45],e值設為1.0×10-5。使用KaKs_Calculator計算每對NLP復制基因的非同義替換率(Ka)和同義替換率(Ks)[48]。
1.8 基因的表達分析
從CottonFGD網站調取已拼接完成的陸地棉不同組織表達轉錄組數據及非生物脅迫表達轉錄組數據。以Log2FPKM對轉錄組數據進行均一化,利用TBtools軟件中的heatmap程序繪制基因表達模式熱圖。通過RT-qPCR進行缺氮及復氮處理過程的表達量分析,使用天根多糖多酚總RNA提取試劑盒提取RNA,使用Thermo Scientific RevertAid第一鏈cDNA合成試劑盒進行反轉錄。利用Primer Premier 5.0軟件設計定量特異性引物(電子附表1),利用ABI StepOnePlus實時熒光定量PCR儀,諾唯贊ChamQ SYBR qPCR Master Mix,采用兩步法進行定量PCR反應。程序設置為95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40個循環。陸地棉為內參基因,每個反應3次重復,根據2-Ct法分析RT-qPCR數據。
1.9 棉花NLP家族蛋白相互作用網絡預測及互作蛋白表達相關性分析
通過蛋白互作在線網站STRING(https://string. db.org)預測棉花NLP家族成員相關的互作關系,選擇模式物種擬南芥作為同源蛋白物種。以預測得到的互作蛋白的序列調取陸地棉中同源蛋白,從cottonFGD網站調取其在不同組織中表達量的轉錄組數據,進行表達特征相關性分析。
2 結果
2.1 棉花NLP轉錄因子家族成員鑒定及基本信息
通過鑒定和分析4種棉花NLP基因家族,在陸地棉、海島棉、亞洲棉和雷蒙德氏棉中共鑒定出65個NLP蛋白,分別是22個GHNLP蛋白、21個GbNLP蛋白、11個GaNLP蛋白和11個GrNLP蛋白(表1)。對棉花NLP家族成員進行理化性質分析,發現該家族蛋白長度為693—996個氨基酸,相對分子質量為76.92—110.02 kDa,理論等電點為5.13—7.77,平均等電點值為5.92。亞細胞定位預測顯示,除GrNLP8-1位于葉綠體及細胞核,其余成員均位于細胞核。總平均親水性(GRAVY)為-0.521—-0.330,即棉花NLP家族成員均為低親水性蛋白。棉花NLP蛋白均各包含1個RWP-RK(PF02042)和1個PB1(PF00564)結構域(表1)。
2.2 棉花NLP蛋白系統發育樹,保守基序及基因結構分析
為了分析棉花NLP蛋白的進化關系,將4種棉花NLP氨基酸序列與其他5種植物(包括2種雙子葉植物(擬南芥和甘藍型油菜)和3種單子葉植物(水稻、玉米和二穗短柄草))的NLP氨基酸序列構建鄰接進化樹(圖1)。可以看出棉花NLP家族蛋白明顯被分為3組。同時,根據進化樹分支及擬南芥NLP命名情況,對棉花NLP蛋白進行重新命名。在棉花NLP家族中,GaNLP1-1/2/3、GaNLP4-1/2、GrNLP1-1/2/3、GrNLP4-1/2、GbNLP1A/D-1/2/3、GbNLP4A/D-1/2、GHNLP1A/D-1/2/3和GHNLP4A/D-1/2為第I組;GaNLP7-1/2/3、GrNLP7-1/2/3、GHNLP7A/D-1/2/3、GbNLP7A/D-1/3和GbNLP7D-2蛋白屬于第Ⅱ組;第Ⅲ組包含GaNLP8-1/2/3、GbNLP8A/D-1/2/3、GrNLP8-1/2/3和GHNLP8A/D-1/2/3。每個分支中均存在雙子葉植物和單子葉植物,表明NLP家族的基因擴增發生在單子葉植物和雙子葉植物分化之前。還發現,NLP蛋白在4種棉花之間的進化關系更緊密,而單子葉植物水稻、玉米和二穗短柄草NLP蛋白和4種棉花NLP蛋白的親緣關系較遠。

表1 棉花NLP基因家族成員信息
a、b:保守結構域RWP-RK(PF02042)和保守結構域PB1(PF00564)的個數
a,b: the numbers of conserved RWP-RK domain (PF02042) and PB1 domain (PF00564)

GH:陸地棉;Gb:海島棉;Ga:亞洲棉;Gr:雷蒙德氏棉;At:擬南芥;Os:水稻;Zm:玉米;Bna:甘藍型油菜;Bd:二穗短柄草
通過對4種棉花NLP蛋白序列構建系統發育樹,將棉花NLP家族成員分為3組(圖2-A)。經MEME分析,在4種棉花NLP蛋白中識別10種保守基序(圖2-B),其中,Motif1組成RWP-RK保守結構域,由大約50個氨基酸組成。Motif4和Motif8組成PB1保守結構域(圖2-D)[18],由大約80個氨基酸組成。此外,Motif7、Motif3和Motif9組成GAF-like保守結構域[18]。GrNLP8-1、GbNLP7A/D-3缺少Motif7、Motif3和Motif9,GHNLP7A-2缺少Motif7,其余NLP序列中均包含這10種保守基序。為了分析4種棉花NLP基因序列的結構特征,利用GSDS網站對NLP家族基因的外顯子/內含子結構進行分析,結果顯示,同一組內基因具有相似的基因結構,外顯子長度及分布相近(圖2-C)。第I組中,除和包含5個外顯子外,多數基因包含4個外顯子。第Ⅱ、Ⅲ組多數基因包含5個外顯子。第Ⅱ組中,包含3個外顯子,、和包含6個外顯子。第Ⅲ組中,包含6個外顯子。
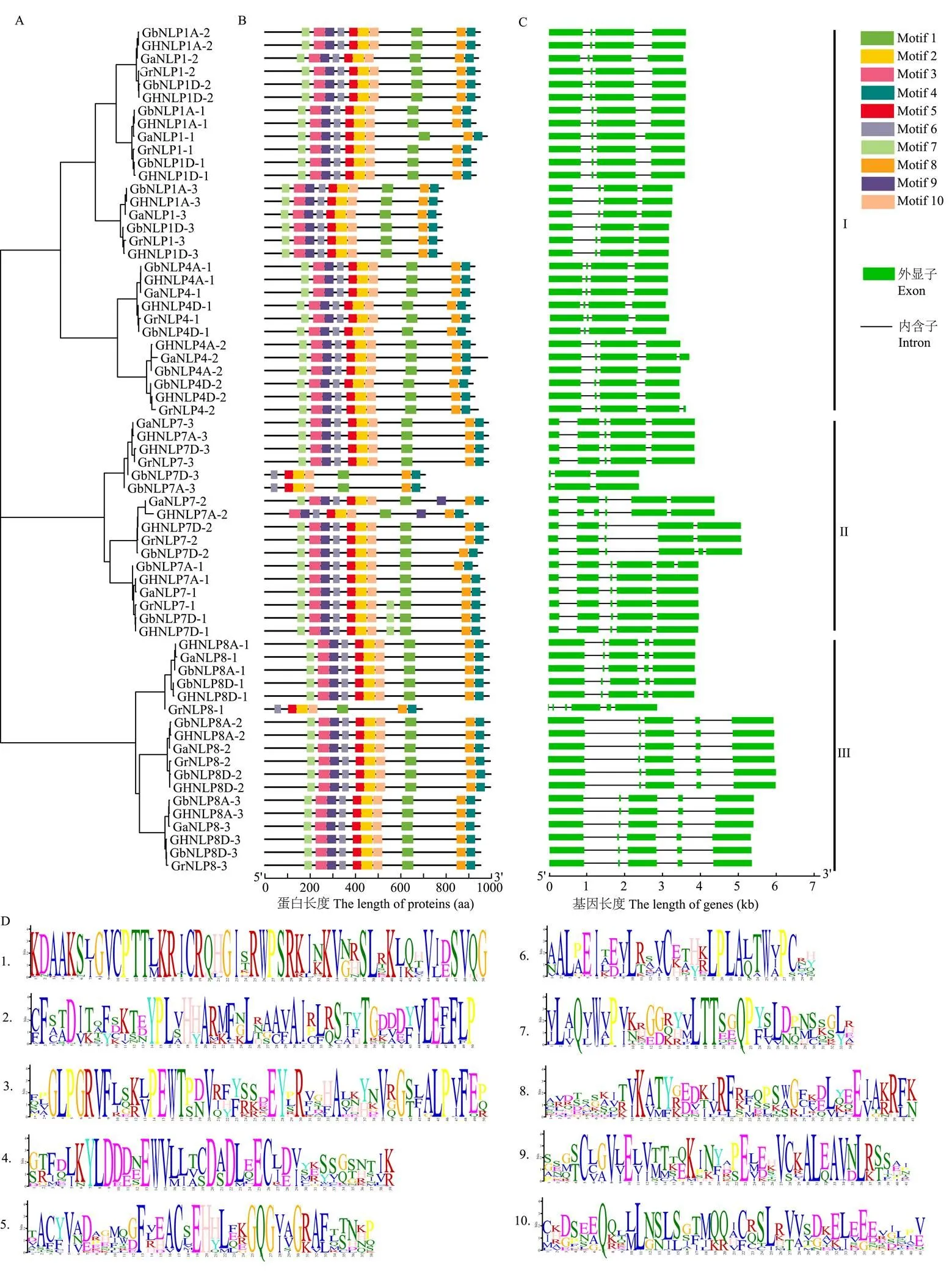
圖2 4種棉花NLP蛋白系統進化樹(A)、蛋白保守基序(B)、基因結構(C)的分析及保守基序的序列(D)
2.3 棉花NLP蛋白二級結構預測
預測棉花NLP蛋白中的二級結構(表2),65個棉花NLP蛋白質二級結構主要包含無規則卷曲和α-螺旋,其中,無規卷曲所占比例最大,此外還包含延長鏈和β-轉角,β-轉角在所有NLP成員中均占最小比例,而且在這些棉花NLP成員蛋白質中各類二級結構的占比相近。
2.4 棉花NLP染色體的定位分析
從基因組注釋文件中提取4種棉花NLP基因家族所在染色體位置的信息,分析NLP基因家族成員在染色體上的分布情況(圖3)。在亞洲棉中,11個GaNLP主要分布在9條染色體上,分別是Chr.2、Chr.3、Chr.5、Chr.6、Chr.7、Chr.9、Chr.10、Chr.11和Chr.13,其中,Chr.5染色體含有2個GaNLP基因(和),Chr.13染色體含有2個GaNLP基因(和),Chr.2、Chr.3、Chr.6、Chr.7、Chr.9、Chr.10和Chr.11染色體分別含有1個GaNLP基因(分別為、、、、、和)。

表2 棉花NLP蛋白質二級結構

續表2 Continued table 2

圖3 NLP家族成員在4種棉花中的染色體定位分析
雷蒙德氏棉NLP成員分布在8條染色體上,分別為Chr.2、Chr.3、Chr.4、Chr.5、Chr.6、Chr.8、Chr.9和Chr.11,其中,Chr.5染色體含有3個GrNLP基因(、和),Chr.2染色體含有2個GrNLP基因(和),Chr.3、Chr.4、Chr.6、Chr.8、Chr.9和Chr.11染色體各含有1個GrNLP基因(分別為、、、、和)。
在陸地棉中,共含有22個GHNLP基因,分布在16條染色體上,在A亞基因組的8條染色體上分布著11個GHNLP基因,A02染色體上含有、和,A01染色體上含有2個成員(和),A03、A05、A08、A09、A10和A12染色體上分別含有1個NLP成員(分別為、、、、和)。在D亞基因組的8條染色體上分布著11個GHNLP成員。其中,D01染色體上含有2個成員(分別為和),D02染色體上含有3個成員(、和),D03、D05、D08、D09、D10、D12染色體上分別含有1個GHNLP成員,分別為、、、、和。
在海島棉中,21個GbNLP成員分布在15條染色體上。10個GbNLP成員分布在7條A亞基因組染色體上,其中,3個成員分布在A02染色體上(、和),A01染色體上含有2個GbNLP成員(和),A03、A05、A09、A10和A12染色體上分別有1個GbNLP成員,分別為、、、和。11個GbNLP成員分布在8條D亞基因組染色體上,其中,3個成員分布在D02染色體上(、和),D01染色體上含有2個成員(和),D03、D05、D08、D09、D10和D12染色體分別包含1個GbNLP成員,分別為、、、、和。
2.5 棉花NLP家族基因的復制及共線性分析
串聯重復和片段復制是基因家族擴張的主要驅動力,促進基因家族的形成與基因組的進化。為了探究棉花NLP基因擴張可能的驅動力,分析4種棉花中NLP成員的復制事件,其中,在亞洲棉的5個GaNLP成員中發現3對片段復制事件,在雷蒙德氏棉的7個GrNLP成員中發現6對片段復制事件,在海島棉的13個GbNLP成員中發現16對片段復制事件,在陸地棉的22個GHNLP成員中發現51對片段復制事件,表明片段復制可能是NLP基因在棉花中擴張的主要驅動力。進一步分析棉花NLP復制基因對的Ka、Ks和Ka/Ks值(表3)。結果表明,4種棉花的NLP復制基因對的Ka/Ks值均小于1(0.118—0.530),推斷4種棉花NLP基因在進化過程中受到了純化選擇,表明棉花NLP功能較為保守。
為了探究四倍體與二倍體棉花NLP成員間的進化關系,對四倍體與二倍體棉花間的共線性進行分析,結果表明,22個陸地棉GHNLP基因與11個亞洲棉GaNLP基因存在共線關系,與11個雷蒙德氏棉GrNLP基因存在共線關系(圖4-A)。海島棉21個GbNLP基因與11個亞洲棉GaNLP基因存在共線關系,與11個雷蒙德氏棉GrNLP基因存在共線關系(圖4-B)。

A:陸地棉、亞洲棉和雷蒙德氏棉NLP基因的共線性分析;B:海島棉、亞洲棉和雷蒙德氏棉NLP基因的共線性分析

表3 棉花NLP復制基因對的非同義替換率(Ka)與同義替換率(Ks)比值
2.6 棉花NLP基因啟動子區順式作用元件分析
通過對棉花NLP家族基因啟動子區順式作用元件進行分析(圖5),鑒定到大量和激素相關及脅迫響應相關的順式作用元件,其中,激素響應元件數量較多的為響應乙烯的ERE,響應生長素的TGA- element和AuxRR-core,此外,還有響應脫落酸的AAGAA-motif和ABRE,響應赤霉素的GARE-motif、P-box和TATC-box,響應水楊酸的TCA-element等元件,響應茉莉酸甲酯的CGTCA-motif和TGACG- motif。與脅迫相應相關的元件中數量較多的為MYB、MYC及厭氧響應元件ARE,損傷誘導元件WUN- motif,此外,還有as-1、STRE、AP-1、DRE core、MYB、MYC、TC-rich repeats和box S,干旱響應元件MBS和CCAAT-box,低溫響應元件LTR等。另外,棉花NLP基因啟動子區還有與氮素響應相關的GCN4元件[49]。
2.7 棉花NLP基因家族不同組織表達模式及響應非生物脅迫表達模式分析
為了探究陸地棉GHNLP成員在棉花生長發育中潛在的作用,對GHNLP家族成員的表達模式進行了分析(圖6),陸地棉NLP成員的組織表達譜顯示,在根、莖、葉、花瓣、花藥、雌蕊、副萼、萼片和花托各組織中表達量都很高,、在各組織中也有較高表達量,其中,在根中表達最高。同時,和在纖維起始時胚珠中表達量較高,隨后在胚珠中表達量降低,而在20和25 d時在纖維中表達量升高。在20 d纖維中表達較高,和在纖維起始時胚珠中表達量較高。
為了研究棉花NLP家族基因在非生物脅迫中的潛在作用,對陸地棉GHNLP基因在低溫、高溫、鹽、干旱脅迫下的表達模式進行了分析(圖7)。結果顯示,、和在高溫處理1 h后表達升高,在高溫處理3 h后表達升高,在高溫處理1、12和24 h時表達升高。在低溫處理后表達升高,低溫處理3 h,表達升高,在低溫處理6、12和24 h時表達量升高,低溫處理24 h后,、和表達量升高。NaCl處理1 h后,和表達量升高,在NaCl處理3 h維持較高表達量,隨后逐漸降低,NaCl處理24 h后,、和表達量升高。干旱處理3 h后,和表達量升高,隨后逐漸下降。在干旱處理6 h后表達上升。

每一列代表一種順式作用元件,每行代表一個棉花NLP家族基因,方格中數字代表順式作用元件數量,右上角圖例代表順式作用元件數量范圍,紅色越深代表數量越多,藍色越深代表數量越少

A:GHNLP基因在不同組織中的表達水平熱圖;B:GHNLP基因在胚珠以及纖維發育不同時期的表達水平熱圖

圖7 陸地棉GHNLP基因在非生物脅迫下的表達分析
2.8 棉花NLP蛋白相互作用網絡及互作蛋白表達相關性分析
為進一步了解陸地棉中NLP轉錄因子潛在的功能,在STRING網站中,利用陸地棉NLP蛋白在模式物種擬南芥中的同源序列,構建陸地棉NLP蛋白相互作用網絡(圖8-A),其中,陸地棉中GHNLP1A/D-1/2/3在擬南芥中同源性最高蛋白均對應AT4G35270,GHNLP4A/D-1/2均對應AT1G20640,GHNLP7A/D-1/ 2/3對應NLP7,GHNLP8A/D-1/2/3對應AT2G43500。網絡圖中可看出,NLP7蛋白可與硝酸鹽轉運蛋白NRT1.1、NRT2.1,胞質硝酸還原酶NIA1及轉錄因子HRS1、LBD37、AGL44等相互作用,可以看出,NLP蛋白和氮素轉運、同化等蛋白相互作用,且NLP7位于核心位置。調取陸地棉中同源的NRT1.1、NRT2.1、NIA1、NIR1及HRS1,LBD37、AGL44蛋白對應基因在不同組織轉錄組的表達量,進行表達特征相關性分析(圖8-B),結果表明,陸地棉中與氮素響應相關的互作蛋白對應基因的表達特征均與、和具有很高的相關性,且這些互作蛋白對應基因之間表達也具有很高的相關性。
2.9 氮饑餓及復氮過程中GHNLPs的表達模式
為了研究氮素缺乏條件下棉花的響應情況,對陸地棉幼苗進行氮饑餓和復氮處理后進行RT-qPCR分析,結果發現,在氮饑餓處理過程中,的表達表現出不同程度的變化,整體而言,在氮饑餓處理的幾個時間點,幾乎所有的表達量較0 h均有不同程度的提高,呈現出不同的變化趨勢。表明對氮饑餓的響應隨時間變化,各個成員之間也存在一定的差異(圖9)。、、和表達量在處理48 h時最高,、、和表達量在氮饑餓處理24 h時最高。
對氮饑餓72 h后的棉花幼苗進行復氮處理,復氮過程中,的表達量在短時間內均顯著上調,表明復氮促進了的表達,對氮的響應迅速,復氮4 h后表達量逐漸下降(圖10)。、、、、、、、和在復氮0.5 h時即具有迅速響應,表達量達到最高。復氮1 h后表達量最高,、、和復氮2 h后表達量最高。
3 討論
3.1 棉花NLP基因家族的特征
NLP轉錄因子在氮素響應過程中起著重要的作用[18, 20],NLP廣泛存在于豆科植物以及非豆科植物中,受硝酸鹽信號調節,該家族蛋白能夠與具有氮響應順式作用元件(NRE)的啟動子結合激活下游相關基因表達[10, 18, 20]。除了響應硝酸鹽信號,也有研究表明NLP轉錄因子可在調節干旱脅迫抗性中發揮一定作用[24]。但棉花NLP基因功能和家族分析并未見報道。本研究以4種棉花為研究對象,系統分析了亞洲棉、雷蒙德氏棉、陸地棉和海島棉NLP家族的序列特征和進化關系以及陸地棉GHNLP基因的組織表達情況及非生物脅迫處理后表達水平變化情況。在這4種棉花中分別識別到了11、11、22和21個NLP家族成員。在不同物種中NLP蛋白家族成員的數量差異較大,在擬南芥中含有9個NLP[14],水稻中含有6個[14],玉米中[12]鑒定了9個NLP,在枳基因組數據中篩選到4個NLP[10],二穗短柄草中鑒定了7個NLP[15],甘藍型油菜基因組包含31個NLP[16],毛竹基因組中得到10個NLP基因[50],毛果楊中共鑒定出14個NLP基因家族成員[9],而四倍體棉花和甘藍型油菜中NLP家族成員較多可能是由于其在進化過程中經歷的基因組加倍事件[51-52]。海島棉中鑒定到21個NLP基因,推測海島棉在二倍體雜交形成四倍體的進化過程中可能存在基因丟失[53]。棉花NLP蛋白均各包含1個RWP-RK和1個PB1結構域,大部分棉花NLP蛋白在N端還包含1個GAF-like結構域。RWP-RK結構域包含1個螺旋-轉角-螺旋基序和1個兩親性亮氨酸拉鏈,可能參與DNA結合[13-14],PB1結構域包含2個α-螺旋和1個混合的五鏈β-折疊,可能在其蛋白結合能力中發揮關鍵作用[54]。這3個結構域(GAF、RWP-RK和PB1)使NLP在非固氮植物氮響應和適應氮缺乏中發揮重要作用[12]。亞細胞定位預測顯示65個棉花NLP有64個定位在細胞核中,這與其轉錄因子的特性相符,而只有GrNLP8-1定位于葉綠體及細胞核,這可能是由于NLP家族的核穿梭現象[27],擬南芥、水稻、毛竹的NLP家族中也有類似現象[33, 50]。總平均親水性(GRAVY)值表明4種棉花NLP均為低親水性蛋白(表1)。一些物種中NLP家族蛋白具有較長的氨基酸和較低的等電點值[12,14,18],在棉花NLP家族蛋白中也得到類似的結果(表1),表明NLP轉錄因子在酸性條件下具有活性。在進化樹第I組除和包含5個外顯子,其他均包含4個外顯子,第Ⅱ組基因包含3—6個外顯子,第Ⅲ組基因包含5—6個外顯子,總之,較第I、Ⅱ組基因外顯子數目多,表明棉花NLP基因結構多樣性,該結果與甘藍型油菜中NLP基因相似[16]。在棉花NLP啟動子區識別到大量乙烯響應元件ERE(圖5),據文獻報道NLP蛋白中的GAF結構域存在于乙烯信號相關的蛋白質中[21-23],由此推測部分棉花NLP蛋白可能與乙烯信號相關,且與GAF結構域有關聯。此外在棉花NLP蛋白啟動子區識別到大量MYB元件,推測部分棉花NLP可能與MYB轉錄因子結合。

A:基于擬南芥同源蛋白的陸地棉GHNLP蛋白相互作用網絡;B:NLP互作網絡蛋白基因表達特征相關性分析。紅色字體為棉花NLP蛋白編號
A: PPI network of GHNLPs from upland cotton based on the homologous proteins in; B: Correlation analysis of the expression characteristics of proteins interacted with NLPs in the PPI network. The name of cotton NLP proteins are highlighted in red color
圖8 GHNLPs蛋白相互作用網絡及互作蛋白表達相關性分析
Fig. 8 PPI network of GHNLPs proteins and the expression correlation analysis of proteins interacted with NLPs
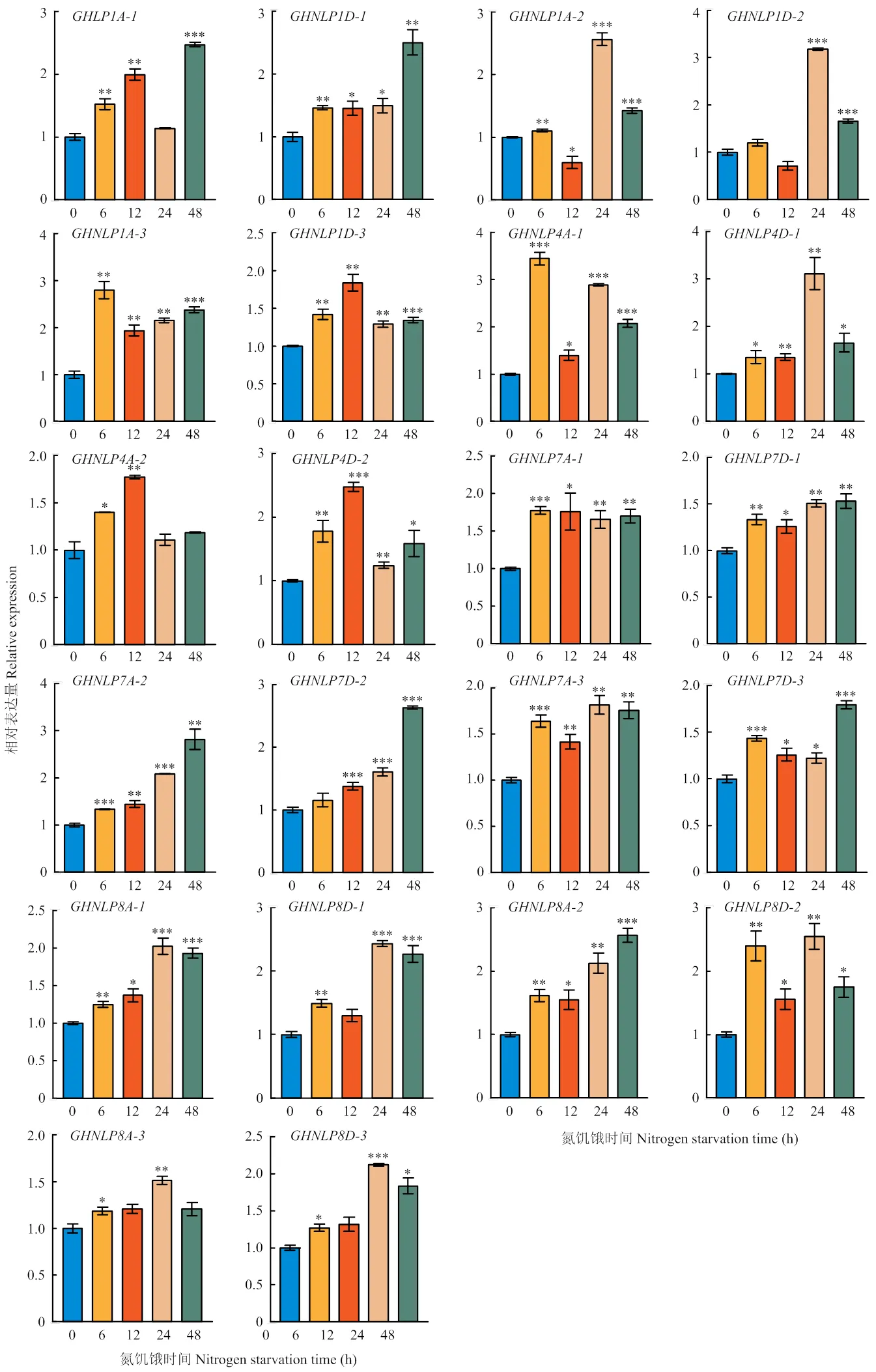
***:<0.001;**:<0.01;*:<0.05
圖9 氮饑餓過程中的表達分析
Fig. 9 Expression analysis ofduring nitrogen starvation

圖10 復氮過程中GHNLPs的表達分析
3.2 棉花NLPs的系統發育及復制關系
進化分析表明各物種NLP家族均可分為3組(圖1),包括擬南芥、甘藍型油菜、水稻、玉米、二穗短柄草及4種棉花。本研究中棉花和其他物種的分組一致,說明棉花中沒有特異進化的NLP成員。而4種棉花NLP成員的基因結構分析和MEME保守基序分析發現,位于相同亞組的NLP家族成員外顯子數量及分布相似(圖2-C),保守基序分布相似(圖2-B)。說明同一亞組的NLP成員可能具有相似的生物學功能。4種棉花NLP家族的復制基因分析發現片段復制是NLP基因在棉花中擴張的主要驅動力。進一步分析了4種棉花中存在片段復制的NLP復制基因對的非同義替換率(Ka)與同義替換率(Ks)及Ka/Ks值,結果表明,棉花中NLP復制基因對的Ka/Ks值均小于1(表3),由此推斷4種棉花中NLP基因在進化過程中受到了純化選擇。共線性分析表明,在22個陸地棉GHNLP基因和11個亞洲棉GaNLP基因間存在42對共線關系,在22個陸地棉GHNLP基因和11個雷蒙德氏棉GrNLP基因間存在46對共線關系,在21個海島棉GbNLP基因和11個亞洲棉GaNLP基因間存在42對共線關系,在21個海島棉GbNLP基因和11個雷蒙德氏棉GrNLP基因間存在44對共線關系。其中在陸地棉中有2個共線基因和,而在海島棉中只有1個共線基因。
3.3 棉花NLP基因表達譜及其對缺氮和復氮條件的響應
陸地棉GHNLP基因在根、莖、葉、花瓣、花藥、雌蕊、副萼、萼片和花托不同組織的特異性的表達,能夠揭示GHNLP基因在棉花生長發育過程中的潛在作用。在所有組織中均有較高表達,說明可能在棉花生長發育過程中發揮重要作用。在根中的表達量最高,擬南芥中是硝酸鹽信號通路的關鍵基因[31],推測棉花中也可能在棉花根中響應硝酸鹽過程中發揮重要作用。在花瓣、花藥、雌蕊、副萼、萼片和花托中具有較高表達,即在開花期間上調,表明可能調節氮轉運和同化以支持開花。陸地棉NLP蛋白相互作用網絡圖中,NLP7蛋白可與硝酸鹽轉運蛋白NRT1.1、NRT2.1,胞質硝酸還原酶NIA1等氮素轉運、同化相關蛋白相互作用,表明棉花中與NLP7同源的GHNLP7A/D-1/3也可能參與硝酸鹽響應過程。
此外,棉纖維發育可以分為起始、伸長、次級細胞壁加厚和成熟階段4個相互重疊的階段,開花后0 d(0 DPA)為纖維起始階段,0—26 DPA纖維長度增長并逐步達到最大值,該時期與纖維的長度緊密相關[55]。次級細胞壁加厚階段合成大量纖維素,此階段主要集中在15—40 DPA,對纖維強度至關重要[56]。進一步分析了陸地棉GHNLP基因在棉纖維發育過程中的潛在作用,在纖維起始階段具有較高表達,表明其可能在纖維起始過程中發揮作用。在棉纖維發育過程中的細胞次級細胞壁加厚期表達量最高。
NLP轉錄因子還參與逆境響應[27],研究表明NLP轉錄因子還在調節干旱脅迫抗性中起一定作用[24],通過分析陸地棉GHNLP基因在鹽、干旱、低溫、高溫脅迫下的表達模式(圖7),探究陸地棉GHNLP家族成員在非生物脅迫中可能的作用。結果顯示,、響應低溫和高溫脅迫,同時響應高溫、低溫和干旱脅迫,對低溫、高溫和鹽脅迫均有響應,對干旱和鹽脅迫均有響應,響應低溫和鹽脅迫,和響應鹽脅迫,對高溫脅迫響應。在干旱脅迫時表達量升高,6 h時表達量最高,之后逐漸下降,與蘋果、枳等NLP在干旱脅迫下表達相似[10, 57]。這些基因可能在棉花對非生物脅迫的調節過程中具有一定作用。氮饑餓過程中,幾乎均不同程度上調表達,表明在陸地棉響應缺氮的過程中發揮重要作用,且不同成員的表達隨著處理時間變化具有不同表達趨勢。這與蘋果、毛竹等在缺氮處理時表達類似[10, 50]。在氮饑餓后復氮處理過程中,均能短時間內作出快速反應,所有的表達均上調,大部分成員在0.5 h內顯著上調,說明硝酸鹽誘導的表達。該結果與番茄中表達相似[17]。結合互作網絡預測,以及表達特征相關性分析的結果,與擬南芥同源性較高的基因中,和可能具有與類似的調控關系。本研究結果為進一步研究GHNLP基因家族在硝酸鹽吸收同化及抵御非生物脅迫方面提供了理論基礎。
4 結論
對亞洲棉、雷蒙德氏棉、海島棉、陸地棉4種棉花NLP轉錄因子進行全基因組分析,分別識別到11、11、21和22個NLP轉錄因子成員,均包含RWP-RK和PB1保守結構域,進化分析可分為3組。啟動子區識別到大量激素和脅迫響應的順式作用元件,數量最多的為乙烯響應元件ERE和MYB,與AtNLP7同源性較高的分支中,在根中及纖維起始表達量高,同時,響應鹽脅迫,響應高溫、低溫和鹽脅迫,響應高溫、低溫和干旱脅迫。對缺氮及復氮過程有響應。
[1] CHEN Z J, SCHEFFLER B E, DENNIS E, TRIPLETT B A, ZHANG T Z, GUO W Z, CHEN X Y, STELLY D M, RABINOWICZ P D, TOWN C D, ARIOLI T, BRUBAKER C, CANTRELL R G, LACAPE J M, ULLOA M, PENG C E, GINGLE A R, HAIGLER C H, PERCY R, SAHA S, WILKINS T, WRIGHT R J, VAN DEYNZE A, ZHU Y X, YU S X, ABDURAKHMONOV I, KATAGERI I, KUMAR P A, RAHMAN M U, ZAFAR Y, YU J Z, KOHEL R J, WENDEL J F, PATERSON A H. Toward sequencing cotton () genomes. Plant Physiology, 2007, 145(4): 1303-1310.
[2] YANG Z R, QANMBER G, WANG Z, YANG Z E, LI F G.genomics: trends, scope, and utilization for cotton improvement. Trends in Plant Science, 2020, 25(5): 488-500.
[3] WANG R, LIU L, KONG Z S, LI S D, LU L L, KABIR N, CHEN G Q, ZHANG J X, QANMBER G, LIU Z. Identification ofgene family revealed thatis involved in regulating salinity tolerance in cotton (L.). Plant Physiology and Biochemistry, 2021, 166: 328-340.
[4] XIE S X, CAO S Y, LIU Q, XIONG X Y, LU X P. Effect of water deficit stress on isotope15N uptake and nitrogen metabolism of Newhall orange and Yamasitaka mandarin seedling. Journal of Life Sciences, 2013, 7(11): 1170-1178.
[5] CRAWFORD N M. Nitrate: Nutrient and signal for plant growth. The Plant Cell, 1995, 7(7): 859-868.
[6] HACHIYA T, MIZOKAMI Y, MIYATA K, THOLEN D, WATANABE C K, NOGUCHI K. Evidence for a nitrate-independent function of the nitrate sensor NRT1.1 in. Journal of Plant Research, 2011, 124(3): 425-430.
[7] Forde B G. Local and long-range signaling pathways regulating plant responses to nitrate. Annual Review of Plant Biology, 2002, 53: 203-224.
[8] Bi Y M, Wang R L, Zhu T, Rothstein S J. Global transcription profiling reveals differential responses to chronic nitrogen stress and putative nitrogen regulatory components in. BMC Genomics, 2007, 8: 281.
[9] 吳翔宇, 許志茹, 曲春浦, 李蔚, 孫琦, 劉關君. 毛果楊基因家族生物信息學分析與鑒定. 植物研究, 2014, 34(1): 37-43, 61.
WU X Y, XU Z R, QU C P, LI W, SUN Q, LIU G J. Genome-wide identification and characterization ofgene family in. Bulletin of Botanical Research, 2014, 34(1): 37-43, 61. (in Chinese)
[10] 曹雄軍, 盧曉鵬, 熊江, 李靜, 吳倩, 周芳芳, 謝深喜. 枳NLP轉錄因子克隆及其在不同水分條件下的表達. 中國農業科學, 2016, 49(2): 381-390.
CAO X J, LU X P, XIONG J, LI J, WU Q, ZHOU F F, XIE S X. Cloning and expression of(L.) raf. NIN-like transcription factors under different water conditions. Scientia Agricultura Sinica, 2016, 49(2): 381-390. (in Chinese)
[11] LIU K H, LIU M H, LIN Z W, WANG Z F, CHEN B Q, LIU C, GUO A P, KONISHI M, YANAGISAWA S, WAGNER G, Sheen J. NIN-like protein 7 transcription factor is a plant nitrate sensor. Science, 2022, 377(6613): 1419-1425.
[12] GE M, LIU Y H, JIANG L, WANG Y C, LV Y D, ZHOU L, LIANG S Q, BAO H B, ZHAO H. Genome-wide analysis of maize NLP transcription factor family revealed the roles in nitrogen response.Plant Growth Regulation, 2018, 84(1): 95-105.
[13] SCHAUSER L, ROUSSIS A, STILLER J, STOUGAARD J. A plant regulator controlling development of symbiotic root nodules. Nature, 1999, 402(6758): 191-195.
[14] SCHAUSER L, WIELOCH W, STOUGAARD J. Evolution of NIN-like proteins in, rice, and. Journal of Molecular Evolution, 2005, 60(2): 229-237.
[15] KUMAR A, BATRA R, GAHLAUT V, GAUTAM T, KUMAR S, SHARMA M, TYAGI S, SINGH K P, BALYAN H S, PANDEY R, GUPTA P K. Genome-wide identification and characterization of gene family for RWP-RK transcription factors in wheat (L.). PLoS ONE, 2018, 13(12): e0208409.
[16] LIU M, CHANG W, FAN Y H, SUN W, QU C M, ZHANG K, LIU L Z, XU X F, TANG Z L, LI J N, LU K. Genome-wide identification and characterization of NODULE-INCEPTION-LIKE protein (NLP) family genes in. International Journal of Molecular Sciences, 2018, 19(8): 2270.
[17] LIU M Y, ZHI X N, WANG Y, WANG Y. Genome-wide survey and expression analysis of NIN?like Protein (NLP) genes reveals its potential roles in the response to nitrate signaling in tomato. BMC Plant Biology, 2021, 21: 347.
[18] CHARDIN C, GIRIN T, ROUDIER F, MEYER C, KRAPP A. The plant RWP-RK transcription factors: key regulators of nitrogen responses and of gametophyte development. Journal of Experimental Botany, 2014, 65(19): 5577-5587.
[19] KONISHI M, YANAGISAWA S. Identification of a nitrate-responsive-element in thepromoter defines the presence of multiple-regulatory elements for nitrogen response. The Plant Journal, 2010, 63(2): 269-282.
[20] Konishi M, Yanagisawa S.NIN-like transcription factors have a central role in nitrate signalling. Nature Communications, 2013, 4: 1617.
[21] SU Y S, LAGARIAS J C. Light-independent phytochrome signaling mediated by dominant GAF domain tyrosine mutants ofphytochromes in transgenic plants. The Plant Cell, 2007, 19(7): 2124-2139.
[22] GAO Z Y, WEN C K, BINDER B M, CHEN Y F, CHANG J H, CHIANG Y H, KERRIS R J, CHANG C R, SCHALLER G E. Heteromeric interactions among ethylene receptors mediate signaling in. Journal of Biological Chemistry, 2008, 283(35): 23801-23810.
[23] GREFEN C, ST?DELE K, R?ZICKA K, OBRDLIK P, HARTER K, HORáK J. Subcellular localization andinteractions of theethylene receptor family members. Molecular Plant, 2008, 1(2): 308-320.
[24] CASTAINGS L, CAMARGO A, POCHOLLE D, GAUDON V, TEXIER Y, BOUTET-MERCEY S, TACONNAT L, RENOU J P, DANIEL-VEDELE F, FERNANDEZ E, MEYER C, KRAPP A. The nodule inception-like protein 7 modulates nitrate sensing and metabolism in.The Plant Journal, 2009, 57(3): 426-435.
[25] KONISHI M, YANAGISAWA S. The regulatory region controlling the nitrate-responsive expression of a nitrate reductase gene,, in. Plant and Cell Physiology, 2011, 52(5): 824-836.
[26] JIAN W, ZHANG D W, ZHU F, WANG S X, ZHU T, PU X J, ZHENG T, FENG H, LIN H H. Nitrate reductase-dependent nitric oxide production is required for regulation alternative oxidase pathway involved in the resistance to Cucumber mosaic virus infection in. Plant Growth Regulation, 2015, 77(1): 99-107.
[27] MARCHIVE C, ROUDIER F, CASTAINGS L, BRéHAUT V, BLONDET E, COLOT V, MEYER C, KRAPP A. Nuclear retention of the transcription factor NLP7 orchestrates the early response to nitrate in plants. Nature Communications, 2013, 4:1713.
[28] YU L H, WU J, TANG H, YUAN Y, WANG S M, WANG Y P, ZHU Q S, LI S G, XIANG C B. Overexpression ofimproves plant growth under both nitrogen-limiting and-sufficient conditions by enhancing nitrogen and carbon assimilation. Scientific Reports, 2016, 6: 27795.
[29] YAN D W, EASWARAN V, CHAU V, OKAMOTO M, IERULLO M, KIMURA M, ENDO A, YANO R, PASHA A, GONG Y C, Bi Y M, PROVART N, GUTTMAN D, KRAPP A, ROTHSTEIN S J, NAMBARA E. NIN-like protein 8 is a master regulator of nitrate- promoted seed germination in. Nature Communications, 2016, 7: 13179.
[30] GUAN P Z, RIPOLL J J, WANG R H, VUONG L, BAILEY- STEINITZ L J, Ye D N, Crawford N M. Interacting TCP and NLP transcription factors control plant responses to nitrate availability. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(9): 2419-2424.
[31] LIU K H, NIU Y J, KONISHI M, WU Y, DU H, SUN CHUNG H, LI L, BOUDSOCQ M, MCCORMACK M, MAEKAWA S, ISHIDA T, ZHANG C, SHOKAT K, YANAGISAWA S, SHEEN J. Discovery of nitrate-CPK-NLP signalling in central nutrient-growth networks. Nature, 2017, 545(7654): 311-316.
[32] ALFATIH A, WU J, ZHANG Z S, XIA J Q, JAN S U, YU L H, XIANG C B. Rice NIN-LikeProtein 1 rapidly responds to nitrogen deficiency and improves yield and nitrogen use efficiency. Journal of Experimental Botany, 2020, 71(19): 6032-6042.
[33] WU J, ZHANG Z S, Xia J Q, ALFATIH A, SONG Y, HUANG Y J, WAN G Y, Sun L Q, TANG H, LIU Y, WANG S M, ZHU Q S, QIN P, WANG Y P, LI S G, MAO C Z, ZHANG G Q, CHU C C, YU L H, XIANG C B. Rice NIN-LIKE PROTEIN 4 plays a pivotal role in nitrogen use efficiency. Plant Biotechnology Journal, 2021, 19(3): 448-461.
[34] ENDRIZZI J E, TURCOTTE E L, KOHEL R J. Genetics, cytology, and evolution of. Advances in Genetics, 1985, 23: 271-375.
[35] PATERSON A H, WENDEL J F, GUNDLACH H, GUO H, JENKINS J, JIN D C, LLEWELLYN D, SHOWMAKER K C, SHU S Q, UDALL J, YOO M J, BYERS R, CHEN W, DORON-FAIGENBOIM A, DUKE M V, GONG L, GRIMWOOD J, GROVER C, GRUPP K, HU G J, Lee T H, LI J P, LIN L F, LIU T, MARLER B S, PAGE J T, ROBERTS A W, ROMANEL E, SANDERS W S, SZADKOWSKI E, TAN X, TANG H B, XU C M, WANG J P, WANG Z N, ZHANG D, ZHANG L, ASHRAFI H, BEDON F, BOWERS J E, BRUBAKER C L, CHEE P W, DAS S, GINGLE A R, HAIGLER C H, HARKER D, HOFFMANN L V, HOVAV R, JONES D C, LEMKE C, MANSOOR S, RAHMAN M U, RAINVILLE L N, RAMBANI A, REDDY U K, RONG J K, SARANGA Y, SCHEFFLER B E, SCHEFFLER J A, STELLY D M, TRIPLETT B A, VAN DEYNZE A V, VASLIN M F S, WAGHMARE V N, WALFORD S A, WRIGHT R J, ZAKI E A, ZHANG T Z, DENNIS E S, MAYER K F X, PETERSON D G, ROKHSAR D S, WANG X Y, SCHMUTZ J. Repeated polyploidization ofgenomes and the evolution of spinnable cotton fibres. Nature, 2012, 492(7429): 423-427.
[36] DU X M, HUANG? G, HE S P, YANG Z E, SUN G F, MA X F, LI N, ZHANG X Y, SUN J L, LIU M, JIA Y H, PAN Z E, GONG W F, LIU Z H, ZHU H Q, MA L, LIU F Y, YANG D G, WANG F, FAN W, GONG Q, PENG Z, WANG L R, WANG X Y, XU S J, SHANG H H, LU C R, ZHENG H K, HUANG S W, LIN T, ZHU Y X, LI ?F G. Resequencing of 243 diploid cotton accessions based on an updated a genome identifies the genetic basis of key agronomic traits. Nature Genetics, 2018, 50(6): 796-802.
[37] LI F G, FAN G Y, LU C R, XIAO G H, ZOU C S, KOHEL R J, MA Z Y, SHANG H H, Ma X F, Wu J Y, LIANG X M, HUANG G, PERCY R G, LIU K, YANG W H, CHEN W B, DU X M, SHI C C, YUAN Y L, YE W W, LIU X, ZHANG X Y, LIU W Q, WEI H L, Wei S J, HUANG G D, ZHANG X L, ZHU S J, ZHANG H, SUN F M, WANG X F, LIANG J, WANG J H, HE Q, HUANG L H, WANG J, CUI J J, SONG G L, WANG K B, XU X, YU J Z, ZHU Y X, YU S X. Genome sequence of cultivated upland cotton (TM-1) provides insights into genome evolution. Nature Biotechnology, 2015, 33(5): 524-530.
[38] WANG M J, TU L L, YUAN D J, ZHU D, SHEN C, LI J Y, LIU F Y, PEI L L, WANG P C, ZHAO G N, YE Z X, HUANG H, YAN F L, MA Y Z, ZHANG L, LIU M, YOU J Q, YANG Y C, LIU Z P, HUANG F, LI B Q, QIU P, ZHANG Q H, ZHU L F, Jin S X, YANG X Y, MIN L, LI G L, CHEN L L, ZHENG H K, LINDSEY K, LIN Z X?, UDALL J A,? ZHANG X L. Reference genome sequences of two cultivated allotetraploid cottons,and. Nature Genetics, 2019, 51(2): 224-229.
[39] HU Y, CHEN J D, FANG L, ZHANG Z Y, MA W, NIU Y C, JU L Z, DENG J Q, ZHAO T, LIAN J M, BARUCH K, FANG D, LIU X, RUAN Y L, RAHMAN M U, HAN J L, WANG K, WANG Q, WU H T, MEI G F, ZANG Y H, HAN Z G, XU C Y, SHEN W J, YANG D F, SI Z F, DAI F, ZOU? L F, HUANG F, BAI Y L, ZHANG Y G, BRODT A, HAMO H B, ZHU X F, ZHOU B L, GUAN X Y, ZHU S J, CHEN? X Y, ZHANG T Z.andgenomes provide insights into the origin and evolution of allotetraploid cotton. Nature Genetics, 2019, 51(4): 739-748.
[40] YANG Z Q, WANG J, HUANG Y M, WANG S B, Wei L L, LIU D X, WENG Y L, XIANG J H, ZHU Q, YANG Z E, NIE X H, YU Y, YANG Z R, YANG Q Y. CottonMD: a multi-omics database for cotton biological study. Nucleic Acids Research, 2022, gkac863: 1-11.
[41] WANG D H, FAN W L, GUO X L, WU K, ZHOU S Y, CHEN Z G, LI D Y, WANG K, ZHU Y X, ZHOU Y. MaGenDB: a functional genomics hub for Malvaceae plants. Nucleic Acids Research, 2020, 48(D1): D1076-D1084.
[42] FINN R D, BATEMAN A, CLEMENTS J, COGGILL P, EBERHARDT R Y, EDDY S R, HEGER A, HETHERINGTON K, HOLM L, MISTRY J, SONNHAMMER E L L, TATE J, PUNTA M. Pfam: The protein families database. Nucleic Acids Research, 2014, 42(D1): D222-D230.
[43] HORTON P, PARK K J, OBAYASHI T, FUJITA N, HARADA H, ADAMS-COLLIER C J, NAKAI K T. WoLF PSORT: Protein localization predictor. Nucleic Acids Research, 2007, 35(suppl_2): W585-W587.
[44] KUMAR S, STECHER G, TAMURA K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution, 2016, 33(7): 1870-1874.
[45] CHEN C J, CHEN H, ZHANG Y, THOMAS H R, FRANK M H, HE Y H, XIA R. TBtools: An integrative toolkit developed for interactive analyses of big biological data. Molecualr Plant, 2020, 13(8): 1194-1202.
[46] BAILEY T L, WILLIAMS N, MISLEH C, LI W W. MEME: Discovering and analyzing DNA and protein sequence motifs. Nucleic Acids Research, 2006, 34(suppl_2): W369-W373.
[47] HU B, JIN J P, GUO A Y, ZHANG H, LUO J C, GAO G. GSDS 2.0: An upgraded gene feature visualization server. Bioinformatics, 2014, 31(8): 1296-1297.
[48] WANG D P, ZHANG Y B, ZHANG Z, ZHU J, YU J. KaKs_ Calculator 2.0: a toolkit incorporating gamma-series methods and sliding window strategies.Genomics, Proteomics & Bioinformatics, 2010, 8(1): 77-80.
[49] MüLLER M, KNUDSEN S. The nitrogen response of a barley C-hordein promoter is controlled by positive and negative regulation of the GCN4 and endosperm box. The Plant Journal, 1993, 4(2): 343-355.
[50] 袁婷婷, 朱成磊, 李紫陽, 宋新章, 高志民. 毛竹NLP轉錄因子鑒定及其響應氮素的表達模式. 林業科學研究, 2021, 34(5): 39-48.
YUAN T T, ZHU C L, LI Z Y, SONG X Z, GAO Z M. Identification of NLP transcription factors ofand their expression patterns in response to nitrogen. Forest Research, 2021, 34(5): 39-48. (in Chinese)
[51] CHALHOUB B, DENOEUDF, LIU S Y, PARKIN I A P, TANG H B, WANG X Y, CHIQUET J, BELCRAM H, TONG C B, SAMANS B,. Early allopolyploid evolution in the post-Neolithicoilseed genome. Science, 2014, 345: 950-953.
[52] HUANG G, WU Z G, PERCY R G, BAI M Z, LI Y, FRELICHOWSKI J E, HU J, WANG K, YU J Z, ZHU Y X. Genome sequence ofand genome updates ofandprovide insights into cotton A-genome evolution.Nature Genetics, 2020, 52(5): 516-524.
[53] LYNCH M, CONERY J S. The evolutionary fate and consequences of duplicate genes. Science, 2000, 290(5494): 1151-1155.
[54] SUMIMOTO H, KAMAKURA S, Ito T. Structure and function of the PB1 domain, a protein interaction module conserved in animals, fungi, amoebas, and plants. Sciemce Stke, 2007, 2077(401): re6.
[55] ZHAO W Q, DONG H R, ZAHOORA R, ZHOU Z G, SNIDER J L, CHEN Y L, SIDDIQUE K H M, WANG Y H. Ameliorative effects of potassium on drought-induced decreases in fiber length of cotton (L.) are associated with osmolyte dynamics during fiber development. The Crop Journal, 2019, 7(5): 619-634.
[56] SONG Z Q, CHEN Y, ZHANG C Y, ZHANG J X, Huo X H, GAO Y, PAN A, DU Z H, ZHOU J, ZHAO Y X, LIU Z, WANG F R, ZHANG J. RNA-seq reveals hormone-regulated synthesis of non-cellulose polysaccharides associated with fiber strength in a single- chromosomal-fragment-substituted upland cotton line. The Crop Journal, 2020, 8(2): 273-286.
[57] 王尋, 陳西霞, 李宏亮, 張富軍, 趙先炎, 韓月彭, 王小非, 郝玉金. 蘋果NLP(Nin-Like Protein)轉錄因子基因家族全基因組鑒定及表達模式分析. 中國農業科學, 2019, 52(23): 4333-4349.
WANG X, CHEN X X, LI H L, ZHANG F J, ZHAO X Y, HAN Y P, WANG X F, HAO Y J. Genome-wide identification and expression pattern analysis of NLP (Nin-Like Protein) transcription factor gene family in apple. Scientia Agricultura Sinica, 2019, 52(23): 4333-4349. (in Chinese)
Genome-Wide Identification and Expression Analysis of NLP (Nin- Like Protein) Transcription Factor Gene Family in cotton
DING GuoHua, XIAO GuangHui, ZHU LiPing
College of Life Sciences, Shaanxi Normal University, Xi’an 710119
【Objective】To explore the structure and evolution characteristics of cotton NLP transcription factors in the whole genome, and further understand their expressions patterns, so as to lay a foundation for the further function research and utilization of NLP genes. 【Method】The NLP transcription factor family members in the whole genomes of four cotton species,(, Ga),(, Gr),(, Gb) and(, GH), were identified using two strategies, BLASTP and HMM search. Further bioinformatics analysis was carried out on the confirmed cotton NLP family members. The molecular weights, theoretical isoelectric points and other physical and chemical properties were predicted using online software Expasy; the MEGA 7 software was used to build the phylogenetic tree; protein conservative motifs were analyzed through MEME website; online software GSDS 2.0 was used to analyze gene structures; TBtools was used to view the chromosome localizations; McscanX was used to analyze the replication genes of cotton NLP family members; the PlantCARE website was used to predict the-acting elements in the promoters of cotton NLP family genes. The heat maps of cotton NLP genes expression levels of different tissues and under abiotic stresses were drawn through TBtools to analyze the tissue expression characteristics and abiotic stresses response characteristics. The expressions ofin cotton under nitrogen starvation and nitrogen resupply treatments were analyzed by RT-qPCR. 【Result】A total of 11, 11, 21 and 22 NLP members were screened from the four cotton protein databases of,,and, respectively. These NLP family genes encoded 693-996 amino acids. The relative molecular masses ranged from 76.92-110.02 kDa and the theoretical isoelectric points were 5.13-7.77. The subcellular localization prediction results showed that almost all the NLP members located in the nucleus. Promoter analysis found a large number of-acting elements related to phytohormone and stress response. Phylogenetic analysis showed cotton NLPs were divided into three groups, I, II and III. Gene replication analysis showed that fragment replication was the main force formembers expansion in cotton. All the Ka/Ks values were less than 1, indicating that evolution of NLP family in cotton mainly underwent purification selection. The results of expression analysis also confirmed thatresponded to nitrogen starvation and nitrogen resupply. 【Conclusion】From the whole genome of,,, and, 11, 11, 21 and 22 NLP transcription factor members were identified respectively. They had high conservatism and some degree of differences. The expression levels ofchanged significantly during nitrogen starvation and nitrogen resupply processes, which may play a role in the response of cotton to nitrate.
cotton; NLP transcription factor; nitrogen signal; bioinformatics
10.3864/j.issn.0578-1752.2023.19.003
2022-11-07;
2023-01-18
國家自然科學基金(32070549、32270578和32200444)、中國博士后科學基金(2022M712005)、陜西省自然科學基礎研究計劃(2022JQ-197)、安徽省自然科學基礎研究計劃(208085QC85)、中央高校基本科研業務費專項資金(GK202002005)、中央高校基本科研業務費(GK202304018,GK202304016,GK202304015)、棉花生物學國家重點實驗室開放課題(CB2022A01、CB2021A05和CB2021A21)
丁國華,E-mail:dingguohuasw@163.com。通信作者竺麗萍,E-mail:zhuliping0903@163.com。通信作者肖光輝,E-mail:guanghuix@snnu.edu.cn
(責任編輯 李莉)

