骨修復材料促成骨作用的分子機制
徐云容 ,唐梓聞 ,何 飛
(1)昆明醫科大學第一附屬醫院骨科,云南 昆明 650500;2)昆明醫科大學附屬曲靖醫院骨科,云南 曲靖 655000)
創傷、感染、手術、先天性畸形和腫瘤切除造成的骨缺損[1-2],會導致骨不愈合、延遲愈合、連接中斷或局部功能障礙[3]。而骨組織工程技術的發展,為骨缺損的修復與再生提供了諸多可能[4-6],使人們對模擬天然骨所需材料的種類、化學組成、空間結構和生物特性有了很好的了解[7-8]。并且研究所產生的多種具有良好機械性能與生物相容性的骨修復材料在骨形成、骨誘導、骨傳導、骨整合、組織再生中表現出了巨大潛能[9-10]。但骨形成是一個復雜、多階段的生理過程,包含多種信號通路和細胞因子網絡的相互交流[11],關于骨修復材料是如何促進成骨作用具體機制的發掘與研究仍然有待深入。對于骨修復材料的進一步發展與臨床應用,越來越需要詳細了解其促進成骨作用的具體機制[12-13]。本文針對現今研究較多的多種信號通路機制進行了一定的闡述,并進一步總結了骨修復材料促進成骨作用的相關分子機制,以期為骨修復材料促成骨作用分子機制的研究提供理論依據與新的思考。
1 成骨相關信號通路
1.1 RTK 信號通路
RTKs 是一類酶聯受體,其配體主要為各類生長因子,每一類RTK 及其配體對應的都是一個蛋白家族,如其配體對應的VEGF 包括VEGF-A、VEGF-B、PGF 和RTK 作為受體對應的包括HER1/2/3/4 的EGFR 蛋白家族等。RTK 與配體結合后形成RTK 二聚體發生自磷酸化,活化下游蛋白激活MAPK 信號通路、PI3K/AKT 信號通路從而參與轉錄調控,見圖1,并最后影響成骨過程,其中成纖維細胞生長因子(fibroblast growth factor,FGF)介導的信號通路就在成骨過程中發揮著重要作用[14]。
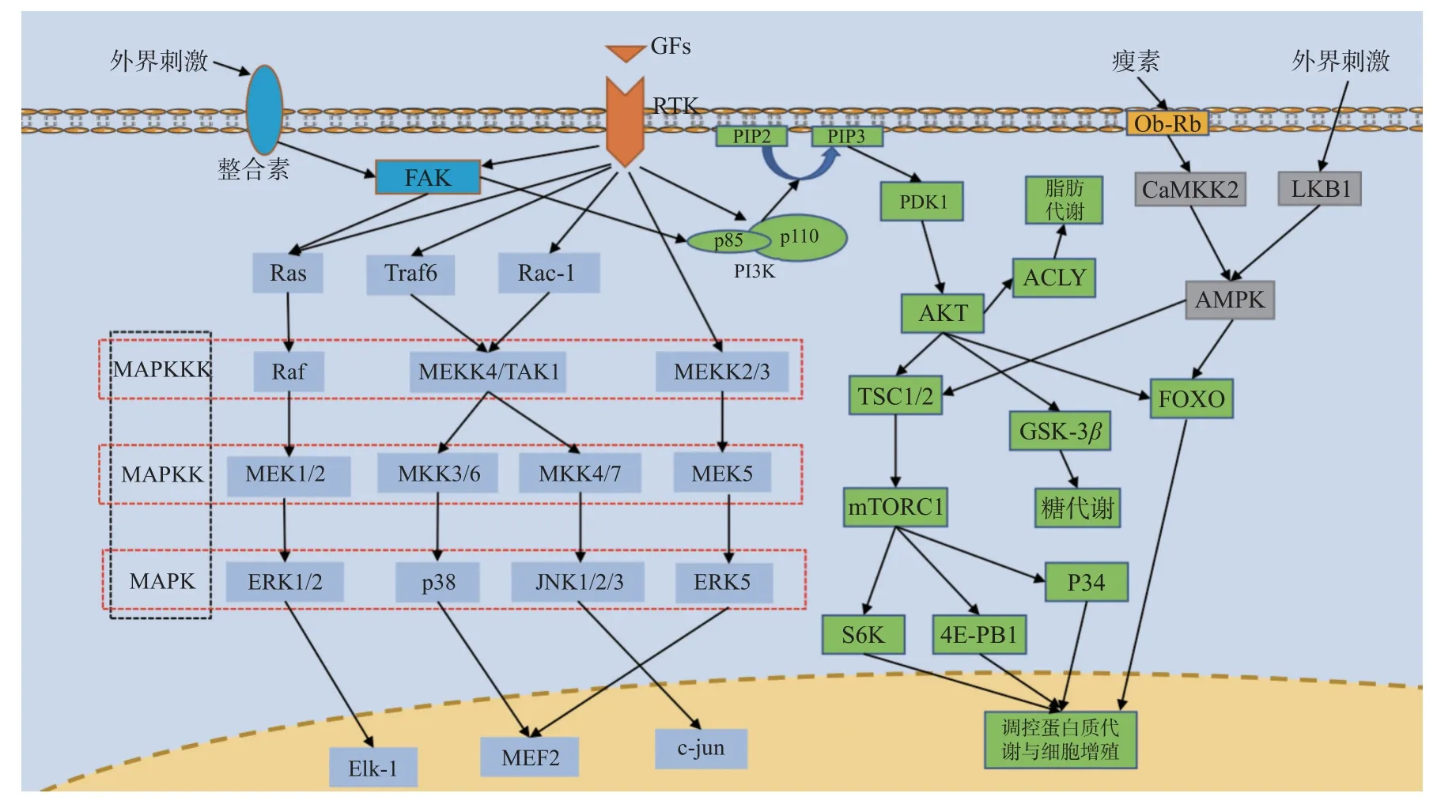
圖1 RTK 通路、MAPK 通路、PI3K/AKT 通路、AMPK 通路、整合素通路并行示意圖Fig.1 Parallel diagram of RTK pathway,MAPK pathway,PI3K/AKT pathway,AMPK pathway and integrin pathway
1.2 MAPK 信號通路
MAPK 信號通路的基本組成是一種包括MAPKKK、MAPKK、MAPK 的3 級激酶模式,MAPK 分為ERK、p38、JNK 和ERK5 4 個亞族,其所構成的ERK/MAPK、p38/MAPK、JNK/MAPK和ERK5/MAPK 信號通路調節著細胞的生長和分化、對環境的應激、炎癥反應等多種生理或病理過程,見圖1。MAPK 信號通路是成骨分化的重要機制,增加ERK1/2、p38 和JNK 的表達可以有效促進成骨分化基因的轉錄[15-18]。
1.3 PI3K/AKT 信號通路
PI3K 由一個催化亞基(主要為p110)和一個調節亞基(p85)組成,既具有絲氨酸/蘇氨酸(Ser/Thr)激酶活性,又具有磷脂酰肌醇激酶活性,可以將PIP2 轉化為PIP3 活化PDK1 從而激活參與細胞增殖與凋亡多種生理活動的AKT,使AKT對下游的TSC1/2、FOXO、GSK-3 產生抑制作用和激活內皮型一氧化氮合成酶(eNOS)和ATP 檸檬酸裂解酶(ATP citrate lyase,ACLY)進而調控轉錄,其在正向調控成骨細胞分化中可能起著主要的作用[19-21]。
1.4 AMPK 信號通路
AMPK 是一個由α 亞基、β 亞基和γ 亞基組成的異源三聚體,主要被其上游的LKB1 和CaMKK2 激活,見圖1,是生物能量代謝調節的關鍵分子[22],并且在骨再生中也發揮著一定作用[23-24]。
1.5 TGF-β 超家族信號通路
TGF-β 超家族成員包括TGF-β、BMP、AMH、Activin、Nodal 及GDF 等配體,主要涉及TGF-β 信號通路、BMP 信號通路、Activin 信號通路,見圖2,傳導過程中配體與II 型受體結合,II 型受體招募并磷酸化I 型受體,I 型受體再使受體調節的Smad(R-Smad)磷酸化以后與共同介導的Smad(CoSmad)結合形成蛋白復合體轉運至細胞核內調控轉錄,其對細胞的增殖、遷移、分化、凋亡起著廣泛的調節作用。而在骨形成過程中TGF-β 信號通路對維持骨代謝平衡起著重要作用,可以促進成骨分化、抑制破骨細胞形成[25],同時BMP 信號通路對成骨分化的啟動起著關鍵作用[26]。
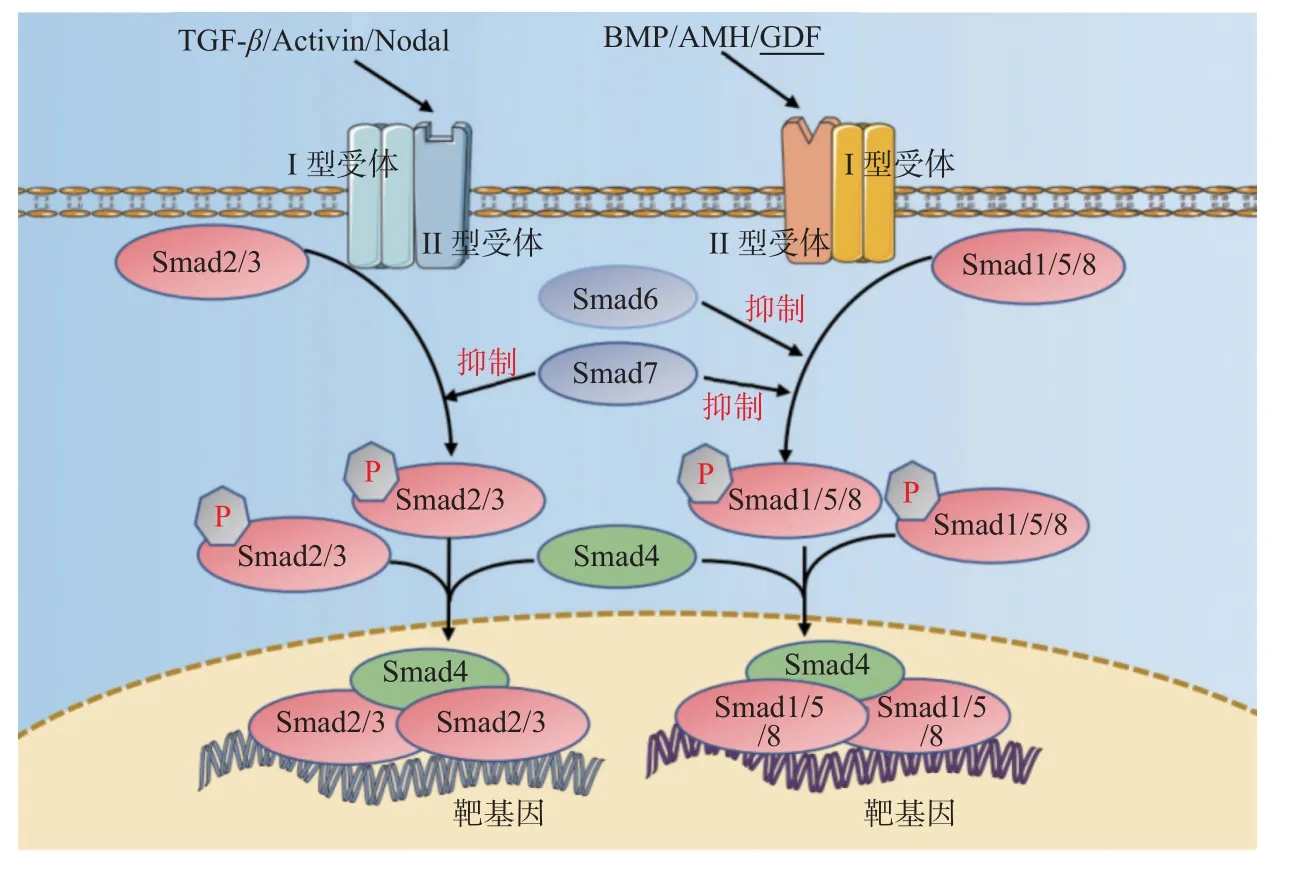
圖2 TGF-β 超家族信號通路示意圖Fig.2 Schematic diagram of TGF-β superfamily signaling pathway
1.6 Wnt 信號通路
Wnt 信號通路包括19 種Wnt 配體蛋白,根據其受體不同,分為經典的Wnt/β-catenin 信號通路、非經典的Wnt/平面細胞極性(planar cell polarity,PCP)、Wnt/Ca2+和調節紡錘體的方向及非對稱細胞分裂的胞內信號通路[27]。Wnt/β-catenin信號通路具有高度保守性,在組織發育與再生中起著核心作用,通過調節細胞質轉錄因子βcatenin 是否磷酸化參與成骨細胞分化,見圖3,激活經典Wnt 信號通路可以作為促進骨再生或加速骨愈合的一種有效方法,具有促進成骨和血管生成同時減少破骨形成的作用[28-30],并且其下游的RhoA/ ROCK 信號通路也在介導材料的不同微觀形貌成骨中表現出了重要作用[31-32]。

圖3 Wnt/β-catenin 信號通路示意圖Fig.3 Schematic diagram of Wnt/β-catenin signaling pathway
1.7 Hippo 信號通路
Hippo 信號通路是一條抑制細胞生長的通路,其下游效應因子為 YAP/TAZ,是調節間充質干細胞成骨分化的關鍵因子[33]。目前已有研究證明YAP/TAZ 信號通路和Wnt 信號通路介導了材料微觀形貌對細胞黏附和細胞骨架結構的調節,并最終影響成骨基因的表達[34],但Hippo 信號通路在是否有效促進成骨方面仍存在爭議,其具體機制有待進一步深入研究[35]。
1.8 NF-κB 信號通路
NF-κB 家族成員包括NF-κB1(p50)、NFκB2(p52)、RelA(p65)、RelB 和c-Rel,其信號通路分為IκB 降解使NF-κB 二聚體(即P50/P65復合物)得到釋放轉運至細胞核調控轉錄的經典信號通路,見圖4A,P100 或P105 經加工處理成p52/RelB 二聚體轉運至細胞核調控轉錄的非經典信號通路,見圖4B,以及NF-κB 介導的其他信號通路。NF-κB 是細胞內重要的核轉錄因子,參與機體的炎癥反應、免疫應答,調節細胞的凋亡、應激反應,并且通過其對炎癥環境的調節可以有效參與成骨分化過程[36-37]。
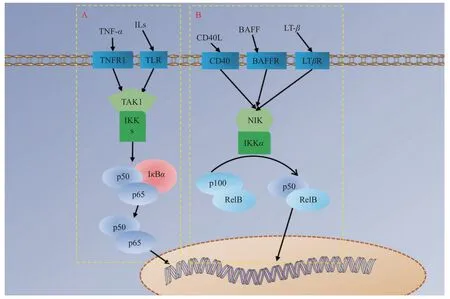
圖4 NF-κB 信號通路示意圖Fig.4 Schematic diagram of | NF-κB signaling pathway
1.9 Notch 信號通路
該信號通路的配體并不位于細胞外基質,而是位于與受體非同一細胞的細胞膜上,為DSL 家族蛋白,目前為止包括JAG1、JAG2、DLL1、DLL3 和DLL4,受體為Notch 跨膜蛋白。Notch 受體與配體結合后,經過ADAM 剪切釋放胞外段與配體一同降解,經γ-secretase 剪切釋放胞內段繼續信號傳導,激活Hes/Hey 基因的轉錄[26]。目前已有研究表明Notch 信號通路在成骨方面具有重要作用[38-40]。
1.10 JAK/STAT 信號通路
該信號通路的JAK(酪氨酸蛋白激酶)包括JAK1/2/3、TYK,STAT(信號轉導和轉錄激活子)包括STAT1/2/3/4/6、STAT5A、STAT5B[41],配體主要為ILs、INFs,與受體結合后使受體發生二聚化,同時與受體偶聯的JAK 發生自磷酸化而活化,招募并磷酸化STAT,使STAT 形成二聚體進入細胞核調控轉錄,參與成骨細胞的分化[3],同時也有研究表明其主要介導炎癥反應在骨形成中發揮作用[42-43]。
1.11 Hedgehog 信號通路
Hedgehog(Hh)信號通路由3 個配體Shh、Dhh、Ihh 和2 個跨膜蛋白受體Ptc、Smo 及其下游Gli、Fu、SuFu、Cos2、PKA 等轉錄因子組成。沒有Hh 配體時,Ptc 抑制Smo 蛋白活性從而抑制下游通路,Gli 與SuFu 結合并被加工成GliR,GliR 抑制靶基因轉錄;當Hh 配體與Ptc 結合時,解除對Smo 的抑制作用,Smo 使SuFu 與Gli 解離,Gli 轉變為GliA,促進靶基因轉錄。Hh 信號通路在細胞增殖、組織形成、干細胞維持和發育的控制中具有多種作用。研究證明,Hh 信號通路的激活參與了MSCs 向成骨細胞和軟骨細胞的分化,可以通過上調Runx2 等成骨細胞因子來促進骨量,在骨組織再生過程中起著關鍵作用[44-46]。
1.12 整合素信號通路
整合素是一個由α 鏈和β 鏈組成的異二聚體細胞跨膜蛋白家族[47],包括22 個不同的異源二聚體復合物,作為結合細胞外基質蛋白與細胞骨架之間信號的主要受體,允許間充質干細胞歸巢到骨以及可以加強成骨細胞和破骨細胞與細胞外基質之間的聯系,可以與ECM 結合觸發整合素聚類,激活FAK 等胞內信號蛋白,隨后導致ERK1/2、p38、PI3K、AKT 等磷酸化,從而參與成骨分化[48-51]。
1.13 其他信號通路
OPG/RANKL/RANK 信號通路在破骨細胞的分化、激活和凋亡中起著至關重要的作用,OPG可作為破骨細胞的負調控因子,競爭性地與RANKL 結合,阻斷RANKL/RANK 信號通路,抑制破骨細胞分化參與骨代謝過程,也可能是骨修復材料促成骨過程中的一種潛在調控機制[52-53]。也有文獻報道缺氧誘導因子(hypoxia-inducible factor,HIF)信號通路也參與了血管生成和成骨調控[49,54]。
2 骨修復材料促成骨分子機制
骨修復材料主要分為金屬材料、非金屬材料和復合材料3 大類,其中非金屬材料又可以分為無機材料和有機高分子聚合材料[55]。近些年骨修復材料在骨組織工程中的研究與應用越來越多,而針對其具體促成骨作用的分子機制研究還有待深入。
2.1 金屬材料
金屬生物材料因其出色的機械力學性能、良好生物相容性及生物安全性而被廣泛應用于骨缺損修復[56]。如鍶在骨組織代謝中可以促進成骨細胞增殖,同時抑制破骨細胞的活性[57],Cui 等[58]采用RT-qPCR 研究Wnt/β-catenin 信號通路相關基因(β-catenin,DKK1,Wnt5A)和 Western blot檢測β-catenin 信號通路蛋白表達情況,同時采用FH 535 阻斷Wnt/β-catenin 信號通路以探究骨水泥中鍶促成骨的可能分子機制,發現局部應用含鍶骨水泥,可通過激活Wnt/β-catenin 信號通路促進骨再生。Zheng 等[20]將經非熱大氣等離子體(non-thermal atmospheric plasma,NTAP)處理的鈦與MC3T3-E1 細胞共培養,通過qRT-PCR、Western blot 和免疫組化染色檢測,PI3K 和Akt蛋白表達顯著上升,與未經處理的鈦相比,NTAP 處理顯著促進了基質礦化和鈣結節形成,而在加入PI3K 抑制劑LY294002 的組MC3T3-E1細胞在NTAP 處理鈦表面的黏附、增殖和成骨分化顯然被抑制,說明PI3K/AKT 信號通路在其中起著關鍵作用。He 等[59]采用陽極氧化制備了具有納米管結構的多孔二氧化鈦材料,結合LCMS/MS 質譜分析和富集分析利用Western blot 檢測發現 p-ERK1/2 的表達受到促進,整合素β1、p-JNK、p-p38、CTSK 和TRAP 的表達受到抑制,RT-qPCR 檢測顯示OCN、OPN、ALP 和RUNX2顯著上調,且當破骨細胞經p-FAK 抑制劑處理后,p-FAK 的表達被抑制,同時破骨細胞標記蛋白CTSK 和TRAP 的表達也相應地再次降低,研究結果證實,該材料可以通過整合素介導的FAK 磷酸化及其下游MAPK 通路抑制破骨細胞的形成,改變細胞因子的分泌情況,使其更有利于成骨。
Zhang 等[60]研究了納米鉭的促成骨機制,發現納米鉭與骨髓間充質干細胞共培養和在SD 大鼠下頜骨缺損修復過程中,BMP-2、Smad4 和Runx2 的表達相比空白對照組增多,且添加Smad4 抑制劑后,ALP 表達、ECM 礦化和Smad4細胞免疫熒光顯著降低,表明BMP/Smad 是金屬鉭促成骨作用的可能機制。也有實驗證明,與鈣離子具有相似離子半徑的稀土元素也可以誘導骨組織生長,Ge 等[61]制備的含金屬鈰的復合材料中,釋放的鈰離子可以激活BMP-2/Smad 信號通路,提高BMP-2、OCN、Runx2 基因及成骨相關蛋白的表達水平促進骨組織再生。
2.2 無機材料
無機材料主要包括羥基磷灰石、磷酸鈣骨水泥、生物活性玻璃等。羥基磷灰石作為骨組織的主要無機成分常被用做骨修復材料[62],Guo 等[7]結合RNA 測序和功能富集分析,發現羥基磷灰石與臍帶間充質干細胞共培養所處的微環境中CDHs 和ITGA2 的表達增加,說明其成骨作用與Hippo 信號通路和PI3K/AKT 信號通路存在一定相關性,并且可能通過激活TGF-β 信號通路,協同激活ANXA10 依賴的PTHrP 信號通路和FGF信號通路,從而促進軟骨內成骨,且臍帶間充質干細胞高表達TIMP1 和TIMP3,表明HIF 信號通路在其中也存在激活,而對于OPG 表達的持續監測,揭示OPG/ RANKL 可能是羥基磷灰石成骨作用潛在調控途徑的一部分,此外SOX9、BMP 信號通路也存在激活,提示這一系列信號通路與羥基磷灰石促進成骨存在著密切的聯系。Lu 等[63]通過數字光刻打印制備了圓柱型、回旋型、菱形孔3 種典型結構的羥基磷灰石材料,RNA 測序顯示RhoA/ROCK2 信號通路相關基因的表達在各組間存在顯著差異,Western blot 和RT-qPCR 分析,DVL2、DAAM1、p-RhoA 和p-ROCK2 上調明顯,這些結果表明該材料通過增強RhoA/ROCK2 通路的機械信號轉導,促進了BMSCs 向成骨分化。
和成骨細胞一樣,來源于單核細胞或巨噬細胞的破骨細胞同樣是骨修復材料骨整合中的關鍵,Wang 等[64]通過改變磷酸四鈣和無水磷酸二鈣的比例制備不同鈣磷比的磷酸鈣骨水泥(calcium phosphate cement,CPC),通過表面等離子體共振分析,與鈣磷比為1.4 和1.5 時相比,鈣磷比為1.67 時CPC 可以顯著增強RANKL 對RANK 的親和力從而促進破骨細胞分化,同時蛋白條帶可視化和定量分析顯示,鈣磷比為1.67 時RANKL 誘導的NF-κB(p65)磷酸化顯著上調,而IκBα表達顯著下調,意味著1.67 鈣磷比的CPC 可以促進IκBα 的降解從而增強NF-κB 信號通路的轉導,揭示了高鈣磷比CPC(即鈣磷比為1.67 時的CPC)可以通過增強破骨細胞生成,促進TGFβ1 分泌加速骨愈合。
生物活性玻璃屬于第3 代骨修復材料,十分有利于體外成骨細胞分化和礦化[65],Yin 等[66]利用加入硼的生物活性玻璃(B-MBG)進行體內外實驗,B-MBG 均表現出理想的成骨效果,RNA 測序顯示Wnt/β-catenin 信號通路被激活,經Western blot 和免疫組化驗證,β-catenin、p-GSK-3β 及靶蛋白setd7(組蛋白賴氨酸甲基轉移酶7)表達增多,H3K4me3(組蛋白第三亞基四號賴氨酸的三甲基化)變多,而在敲除setd7 后,成骨相關標志物ALP 和Runx2 顯著下降,表明BMBG 促成骨效應是由Wnt/β-catenin 信號通路介導的,且Setd7 和H3K4me3 的表達可能受到Wnt/β-catenin 信號通路的調控從而參與成骨促進。MEI 等[67]制備了具有納米結構的硅酸鈣生物陶瓷,qRT-PCR 檢測成骨相關基因的表達,Runx2、OPN、Col1-α1 顯著上調,Western blot檢測FAK、p-FAK 和MAPK 信號通路相關蛋白(ERK、JNK、p38)表達水平,p-FAK、ERK、JNK、p38 表達水平明顯上調,且在添加FAK 信號通路抑制劑PF573228 和p38 信號通路抑制劑SB203580 時結果相反,表明硅酸鈣生物陶瓷可以活化FAK 激活MAPK 信號通路促進成骨。
2.3 有機高分子材料
與金屬和無機材料相比,聚合物材料具有更多適應臨床應用的物理化學性質,提供了更多的化學修飾和結構改變的可能性[68],是極具前途的骨修復材料之一[69]。然而,有機高分子材料在大多數時候都是作為復合材料的基體[70],使得缺少關于單一有機高分子材料促成骨作用相關分子機制方面的研究,未來可以優先考慮這一方面的探索。
Li 等[71]通過體內外實驗證明,負載去鐵胺的明膠水凝膠可以激活HIF1-α 信號通路,上調eNOS、VEGF 和SDF1-α 的表達,耦合成骨與血管化促進骨再生。ASPARUHOVA 等[72]利用qRTPCR 和Western blot,觀察到在透明質酸處理的ST2 和MC3T3-E1 細胞中OPN、Col-1、Runx2、BSP、ALP 表達明顯增加,Smad1/5/8 顯著下調,TGF-β1 和FGF 顯著上調,Smad2 磷酸化和Erk1/2 磷酸化增多,揭示透明質酸的促成骨作用是通過激活TGF-β/ Smad2 和Erk1/2 介導的信號通路實現的,但晚期同時表現為抑制BMP/ Smad信號通路。Han 等[47]采用3D 打印技術制備了氧化鐵涂層的聚乳酸-羥基乙酸共聚物骨修復材料,通過對整合素亞基α1、α2、α5、β1、β3 以及FAK、ERK1/2 和成骨標志基因(OCN、Col-I、OPN、BMP2、ALP)的檢測,發現該材料可以激活整合素信號通路,活化FAK,上調ERK1//2 促進成骨。
聚醚醚酮(polyetheretherketone,PEEK)因其優異的力學性能和物理化學耐受性已被廣泛用作骨修復材料[73],Gao 等[42]采用O2 等離子體處理PEEK 后,利用分層自組裝技術制備了具有納米孔結構的PEEK 材料與骨髓間充質干細胞共培養,進行全基因組表達分析,發現其促成骨作用與MAPK 和PI3K-Akt 信號通路介導炎癥反應有關,為具有免疫調節能力新材料及其分子機制的研究提供了不同思路。Xue 等[74]研究了臍帶間充質干細胞、骨髓間充質干細胞、脂肪間充質干細胞在聚己內酯(polycaprolactone,PCL)材料上的成骨分化能力及可能機制,發現PCL 對3 種間充質干細胞都具有成骨促進作用,Western blot 檢測,βcatenin、p-Smad3 上調,且經β-catenin 抑制劑DKK1、p-Smad3 抑制劑SIS3 反向實驗,發現抑制劑聯合使用比單一使用顯著降低間充質干細胞的成骨分化,證明PCL 的促成骨作用是通過激活Wnt/β-catenin 信號通路和smad3 相關信號通路進行。Wang 等[18]研究表明,聚多巴胺作為一種涂層材料能有效促進成骨,在成骨分化驗證實驗中,免疫熒光染色顯示聚多巴胺涂層組黏著斑蛋白(Vinculin)表達強度顯著高于空白組,Western bolt 檢測p-FAK、p-p38 表達增多,說明聚多巴胺涂層對BMSCs 成骨分化的增強涉及FAK/P38通路的激活。Sun 等[75]研究也表明聚多巴胺涂層可能通過激活Wnt 信號通路、TGF-β 信號通路參與促骨生成。
2.4 復合材料
為獲得更佳的骨傳導性、骨誘導性和骨形成效果及具有良好的機械性能與生物相容性的骨修復材料,對材料進行復合是一種研究新趨勢[76],并且針對復合骨修復材料促進成骨機制的研究成果卓著,見表1。
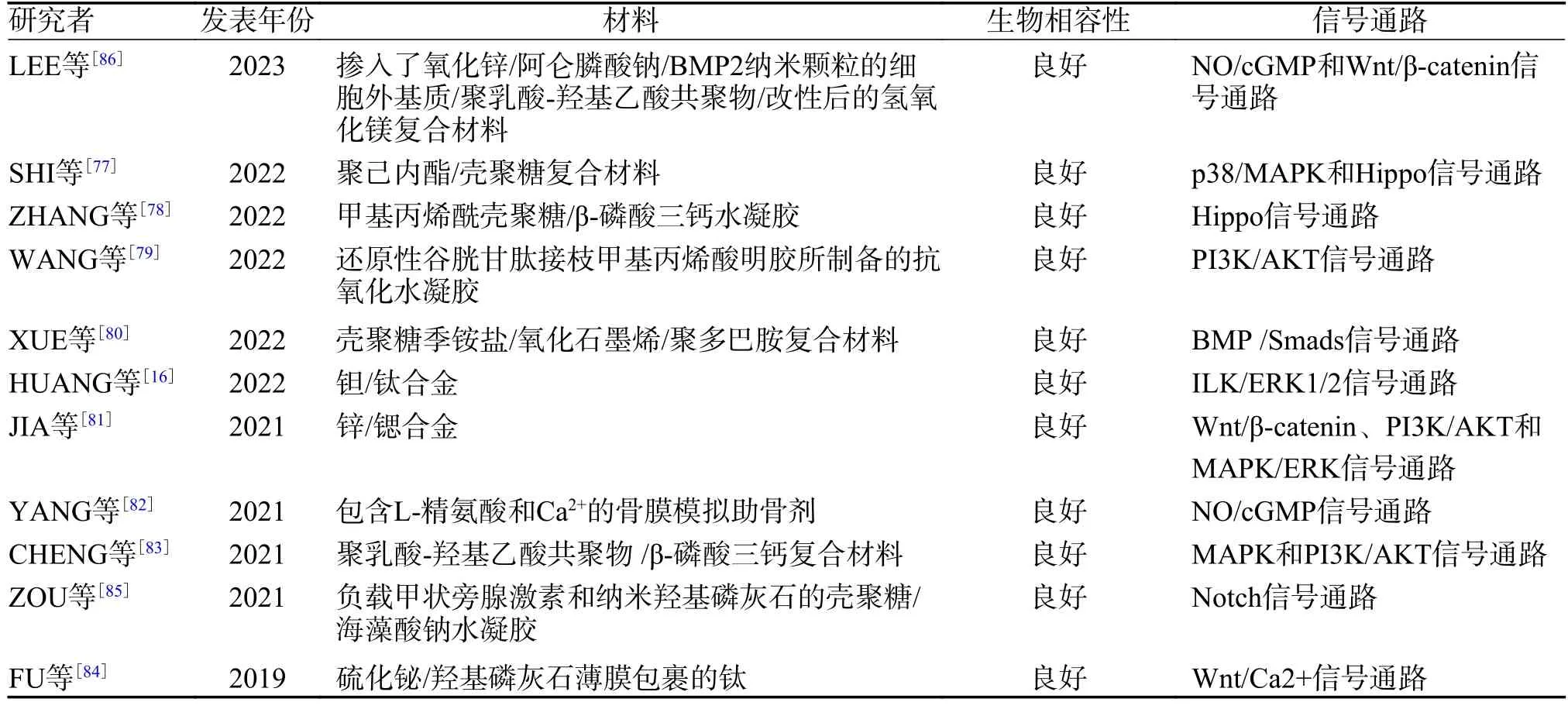
表1 復合材料成骨機制的研究Tab.1 Studies on osteogenic mechanism of composite materials
聚己內酯的疏水性和殼聚糖較差的力學穩定性,限制了他們在骨修復中的應用,而Shi 等[77]將它們經溶劑鑄造制成復合材料,結合前期IL-10 敲除小鼠會發生骨質流失的研究成果,發現該材料通過增加外胚間充質干細胞(ectoblast mesenchyme stem cells,EMSCs)中的IL-10 水平激活p38/MAPK 信號通路誘導抗炎反應促進成骨,在進一步使用shRNA 特異性沉默Hippo 信號通路中的關鍵分子YAP 進行功能喪失實驗后,發現EMSCs 中的礦化面積和堿性磷酸酶活性降低,該材料的機械性能可能使YAP 產生響應進而調控成骨作用。Zhang 等[78]以甲基丙烯酰殼聚糖和β-磷酸三鈣進行光交聯形成的復合水凝膠經實驗證明可以上調堿性磷酸酶、骨鈣素和骨橋蛋白的表達,驗證了Hippo 信號通路在該材料促成骨的調控機制中發揮作用。Wang 等[79]將還原性谷胱甘肽接枝甲基丙烯酸明膠所制備的抗氧化水凝膠(GelMA-g-GSH)與MC3T3-E1 細胞共培養,經過RNA 測序與富集分析,PI3K-Akt 信號通路明顯上調,采用qRT-PCR 與Western blot 檢測βcatenin、GSK-3β 和PTEN 的表達水平,發現βcatenin 基因和蛋白水平上調,PTEN 和GSK-3β基因和蛋白水平下調,并且在GelMA-g-GSH 組中最明顯,而在使用了PI3K 特異性抑制劑LY294002 后,相關基因與蛋白表達水平與之前相反,表明PI3K/Akt 信號通路是GelMA-g-GSH促進成骨的潛在機制之一。Xue 等[80]實驗證明MC3T3-E1 細胞在殼聚糖季銨鹽/氧化石墨烯/聚多巴胺復合材料刺激36 h 后,經Western blot 檢測BMP2、BMPR1B、BMPR2、p-Smad1/5/8、Smad1/5/8和Runx2 蛋白的表達水平升高,表明BMP/Smads信號通路在MC3T3-E1 細胞中參與了該復合材料促進成骨的過程。
而將金屬與金屬復合,同樣可以獲得更好的成骨效果,Huang 等[16]選擇金剛石和菱形十二面體作為單位細胞結構,利用激光熔融技術制備了鉭/鈦合金復合材料,其具有與骨小梁結構相似的優點,研究證明當大鼠骨髓間充質干細胞黏附在材料表面時,ILK 被FAK 所募集并激活ERK1/2,磷酸化的ERK1/2 顯著上調Runx2 的表達水平,此外應用U0126(ERK1/2 抑制劑)和OSU-T315(ILK 抑制劑)可明顯下調Runx2 表達水平,進一步證實了ILK/ERK1/2 信號通路介導了該材料的促成骨作用,且通過分組對比發現,具有金剛石單位細胞結構的鉭/鈦合金具有更加優異的生物性能和適當的機械強度。同樣,Jia 等[81]合成的鋅/鍶合金材料,體內外實驗表現出理想的成骨效果,經RNA 測序和Western blot 表明,該合金可以通過激活Wnt/β-catenin、PI3K/AKT 和MAPK/ERK信號通路來促進成骨。
Yang 等[82]不僅關注復合材料對成骨的影響,并且同時聚焦復合材料促血管化的作用,經體內外實驗證明,他們制備的骨膜模擬助骨劑復合材料可以實現L-精氨酸和Ca2+的持續釋放,激活NO(一氧化氮)/cGMP 通路,增強成骨與血管生成耦合效應促進骨組織再生,提示cGMP 信號轉導通路也潛在參與了骨形成的調控,可以深入研究。Cheng 等[83]所制備的聚乳酸-羥基乙酸共聚物(poly lactide-co-glycolide),PLGA)和β-磷酸三鈣(β-tricalcium phosphate,β-TCP)復合材料在大鼠顱骨缺損模型免疫組化中顯示,VEGF 表達顯著增多,結合Western blot 檢測,發現VEGF引發Src、AKT、FAK 和p38 下游磷酸化促進血管再生與骨形成,表明MAPK 信號通路和PI3K/AKT 信號通路參與了該材料促成骨的作用,且進一步研究發現在材料中添加葫蘆素B 后,VEGF 表達再一次上調,成骨和血管化效果增強。基于光學、電學、超聲和磁化等方法具有非侵入性和精確調節生物活性的優點,Fu 等[84]制備了硫化鉍/羥基磷灰石薄膜包裹的鈦復合材料,結合生信分析,該材料在近紅外照射下可以產生電子,使Wnt 和Frizzled 的表達發生改變,PLC、IPR3、IP3 和IP3R 顯著上調,激活Wnt/Ca2+信號通路參與材料促成骨作用,揭示物理因素在骨修復材料促進成骨中依舊可以發揮正向作用。Zou 等[85]將甲狀旁腺激素(PTH)和納米羥基磷灰石(nHAP)加入具有多孔結構帶電基團相反的殼聚糖(chitosan,CS)/海藻酸鈉(sodium alginate,SA)水凝膠(Gel)中,蛋白質免疫印跡和實時聚合酶鏈反應顯示,相比于對照組,Gel-nHAP-PTH 組和Gel-nHAP 組Notch1、Jagged1、NICD、Hes1、Hes5 水平顯著升高,且Gel-nHAP-pth 組的表達高于Gel-nHAP組,表明得益于PTH 和nHAP 的加入,GelnHAP-PTH 可以顯著誘導Notch 信號通路的激活促進成骨蛋白和基因的表達,以改善成骨分化。
結合聚乳酸-羥基乙酸共聚物(PLGA)、改性后的氫氧化鎂(mMH)、細胞外基質(ECM)各自的優點,Lee 等[86]制備的摻入了氧化鋅/阿侖膦酸鈉/BMP2 納米顆粒的仿生PLGA/mMH/ECM 復合材料在抗炎、促血管生成、抗破骨細胞生成和骨再生方面表現出了良好的多功能活性,結合RNA 測序技術,采用Western blot、PCR、ELISA 檢測發現,由于該材料引起NO 的持續釋放,誘導了可溶性鳥苷酸環化酶(soluble guanylate cyclase,sGC)激活,使cGMP 和PKG 等信號分子上調,導致VEGF 和HIF-1α 的高表達,下調了DKK-1 的表達,激活了NO/cGMP 和Wnt/β-catenin 信號通路產生了有利于骨再生的一系列生理過程。
3 小結
現今的多種骨修復材料是繼自體骨、同種異體骨后,對骨缺損修復有效的植入替代物,通過對各種骨修復材料的改性與結構設計,使其有望在臨床實踐中得到廣泛應用。同時研究發現MAPK 信號通路、PI3K/AKT 信號通路、AMPK 信號通路、TGF-β 超家族信號通路、Wnt 信號通路、Hippo 信號通路、NF-κB 信號通路、Notch信號通路、JAK/STAT 信號通路、Hedgehog 信號通路、整合素信號通路等許多分子通路機制都參與了骨修復材料促骨再生過程,對骨修復材料如何促進成骨分化起著主要調控作用。雖然骨修復材料促成骨作用具有復雜的分子機理,各種信號通路相互交錯構成一個調控網絡,但信號通路與信號通路之間,分子與分子之間,可能存在共通點,這可以作為今后研究的突破點。并且目前骨修復材料促成骨機制方面的研究對象多集中于各種負載生物活性因子的復合材料,對單一材料具體促成骨作用信號通路的探索相對較少,且對于骨修復材料在促成骨過程中與免疫環境的改善、促血管化等方面的串擾機制所關注的較少,增加骨修復材料對體內微環境影響的關注更有利于理解其促進成骨作用的分子機制。
骨修復材料的靈活設計與體內外促成骨研究在今后依然是熱門研究領域,但對于其促成骨作用具體機制的許多細節還有待進一步深入研究與闡述。本文中所介紹的相關信號通路和骨修復材料促成骨機制的研究實例可以為今后的研究提供一些新的切入點與參考,有助于深入了解骨修復材料促成骨作用背后的分子機制,為其精準設計與臨床應用鋪平道路。未來進一步闡明涉及各信號通路激活的詳細機制,并確定其在骨修復材料促進成骨中的具體作用,可以為骨組織工程中生物材料的研究帶來新的突破,揭示骨修復材料在促進成骨分化過程中的作用機制與規律將會是未來骨修復材料研究所關注的重點。

