谷氨酸棒狀桿菌高絲氨酸脫氫酶單突變體酶學性質表征
江澤沅,柳羽哲,高 欣,曾 琦,閔偉紅*
(吉林農業大學食品科學與工程學院,小麥和玉米深加工國家工程實驗室,吉林 長春 130118)
蛋氨酸(Met)具有多種生理功能,在醫藥、飼料、食品等領域得到廣泛應用[1]。在醫藥方面,Met具有保護肝臟、心肌、解毒、抗抑郁和降血壓等生理活性,在臨床治療上應用廣泛[2];在飼料方面,Met是禽畜類必需氨基酸之一,具有提供營養、提高動物免疫力和抗氧化力等功能[3];在食品方面,Met被用作食品調味劑和營養強化劑。目前,工業上主要通過化學法和蛋白水解法獲得Met,微生物合成法由于過量積累的Met對微生物生長有害,未被大規模應用于工業化生產[4]。
天冬氨酸族氨基酸代謝途徑是特異性生產M e t的氨基酸代謝途徑,天冬氨酸是谷氨酸棒狀桿菌(Corynebacterium glutamicum)中合成Met的前體物質,在天冬氨酸激酶催化下生成天冬氨酰-4-磷酸,經過天冬氨酸半醛脫氫酶催化合成天冬氨酸半醛[5]。高絲氨酸脫氫酶(homoserine dehydrogenase,HSD)參與天冬氨酸族氨基酸代謝途徑的第3步反應,通過NADPH將L-天冬氨酸-β-半醛還原為L-高絲氨酸(L-homoserine,L-HSE),調控碳流向高絲氨酸生成的方向進行,最終控制Met的合成[6]。因此,減弱或解除天冬氨酸族氨基酸代謝途徑中HSD的抑制作用能夠達到通過微生物合成法高產Met的目的。
H S D 是一種氧化還原酶,在谷氨酸棒狀桿菌中由hom基因編碼,催化中心在生物中具有不同折疊方式,其晶體結構主要分為二聚體結構和四聚體結構。在嗜熱棲熱菌(Thermus thermophilus)[7]、釀酒酵母(Saccharomyces cerevisiae)[8]、極端嗜熱古菌(Hyperthermophilic archaeal)[9]、超嗜熱古菌(Sulfolobus tokodaii)[10]和金黃色葡萄球菌(Staphylococcus aureus)[11]中HSD為二聚體結構;在枯草芽孢桿菌(Bacillus subtilis)[12]、多核桿菌(Polynucleobacter)[13]和淋病奈瑟菌(Neisseria gonorrhoeae)[14]中HSD為四聚體結構。
Ogata等[15]通過結構分析,在超嗜熱古菌中發現半胱氨酸(Cys)位于高絲氨酸結合位點內,并且Cys和煙酰胺環之間形成了共價鍵,進而抑制HSD活力。Kubota等[16]通過Sulfurisphaera tokodaii重組HSD被熱處理后顯著激活,得出熱誘導活化是由于HSD催化區域的特定構象發生變化。此外,Li Ning等[17]在谷氨酸棒狀桿菌中,通過強啟動子增強L-HSD和L-高絲氨酸乙酰轉移酶表達,進一步通過發酵使O-乙酰-L-高絲氨酸提高產量。然而,對HSD基因突變生產Met的研究較少。申術霞等[18]成功獲得酶活力顯著提高的雙突變體L200F/D215K,為構建高產Met工程菌提供了參考依據。因此,本研究在實驗室成功構建pET-28a-HSD基礎上,對HSD進行基因突變,以獲得高活力HSD,并進一步對高酶活力菌株進行酶學性質表征。旨在通過對HSD分子空間結構改造,為以后研究HSD催化機制和構建高產Met工程菌株提供一定的理論依據。
1 材料與方法
1.1 材料與試劑
谷氨酸棒狀桿菌ATCC13032、大腸桿菌BL21(DE3)和大腸桿菌DH5α均由本實驗室保存;pET-28a-HSD質粒由實驗室構建。
Taq聚合酶、定點突變試劑盒、核酸電泳Marker日本TaKaRa公司;非預染蛋白電泳Marker、基因組DNA抽提試劑盒、質粒抽提試劑盒、DNA膠回收試劑盒生工生物工程(上海)股份有限公司;高保真DNA聚合酶2×Phanta Max Master Mix Vazyme(中國)公司;異丙基硫代-β-D-半乳糖苷(isopropyl-β-Dthiogalactopyranoside,IPTG)、卡那霉素 長春市翊博生物科技公司;LB(Luria-Bertani)培養基參照文獻[19]配制,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)試劑參照文獻[20]配制。
1.2 儀器與設備
TGL-20000CR低溫離心機 上海安亭科學儀器廠;空氣浴振蕩器 東聯電子技術開發有限公司;鋁質梯度聚合酶鏈式反應(polymerase chain reaction,PCR)儀德國Eppendorf AG公司;隔水式恒溫培養箱 上海精宏實驗設備有限公司;可見分光光度計 沙鷹科學儀器(上海)有限公司;蛋白印記轉膜儀 美國Bio-Rad公司;SE260蛋白電泳儀 美國GE公司;UVP GelStudio Plus凝膠成像儀 德國耶拿公司。
1.3 方法
1.3.1 HSD突變體構建
以6dzs晶體結構為模板,利用同源建模方法獲得了HSD的三維結構,使用軟件Autodock4對催化底物L-HSE和NADP+進行分子對接,得到HSD與催化底物的復合結構。采用Discovery Studio軟件[21]確定了突變的氨基酸位點,利用Primer 5.0軟件設計突變位點引物,以pET-28a-HSD質粒為模板進行飽和定點突變。反應條件:94 ℃預變性5 min,94 ℃變性90 s,56 ℃退火1 min,72 ℃延伸10 min(擴增20 個循環);72 ℃延伸15 min。突變PCR完成后,使用1%瓊脂糖凝膠對PCR產物進行電泳驗證,保證質粒突變成功。隨后,將質粒用DpnI酶在37 ℃金屬浴中消化2 h,消化體系為緩沖液18 μL、突變PCR產物2 μL、DpnI酶0.3 μL[22]。
將大腸桿菌DH5α感受態細胞在冰上冰浴30 min,加入10 μL消化后PCR突變產物,充分混勻后冰浴15 min,在42 ℃金屬浴熱擊90 s后再次冰浴10 min,加入900 μL LB液體培養基,放入37 ℃、190 r/min搖床中培養1~2 h。將復蘇的菌液5 000 r/min離心5 min,棄掉上清液,將剩余100 μL菌液吹打混勻后,均勻地涂布于含卡那霉素的LB固體培養基中,在37 ℃培養箱中過夜培養[23]。挑取平板上單菌落進行擴大培養,經過菌液PCR驗證后,將成功轉化的菌液提取質粒進行測序。
1.3.2 突變體的表達和純化
將大腸桿菌DH5α成功突變pET-28a-HSD質粒轉化到表達菌株BL21中,挑取單菌落進行擴大培養,對菌液進行PCR驗證,確保質粒成功轉化至大腸桿菌BL21中。按2%接種量接種到100 mL含卡那霉素的LB發酵培養基中,放在37 ℃搖床中培養2 h,當菌液OD600nm值在0.6~0.8之間時加入100 μL誘導劑IPTG使其終濃度為1 mmol/L,放入搖床進行26 ℃、180 r/min誘導14~16 h。誘導后的菌液4 ℃、8 000 r/min離心10 min,棄掉上清液,用預冷磷酸鹽緩沖溶液重懸菌體進行超聲波破碎,4 ℃、8 000 r/min離心10 min,收集的上清液即為粗酶液。最后,將粗酶液進行鎳柱純化處理得到純化液[24]。
1.3.3 HSD活力測定
將HSD的1 個酶活力單位定義為每10 min生成1 μmol NADPH所需要的酶量,其酶活力根據NADPH在340 nm波長處吸光度的變化進行測定。反應體系總體積為5 mL:100 mmol/L Tris-HCl(7.5)、10 mmol/L MgCl2、80 mmol/L KCl、1.2 mmol/L NADP+、20 mmol/LL-HSE、100 μL酶液[25-26]。將反應體系置于37 ℃水浴10 min后檢測NADPH在340 nm波長處吸光度變化量。通過考馬斯亮藍法測定酶液中蛋白含量,每組實驗做3 個平行[27]。
1.3.4 HSD最適pH值和最適反應溫度測定
以L-HSE為底物,分別在不同pH值(6、6.5、7、7.5、8、8.5、9、9.5)和不同溫度(25、30、35、40、45、50 ℃)條件下進行最適反應pH值和最適反應溫度測定。將最高酶活力定義為100%,每組實驗做3 個平行。
1.3.5 HSD熱穩定性測定
將野生型(wild type,WT)和突變體分別置于最適溫度下水浴保溫,每隔1 h測定HSD活力,一共檢測9 h,進而計算得出HSD活力半衰期。將0 h的酶活力定義為100%,每組實驗做3 個平行。
1.3.6 金屬離子、有機溶劑和底物抑制劑對HSD活力影響的測定
以L-HSE為底物,測定不同濃度(20、60、100、200 mmol/L)下K+、Mg2+和Ca2+對HSD活力影響;測定不同體積分數(1%、5%、10%、20%)甲醇、乙醇、乙腈和二甲基亞砜對HSD活力影響;測定不同濃度(1、5、10、20 mmol/L)的蘇氨酸(Thr)、Met、Thr+Met對HSD活力影響。將不添加金屬離子、有機溶劑以及酶抑制劑的酶活力定義為100%,每組實驗做3 個平行。
1.3.7 酶動力學分析
在酶活力反應體系中,以不同濃度(1、5、10、20、30、40、50、70、90、100、200 mmol/L)L-HSE為底物,測定HSD活力,每組實驗做3 個平行。根據Hill方程[25]V=Vmax[S]n/(K+[S]n)在GraphPad Prism軟件中進行非線性擬合。
1.4 數據處理與分析
2 結果與分析
2.1 HSD突變位點選擇
采用同源建模獲得HSD三維結構,通過AutoDock對底物進行分子對接[26],成功構建HSD復合結構(圖1)。通過Discovery Studio軟件確定底物周圍4 ?范圍內氨基酸殘基,由于保守位點影響底物結合,同時,根據突變原則不能選擇CG含量過高位點,因此,選擇Asp61和Gly25兩個位點進行突變,篩選出酶活力較WT提高的突變體。
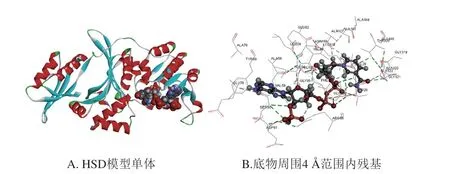
圖1 突變位點選擇Fig.1 Selection of mutation sites
2.2 HSD基因飽和定點突變
將全質粒擴增突變PCR產物用瓊脂糖核酸電泳進行驗證,pET-28a質粒大小約為5 369 bp,HSD基因大小約為1 335 bp,因此,突變PCR產物大小約為6 700 bp。如圖2所示,在4 000~7 000 bp范圍內靠近7 000 bp處出現一條明亮的條帶,表明突變成功。將突變PCR產物轉化至大腸桿菌BL21感受態中,經過測序驗證突變成功,初篩獲得酶活力提高的兩個突變體A61L和G25G。測序結果表明,Asp61位點由Asp突變成賴氨酸(Lys),Gly25位點密碼子由GGA突變成G。
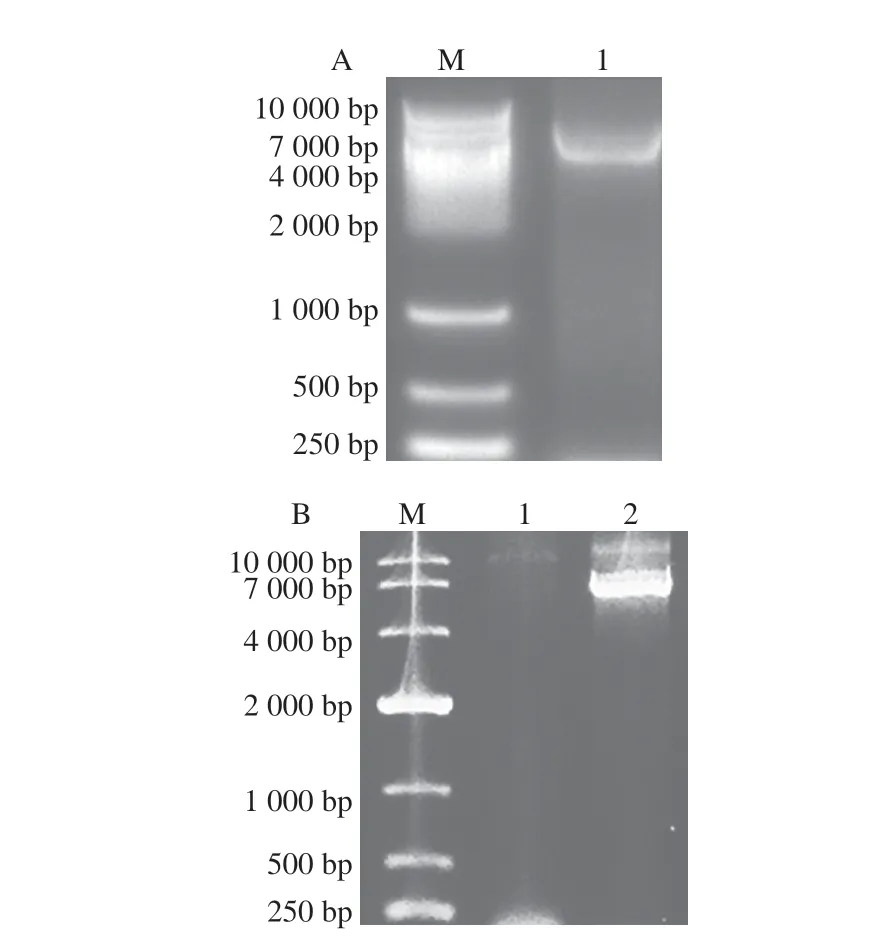
圖2 Gly25(A)和Asp61(B)飽和定點突變PCR核酸電泳Fig.2 Electrophoresis of PCR amplified products from Gly25 (A) and Asp61 (B) with site-directed saturation mutation
2.3 HSD蛋白表達和純化
將誘導表達的WT、A61L和G25G依次經過前處理和鎳柱純化得到HSD純化液,SDS-PAGE結果(圖3)顯示,純化液在46 kDa附近有明顯單一條帶,表明HSD蛋白表達成功;Western Blot驗證結果表明,HSD純化液含有HSD蛋白。
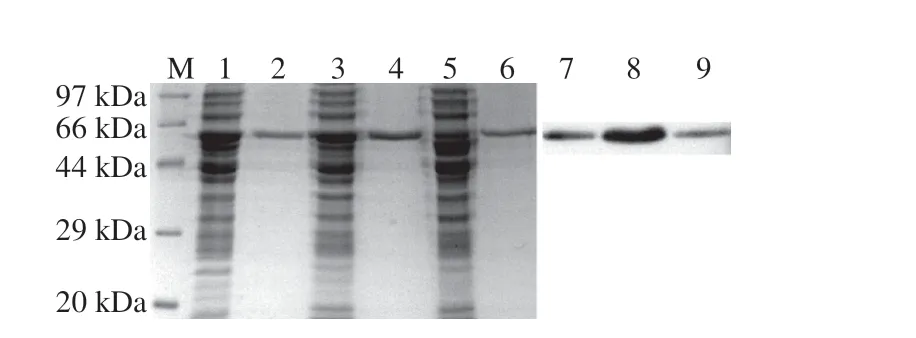
圖3 SDS-PAGE及Western Blot驗證結果Fig.3 SDS-PAGE and Western blot of purified HSD
2.4 HSD酶動力學分析
測定數據用軟件GraphPad Prism 8進行非線性擬合,如圖4所示。WT和突變體的酶動力學曲線符合Hill方程V=VmaxSn/(Kn+Sn),表明HSD為典型的別構酶。由表1可知,A61L和G25G突變體Vmax分別是WT的1.21 倍和1.35 倍。相比于WT,A61L和G25GKm值降低,表明突變體催化效率相較于WT提高,與底物親和力增強。WT、A61L和G25G的n值均大于1,說明WT和突變體呈正協同性,并且A61L和G25G的n值相對于WT顯著變小,說明別構效應減弱。

表1 WT和突變體的酶動力學參數Table 1 Enzyme kinetic parameters of WT and mutants
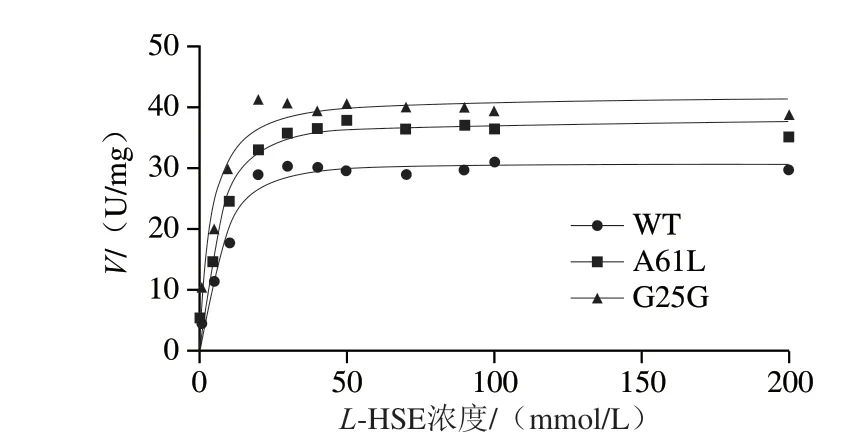
圖4 WT和突變體的酶動力學曲線Fig.4 Enzyme kinetic curves of WT and mutants
2.5 HSD酶學性質
2.5.1 最適反應pH值和最適反應溫度分析
由圖5可知,與WT相比,突變體A61L和G25G最適溫度沒有顯著變化。在高溫環境下,A61L和G25G相對酶活力高于低溫,且顯著高于WT,表明突變體A61L和G25G更加耐高溫。此外,與WT相比,突變體A61L最適pH值沒有顯著變化,為8.0,突變體G25G最適pH值提高至8.5。在堿性環境下,突變體A61L和G25G相對酶活力高于WT,表明突變體更適應堿性環境。

圖5 溫度(A)和pH值(B)對酶活力的影響Fig.5 Effect of temperature (A) and pH (B) on enzyme activity of WT and mutants
2.5.2 突變體熱穩定性分析
由圖6可知,WT和突變體在40 ℃最適溫度下水浴保溫,隨著保溫時間延長,WT和突變體相對酶活力持續下降,且下降趨勢相似。與WT酶活力半衰期相比,突變體A61L酶活力半衰期增加至5.5 h,G25G酶活力半衰期減少至4.0 h。此外,突變體G25G在反應初期(0~2 h)和反應后期(7~9 h)相對酶活力均高于WT;然而,突變體A61L相對酶活力在整個反應時間內均高于WT。
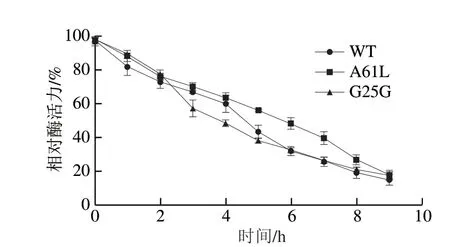
圖6 WT和突變體的熱穩定性Fig.6 Thermostability of WT and mutants
2.5.3 金屬離子對WT和突變體酶活力的影響
由表2可知,終濃度為20~200 mmol/L的K+對WT、A61L和G25G有激活作用,隨著濃度增大相對酶活力增高,在終濃度為100 mmol/L時WT、A61L和G25G相對酶活力達到最高,隨后,增大濃度相對酶活力開始減弱;終濃度為20 mmol/L的Mg2+對WT、A61L和G25G有激活作用,并且在該濃度下WT和突變體相對酶活力最高,隨著濃度增加相對酶活力降低;WT和A61L在Ca2+終濃度為20 mmol/L和60 mmol/L時被激活,G25G在Ca2+終濃度20、60 mmol/L和100 mmol/L時被激活,且隨著濃度增大相對酶活力減弱。以上結果表明,低濃度的K+、Mg2+和Ca2+是WT和突變體的促進劑,且隨著離子濃度增加抑制HSD活力。
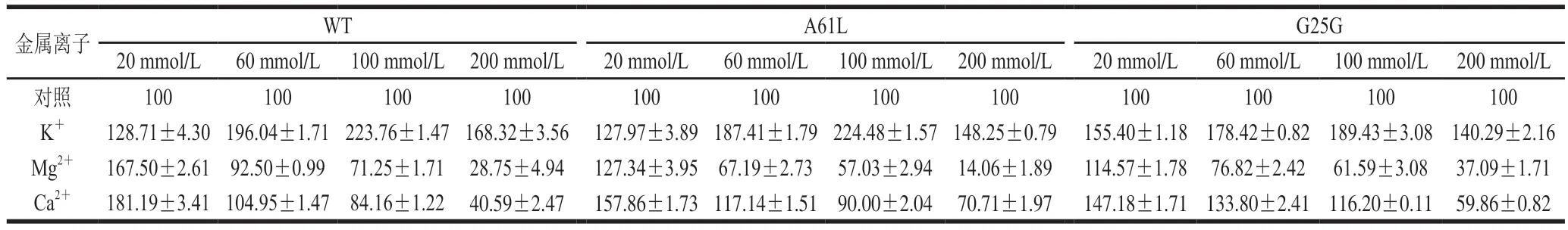
表2 金屬離子對WT、A61L和G25G相對酶活力的影響Table 2 Effects of metal ions on relative enzyme activities of WT, A61L and G25G %
2.5.4 有機溶劑對WT和突變體酶活力的影響
由表3可知,不同體積分數有機溶劑對WT、A61L和G25G均有抑制作用,但5%乙醇對WT有激活作用,在該體積分數下WT相對酶活力達到最大,為115.11%;1%乙腈對A61L有激活作用,在該體積分數下A61L相對酶活力為107.65%;1%、5%、10%乙醇以及1%甲醇對G25G有激活作用,在5%乙醇時相對酶活力達到最大,為125.64%。隨著有機溶劑體積分數增大,WT、A61L和G25G相對酶活力下降。

表3 有機溶劑對WT、A61L和G25G相對酶活力的影響Table 3 Effects of organic solvents on relative enzyme activities of WT, A61L and G25G %
2.5.5 底物抑制劑對WT和突變體酶活力的影響
由表4可知,WT受Thr反饋抑制和Met阻遏抑制。隨著Thr和Met濃度增加,抑制作用顯著加強,當Thr和Met抑制劑濃度增加至25 mmol/L時,對WT抑制率分別為83.67%和88.10%。當兩種抑制劑組合濃度為25 mmol/L時,WT抑制率達到最高,為93.62%。在Thr、Met和Thr+Met抑制劑濃度為1~25 mmol/L時,突變體A61L和G25G抑制率均低于WT,結果表明,突變有效地降低了Thr反饋抑制和Met阻遏抑制,且在Thr+Met濃度為25 mmol/L下,突變體A61L和G25G抑制率達到最高。Thr對WT和突變體抑制作用弱于Met抑制劑,但Thr+Met抑制作用顯著增強。
3 討 論
由于生物遺傳密碼子存在簡并現象,在某一堿基改變后,其原來的某種氨基酸位置譯成同一種氨基酸,此現象稱同義突變[28]。同義突變不會改變產生的蛋白質,但會對蛋白質水平產生顯著影響[29-30]。同義突變主要是根據密碼子偏好性進行最優密碼子選擇。密碼子偏好性是翻譯效率的重要決定因素,其通過調節RNA加工、蛋白質翻譯和蛋白質折疊等多種過程加快翻譯速率,進而提高酶的活性。鄭志強[31]利用密碼子偏好性對極端嗜熱細菌嗜熱棲熱菌的漆酶編碼基因進行密碼子優化,得到了酶活力提高86 倍的漆酶;董聰等[32]通過對FAD依賴的葡萄糖脫氫酶進行密碼子優化,成功構建高酶活力且穩定表達的重組菌株,表明利用密碼子偏好性對酶編碼基因進行密碼子優化能夠提高酶的活性。因此,本研究中突變體G25G在25位點密碼子為GGC,WT在25位點密碼子為GGA,根據大腸桿菌密碼子偏好性分析,GGC密碼子偏好性高于GGA密碼子偏好性,表明GGC密碼子對應的tRNA比GGA密碼子對應的tRNA具有數量優勢,促進翻譯過程中tRNA聚集,進而加速翻譯延伸過程,最終提高HSD活性。
HSD晶體結構空間變化和氫鍵改變均會導致酶活力升高或降低,WT 61位點為保守位點,A61L突變后,在位點側鏈形成一個類似細長的棒狀結構,解除電荷相互作用,空間位阻降低,更容易與底物相結合,促進酶-底物中間過渡態的形成和轉化。相較于WT,突變體A61LKm值由7.011 mmol/L降低到6.276 mmol/L,這也表明與底物作用力增強,提高其酶活力和底物親和力。
4 結 論
本研究對谷氨酸棒狀桿菌HSD關鍵位點Gly25和Asp61進行飽和定點突變以達到增強底物親和力和提高酶活力、得到優良單突變體的目的。通過互補引物進行全質粒擴增,獲得2 個單突變體A61L和G25G。根據動力學分析,A61L和G25G突變體Vmax較WT分別提高到1.21 倍和1.35 倍,突變體與底物親和力增強。酶學性質結果表明,突變體G25G最適pH值比WT提高,耐酸堿程度增加;2 個突變體最適溫度與WT一致,但耐熱性較WT提高;突變體A61L酶活力半衰期較WT延長,并表現出良好的穩定性;低濃度K+、Mg2+和Ca2+對突變體有激活作用;部分低體積分數乙醇、甲醇、乙腈和二甲基亞砜對突變體有抑制作用。本研究為優化谷氨酸棒狀桿菌HSD代謝途徑和促進天冬氨酸族氨基酸生物合成產業發展提供參考依據。

