手性內酯類化合物的來源及其制備方法研究進展
汪 薇,王靖宇,辛 璇,*,任文彬,*,白衛東,毛 悅
(1.仲愷農業工程學院輕工食品學院,廣東 廣州 510225;2.仲愷農業工程學院 廣東省嶺南特色食品科學與技術重點實驗室,廣東 廣州 510225)
內酯是指羥基脂肪酸分子內脫去一分子水形成的產物。根據羥基脂肪酸上羥基位置的不同,可將其分為β-內酯、γ-內酯、δ-內酯等[1]。內酯天然存在于各種果蔬(如芒果、桃子和草莓)和動物產品(如肉類和牛乳)中,也是這些食品香氣和風味的主要貢獻者[2]。內酯類化合物具有較低的香氣閾值,如γ-壬內酯、γ-癸內酯和γ-十二內酯在葡萄酒中的香氣閾值分別為25 μg/L、0.88 mg/L和7 μg/L[3],在氣味描述符上有明顯的差別,如桃子果香、椰子香、奶油香和花香等[4]。一些內酯類化合物還兼具抗菌和消炎等生物活性[5-6],這些內酯類化合物已被作為食品添加劑和香料而廣泛應用于食品和日化產品中。此外,內酯類化合物也被報道可作為綠色溶劑、燃料和各種高附加值化合物的合成前體物質,如γ-戊內酯[7]。內酯類化合物每年的市場銷量達到數千萬噸,價格在300~6 000 美元/kg之間[8]。大多數內酯類化合物具有手性結構,其分子的絕對構型通常決定了其香氣特征和生物活性。深入了解手性內酯類化合物的來源、結構、香氣特征和制備方法,有助于全面認識內酯類化合物,推動內酯類化合物在食品、日化用品等領域中的應用。然而,對于不同種類的手性內酯類化合物的天然來源和制備方法目前鮮見系統綜述報道。因γ-內酯(五元環)以及δ-內酯(六元環)的環內角張力最小,是最為穩定的結構,所以γ-內酯和δ-內酯在食品、化妝品、醫藥和精細化工等領域中應用最為廣泛[9]。因此,本文對食品中常見的7 種γ-和δ-手性內酯(γ-戊內酯、γ-己內酯、γ-癸內酯、γ-十二內酯、δ-癸內酯、δ-十二內酯和δ-茉莉內酯)的天然來源、結構、香氣特征及其制備方法進行了綜述,以期為手性內酯類化合物的應用和制備提供理論基礎。
1 手性內酯類化合物的來源
食品中的風味與其原料中內酯類化合物及其前體物質有著密切的聯系,而且內酯類化合物的化學結構決定了它們的香氣特征和化學性質。手性內酯類化合物廣泛存在于自然界中,例如草莓、桃、椰子、杏和茉莉花等,它們作為這些植物吸引捕食者的信號來促進授粉和種子傳播[10-11]。紅葡萄酒中富含(R)-馬索亞內酯,在酒精發酵過程中該芳香內酯被還原為(R)-δ-癸內酯,從而使酒體具有獨特的椰子香和無花果干香[12]。內酯類化合物被認為是桃子果香和甜脂香的主要特征香氣化合物[13-14]。自然界中大多數內酯類化合物具有手性結構,如(S)-δ-癸內酯,天然存在于樹莓中,而(R)-δ-癸內酯則天然存在于桃子、杏、油桃、椰子等[15]中。茉莉花的提取物中只含有(R)-δ-茉莉內酯,而在晚香玉中只合成(S)-δ-茉莉內酯[16]。茶葉中也富含各種手性內酯類化合物,白毫銀針中不僅有(R)-γ-壬內酯,而且也有(S)-γ-壬內酯,白牡丹茶葉中有(R)-δ-辛內酯,壽眉中則富含(R)-δ-辛內酯和(S)-γ-辛內酯[17]。這些內酯類化合物因為手性中心的存在,不同的對映異構體間呈現出不同的香氣特征和程度(感官差異)。以γ-十一內酯為例,(S)-γ-十一內酯具有脂香、醛香,甜的椰子香;(R)-γ-十一內酯則帶有花香、類似于桃子的香氣;(S)-γ-己內酯具有奶油香和木質香;(R)-γ-己內酯具有椰子香和甘草香氣;(S)-γ-辛內酯具有脂類香氣;(R)-γ-辛內酯則帶有杏仁香;(S)-γ-壬內酯具有濃烈的脂類香氣;(R)-γ-壬內酯則帶有霉味[18]。
內酯類化合物在食品中含量低且成分種類繁多,而目前缺少對食品中內酯類化合物手性結構的研究,相關報道仍停留在對其種類和含量的確定分析方面。Niu Yunwei等[19]對浙江奉化玉露桃的香氣物質進行了研究,發現內酯類化合物是其關鍵芳香活性化合物之一,包括γ-己內酯、γ-庚內酯、γ-辛內酯、δ-辛內酯、γ-癸內酯、δ-癸內酯、δ-十二內酯,其中γ-癸內酯(含量為618.53 μg/kg)和δ-癸內酯(含量為4 979.86 μg/kg)的氣味活性值(odor activity value,OVA)最高,分別為61.9和49.8。Zhu Jiancai等[13]在5 種不同品種的桃子中也發現了相似的結果。Yoshinaga等[20]比較了黃油和人造黃油的內酯種類,發現γ-十二內酯、δ-癸內酯、δ-十二內酯、δ-十四內酯和δ-十六內酯是黃油的主要內酯類化合物,而人造黃油中主要的內酯為δ-癸內酯和δ-十二內酯。Chen Chen等[21]發現內酯類化合物對用牛乳制備而成的切達爾奶酪的整體風味具有重要的貢獻,主要的芳香活性物質為γ-辛內酯、γ-十一內酯、γ-十二內酯、δ-辛內酯、δ-癸內酯和δ-十二內酯。γ-辛內酯在水中的香氣閾值為6.5~24.0 μg/mL[22],而在切達爾奶酪中的質量濃度可達到130.0~170.0 μg/mL[23],遠高于其香氣閾值。δ-十二內酯的在水中的香氣閾值極低,僅為0.46~53.00 μg/mL[22],但在切達奶酪中質量濃度可高達19.37~396.26 μg/mL[24]。Haase等[25]對4 種不同產地的新鮮可可果肉中的芳香活性化合物進行了定性分析,發現在測定的65 種芳香活性化合物中內酯類化合物是一類重要的香氣物質,包括γ-辛內酯、γ-壬內酯、δ-壬內酯、γ-癸內酯、δ-癸內酯、γ-十二內酯、δ-十二內酯。風味稀釋因子(flavor dilution factor,FD)越高,在食品中的風味貢獻程度越大。以可可果肉為例,內酯類化合物是其中風味貢獻程度最大的芳香化合物,隨著產地的不同,其內酯類化合物的貢獻度也不同。產自印尼和越南的可可果肉中具有焦糖味和花香味的γ-十二內酯的風味貢獻最大,而產自喀麥隆和尼加拉瓜的可可果肉中具有椰子香味的δ-癸內酯的風味貢獻最大[25]。除了果肉,一些果核中的種子也富含內酯類化合物,例如,γ-己內酯和γ-壬內酯是櫻桃籽重要的香味賦予物。當經過烘烤后,櫻桃籽中γ-己內酯和γ-壬內酯的質量分數從2.14%和0.88%分別增加到6.58%和4.20%,這與烘烤脫水增強了一些羥基脂肪酸的分子內酯化有關,從而使風味更佳[26]。γ-丁內酯也是鳳凰單叢茶中主要的揮發性成分之一,具有玉蘭香[27]。
除了植物,手性內酯類化合物也存在于其他生物體內,如霉菌、酵母和動物[8,28]。Li Guang等[29]對北美豪豬下背部脂質涂層中的揮發性化合物進行測定,發現具有豪豬氣味特征的異構體為(R)-δ-癸內酯,并認為這種內酯化合物的生物學功能是作為一種警告氣味,使捕食者產生厭惡感。?mura等[30]也證實了雄性成年蝴蝶散發出的特殊氣味是(R)-δ癸內酯。目前,已被報道的能夠在體內自身從頭合成內酯類化合物的微生物有絲狀真菌梨孢鐮孢菌(Fusarium poae)[31]、綠色木霉菌(Tr i c h o d e r m a v i r i d e)[32]、棉阿舒囊霉(Ashbya gossypii)[33]以及酵母臭孢子酵母(Sporobolomyces odorus)[34]。例如,Sarris等[31]使用麥芽肉湯培養基培養絲狀真菌梨孢鐮孢菌(Fusarium poae)時檢測到培養基中含有8 種飽和γ-內酯(γ-戊內酯、γ-己內酯、γ-庚內酯、γ-辛內酯、γ-壬內酯、γ-癸內酯、γ-十一內酯和γ-十二內酯)、一種不飽和γ-內酯(順-6-γ-十二烯內酯)和一種δ-內酯(δ-癸內酯)。未來需提高對食品和微生物中內酯類化合物的構型研究,通過生物法制備手性內酯類化合物,從而根據需求添加不同構型的香精,設計出感官特性更合理的食品。
表1總結了幾種典型的手性內酯類化合物的化學結構、來源及其香氣特征。

表1 幾種典型的手性內酯類化合物Table 1 Several typical chiral lactone compounds
2 不同手性內酯類香料的制備
目前內酯類化合物的制備方法主要分為天然提取法、化學法和生物法。天然提取法主要是直接提取植物中的內酯類化合物,常用的方法為有機溶劑萃取法、壓榨法、水蒸氣蒸餾法和超臨界二氧化碳萃取法等[18]。天然提取法的內酯類化合物香氣雖更自然宜人,但由于天然存在的內酯類化合物含量少且提取成本高,難以滿足日益增長的市場需求[35-36]。目前,內酯類化合物的制備以化學法合成為主,如化學合成的γ-癸內酯占據了90%的市場。然而,化學法合成的內酯類化合物多數為外消旋混合物,產物香味單一,且在合成過程中涉及大量有機溶劑的使用,容易造成有機溶劑殘留[37]。而生物法合成可以避免化學法合成的缺點。生物法合成是指外源性化學物經過酶或微生物催化轉化后化學結構發生改變的過程。已有研究表明,以羥基脂肪酸、非羥基脂肪酸和脂肪酸酯等為底物,經過微生物或酶催化轉化可制備手性內酯類化合物[38-39]。利用生物技術制備的內酯類化合物與來源于植物的類似,也具有光學活性,被認為是天然同等香料,因此,采用生物法制備手性內酯類化合物具有更廣闊的應用前景。
2.1 γ-內酯類化合物
γ-內酯類化合物是一類重要的呈香化合物,具有桃子、椰子等濃郁的水果香。此外,γ-內酯類化合物還具有抗菌、消炎等生物活性。例如,經過修飾的α-亞甲基-γ-內酯具有良好的抗菌活性,研究證實其對細菌(金黃色葡萄球菌、大腸桿菌和熒光假單胞菌)和真菌(釀酒酵母和黑曲霉)的生長均有抑制作用[40]。Eltom等[5]發現從鴕鳥油中分離得的γ-內酯(1.1 mg/kgmb,灌胃)能夠減輕福爾馬林誘導的大鼠足腫脹,且治療效果優于對照藥物雙氯芬酸凝膠和布洛芬乳劑。因具有增香的作用和多種生物活性,γ-內酯類化合物已被廣泛應用于食用香精、日化用品和醫藥領域中,如γ-戊內酯、γ-己內酯、γ-癸內酯和γ-十二內酯。
2.1.1γ-戊內酯
γ-戊內酯具有香蘭素和椰子香味,主要用以配制桃、椰子、香草等型香精[41]。此外,γ-戊內酯也是一種重要的化學物質,可用于生產液體燃料、精細化學品合成的中間體和香精香料等[42]。(S)-γ-戊內酯香氣弱,而(R)-γ-戊內酯則呈現出甜香和椰子香[18]。目前γ-戊內酯的合成以化學法合成為主,該方法是以乙酰丙酸(levulinic acid,LA)或乙酰丙酸烷基酯(alkyl latinate,AL)為底物經過催化氫化制備(圖1),但γ-戊內酯的大規模合成受到LA和AL原料供應的限制。研究表明,LA和AL可以從碳水化合物或木質纖維素在酸性催化劑存在下經過在水或醇中水解或醇解得到,這使得γ-戊內酯的大規模生產變得更可持續性和更經濟[43]。Qi Long等[44]利用果糖作為底物,先將果糖脫水生成羥甲基糠醛(hydroxy methyl furfural,HMF),然后在硫酸催化下將HMF復水生成LA,再利用進一步還原制備γ-戊內酯。類似地,以木質纖維素為底物,先將木質纖維素轉化為LA,再一鍋法合成γ-戊內酯,目標產物得率高[45]。與LA相比,AL能更為有效地從碳水化合物的酸催化脫水中制備得到,所以將AL作為底物可以為γ-戊內酯的生產開辟一條更有效的途徑。Tukacs等[46]以乙酰丙酸甲酯(methyl levulinate,ML)和乙酰丙酸乙酯(ethyl levulinate,EL)為底物,通過連續加氫催化生成γ-戊內酯,底物轉化率和時空產率分別為100%和0.45 mol/(g·h)。除了底物,發展新型高效、高選擇性的手性金屬催化劑也是合成手性物質的熱點之一,研究人員對催化劑進行研究以期獲得高穩定性和高催化活性的催化劑,從而實現高效制備γ-戊內酯。李文秀等[47]通過原位熱解策略構建了鈷基催化劑(Co@NC-800),該催化劑可實現LA定向轉化合成γ-戊內酯,且產率達到99%以上。該催化劑還可催化EL轉化制備γ-戊內酯,底物轉化率和產率分別達到100%和97%,并且連續循環使用7 次仍能保持較高的催化性能。Melero等[48]合成Zr-Al-β分子篩為催化劑,以FAL為底物,2-丙醇為氫供體和溶劑,FAL與催化劑的質量比為1.2∶1.0,反應4 h后產率為88%,此外,將分子篩反應結束后經過550 ℃活化后仍可重復利用。Shende等[49]通過使用釕催化劑對LA進行連續氫化得到(R)-γ-戊內酯,轉化率為99%,對映體過量值(enantiomeric excess,ee)為93%。糠醛(furfural,FAL)轉化為γ-戊內酯涉及多步反應,這一系列反應中會使用到大量的酸、醇和金屬催化劑,β沸石分子篩是一種多孔規則結構的高硅沸石,具有良好的酸催化性和結構穩定性[50]。對γ-戊內酯的合成機理深入了解,并設計出更為適合的催化劑是未來研究的突破點,微生物是各種酶的天然且經濟的催化劑來源。
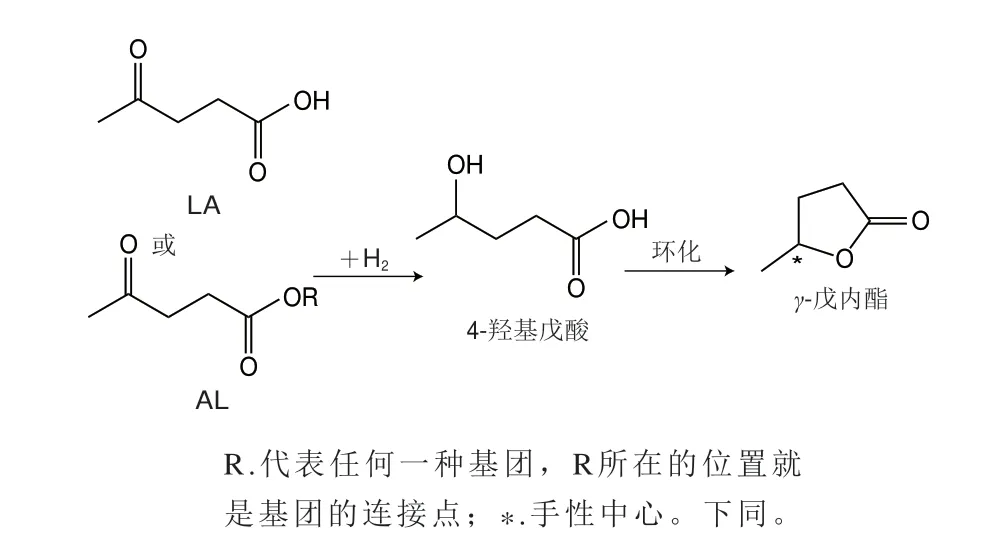
圖1 催化氫化LA制備γ-戊內酯的途徑Fig.1 Preparation of γ-valerolactone by catalytic hydrogenation of LA
目前使用酶參與的化學合成可以克服使用大量化學催化劑的缺點,特別是當需要合成手性γ-戊內酯時。O’Neill等[51]以聚(R)-3-羥基丁酸酯為底物,連續氫化得到(S)-3-羥丁酸乙酯,再利用酵母菌對其進行還原,最后環化為(R)-(+)-γ-戊內酯,總產率為32%。Lee等[52]以LA為底物,使用糞產堿菌(Alcaligenes faecalis)中的3-羥基丁酸脫氫酶對LA進行特異性還原,再使用硫酸將γ-羥基戊酸脫水環化為(R)-γ-γ-戊內酯,產率為100%,ee值>99%,與傳統化學合成方法相比,該法在環化階段采用更低濃度的硫酸(體積分數1%),反應條件更為溫和。G?tz等[53]使用LA在離子交換樹脂上進行酯化,得到EL,再利用近平滑念珠菌(CPCR2)中的(S)-羰基還原酶將EL還原為(S)-γ-羥基戊酸,再使用南極假絲酵母脂肪酶B(Candida antarcticalipase B,CalB)將(S)-γ-羥基戊酸環化為(S)-γ-戊內酯,最終產率為90%,ee值>99%。將酶催化和化學催化相結合,利用兩者的優勢能夠獲得更為理想的結構。
不同構型的γ-戊內酯具有明顯的氣味差異,令人愉悅的香氣閾值非常高,若質量濃度低于10-4mg/L,口感和香氣強度相對于其他γ-內酯來說較差[41]。此外,目前γ-戊內酯的生產工藝仍有局限性,需添加大量的化學催化劑,不符合當下消費者健康消費觀,因此γ-戊內酯更加適合作為生物質基平臺化合物,或作為一種性能優良的溶劑。上述生物技術過程反應條件溫和,故有利于使用微生物和酶,此外,可開發更多適合的底物(類似于一些木質纖維素農業廢棄物),同時,這些生物技術過程可以根據所使用的每種生物催化劑進行優化,為后期實現工業化和產業化生產奠定基礎。
2.1.2γ-己內酯
γ-己內酯化學名稱為5-乙基二氫-2(3H)-呋喃酮、似香豆素,具有獨特的藥草香氣和焦糖香氣,常被添加于酒精飲料、茶飲料、面包、乳制品和黃油等食品中。此外,γ-己內酯也常添加在日化產品中以達到增香的目的[54]。(S)-γ-己內酯具有類似于香豆素的味道,但是(R)-γ-己內酯具有弱的甜香、椰子香和甘草味[18]。
γ-己內酯可從植物中直接提取。de Oliveira Barretto等[55]利用水蒸餾法和過氮氣水蒸餾法結合固相微萃取技術對菠蘿渣中的揮發性化合質量分數物進行提取和表征,發現含有大量的內酯類化合物(質量分數35%),包括γ-丁內酯、γ-己內酯、γ/δ-辛內酯、γ/δ-癸內酯和γ/δ-十二內酯等,其中γ-己內酯在這些內酯類化合物中含量最高,所以菠蘿渣可作為提取γ-己內酯的原料。γ-己內酯也是芒果中重要的香氣揮發物之一。Deshpande等[56]揭示了芒果中內酯類化合物可能的生物合成途徑,發現在果實發育和成熟階段中的9-脂氧合酶(Mi9LOX)、環氧化物水解酶2(MiEH2)、過氧化物酶、過氧化氫裂解酶和酰基輔酶A氧化酶與內酯的合成密切相關。并且將Mi9LOX和MiEH2重組表達于大腸桿菌后,發現Mi9LOX和MiEH2基因的過表達顯著增加了大腸桿菌產γ-己內酯的能力,這為體外γ-己內酯的合成研究奠定了理論基礎。此外,γ-己內酯也可以通過化學法合成:以1,2-環氧丁烷和丙二酸二乙酯鈉鹽為原料,經皂化、酸化和脫羧反應可制備得到[57]。然而,該法中所用原料1,2-環氧丁烷目前依賴于進口,所以利用此方法大規模生產γ-己內酯仍然受到了限制。此外,還可以以丙醛和丙烯酸為原料,經過電解還原、加成以及環化制備γ-己內酯,但該方法的產率僅約為20%,難以實現γ-己內酯的工業化生產。韓巧等[58]以正丁醛和丙二酸為底物,經過縮合重排以及內酯化等步驟制備合成γ-己內酯,產率達到76%。
由于化學合成的γ-己內酯為外消旋體,通過各種拆分的方法制備具有光學活性的γ-己內酯也備受科研人員的關注。目前實現手性化合物拆分的方法有很多種,如化學拆分、色譜拆分、膜拆分和酶法拆分等。與其他的拆分方法相比,酶法拆分手性化合物具有環境友好、操作簡單、副產物少等優勢,常用到拆分的酶為脂肪酶。合成手性γ-己內酯以外消旋體的拆分為主,因為酶無毒且溫和綠色,使用酶催化拆分外消旋體是目前較為理性的選擇。梁甜甜等[59]發現豬胰脂肪酶能夠選擇性地對γ-己內酯進行水解生成(S)-γ-己內酯,其中在最優的反應條件下轉化率可達到46.5%,對映選擇性為76.4%。
2.1.3γ-癸內酯
γ-癸內酯,化學名稱為4-己基丁內酯,天然存在于桃子、杏仁、草莓、蘋果、奶酪和果酒等食品中。由于γ-癸內酯具有濃郁的果香,稀釋時具有桃子香氣[60],因此在調味品和香精香料等領域中應用廣泛。γ-癸內酯是手性分子,不同構型的γ-癸內酯具有不同的香氣特征,如(S)-型γ-癸內酯具有水果香、香蕉香和茉莉花樣的頭香,且香氣更飽滿,甜香和花香較少;而(R)-型γ-癸內酯具有脂香、動物樣的頭香,適用于食用香精[18]。此外,γ-癸內酯在醫藥領域亦有巨大的應用潛力。Pflüger等[61]研究發現,γ-癸內酯可抑制人體中單胺氧化酶-B(帕金森病的藥物治療就包括使用單胺氧化酶-B抑制劑)的活性和降低人肝癌細胞的細胞毒性,且γ-癸內酯不具有遺傳毒性,因此,γ-癸內酯具有治療帕金森疾病的潛力。
目前,市場上90%以上的γ-癸內酯都是通過化學法合成的,應用最為廣泛的是辛醛和丙二酸合成法[54]。該方法是先將辛醛和丙二酸脫水縮合,然后經脫羧以及內酯化制備得到γ-癸內酯,具有工藝簡單、原料易得和產物收率高等優點。然而,化學法合成的γ-癸內酯多為外消旋體,這會影響食品香氣的像真度。因此,研究制備具有高純度光學活性的γ-癸內酯在香料領域具有重要的科學價值。
生物法合成γ-癸內酯可分為生物合成法、生物轉化法和生物催化法。生物合成是指在生物體內所進行同化反應的總稱,包括主要原料的從頭合成和部分分解產物的可逆廢物利用合成。許多研究證實γ-癸內酯是賦予桃強烈果香的最重要內酯類化合物[62-63]。微生物具有從頭合成γ-癸內酯的能力。早在1972年,Tahara等[34]證實了具有特殊香氣的鮭色鎖擲酵母(Sporidiobolus salmonicolor)所產的香味成分為γ-癸內酯和γ-十二內酯。另外,Neuser等[64]在培養擔子菌的發酵液(麥芽-酵母提取液)時也發現了γ-癸內酯的存在。生物轉化法是指外源化合物在微生物體內經代謝通路中各種關鍵酶催化轉化的過程。與能夠從頭生物合成內酯的微生物相比,能夠將脂肪酸轉化為內酯的微生物非常廣泛。因此,生物轉化法是生物法制備γ-癸內酯最為常用的方法,如首選系統解脂耶氏酵母(Yarrowia lipolytica),可利用羥基脂肪酸(如蓖麻油酸)作為前體進行催化轉化制備γ-癸內酯。該方法的代謝機理如圖2所示,蓖麻油酸先轉運到線粒體中,通過線粒體中的4步β-氧化循環后,脫去8 個碳原子,生成4-羥基癸酸,再在脂肪酶等催化下內酯化得到具有高純度光學活性的γ-癸內酯[65-66]。有專利報道了在300 L的發酵罐中使用Y.lipolytica發酵制備的γ-癸內酯質量濃度可高達12.5 g/L[67]。然而,這種生產方法存在局限性,如蓖麻油酸不是一種豐富的可再生的原料,且它的提取還存在若干健康、季節性和經濟問題[68]。為了尋找新的簡單易得和可再生的底物,Soares等[69]探究了Y.lipolytica和Lindnera saturnus酵母菌株利用粗甘油生產γ-癸內酯的能力,發現L.saturnus能利用100 g/L粗甘油產生5.8 g/L的γ-癸內酯。因為粗甘油是生物柴油工業的主要副產品,所以它是一種可持續的生物轉化替代底物。此外,Marella等[70]對Y.lipolytica進行基因改造以期獲得將非羥基脂肪酸轉化為內酯的能力,發現導入來源于嗜麥芽寡養單胞菌(Stenotrophomonas maltophilia)的油酸-10-水合酶基因后,重組Y.lipolytica可以催化轉化油酸制備γ-癸內酯。雖然與傳統的羥基脂肪酸生物轉化過程相比,重組Y.lipolytica生成的內酯濃度較低,但是向更加可持續的內酯生產邁進了一步。另一個需要考慮的重要因素是內酯對微生物的毒性[71]。研究表明,γ-癸內酯的質量濃度高于150 mg/L時會抑制Y.lipolytica的生長,使活細胞去極化并增加細胞膜的流動性[72]。這可能是γ-癸內酯與膜磷脂的酰基鏈疏水相互作用,導致無序程度逐漸增加,從而增加了細胞膜內的整體流動性[73]。為了減輕對酵母細胞的毒性抑制,原位產物分離發酵技術被應用于生物催化轉化制備γ-癸內酯中,即將生成的γ-癸內酯與酵母細胞分離[74]。Rong Shaofeng等[75]探究了樹脂(HZ-816)或環戊硅氧烷(DC345)兩種“液-液”原位分離體系對酵母代謝的影響,發現這兩種原位分離體系均能提高γ-癸內酯的產率(140%和175%),但DC345體系中的產率更高以及對酵母細胞的損傷更小,因此DC345體系具有作為一種生物轉化生產γ-癸內酯新型分離系統的潛力。生物催化是指直接利用酶或生物有機體(包括整個細胞、細胞器、組織等)作為催化劑進行化學轉化的過程。Ren Chunlei等[76]利用基因挖掘技術從釀酒酵母中克隆出羰基還原酶OdCR1基因,并在大腸桿菌中過表達,用于催化4-氧癸酸的不對稱還原。研究結果表明,該基因工程菌對4-氧癸酸具有較高的立體選擇性,可生成(R)-γ-癸內酯(99% ee),產率高達85%。該研究為利用酶催化的選擇性還原酮酸(酯)制備γ-癸內酯提供了新的示例。
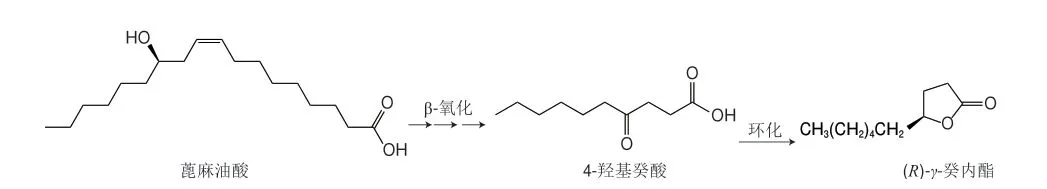
圖2 蓖麻油酸制備(R)-γ-癸內酯的途徑Fig.2 Preparation of (R)-γ-decalactone from ricinoleic acid
2.1.4γ-十二內酯
γ-十二內酯是一種天然的芳香化合物,具有濃郁的桃子味和奶油味,存在于杏、桃子、草莓、菠蘿、芒果、梅子和針葉櫻桃等水果中[77]。(R)-γ-十二內酯具有濃烈的花香,而(S)-γ-十二內酯則具有奶香味和甜脂香[78]。此外,研究表明γ-十二內酯具有良好的消炎作用[79]。
γ-十二內酯由于在植物中的含量少,且不易單獨分離出來,所以目前市場上銷售的仍主要是化學合成的無旋光活性產品。常見制備γ-十二內酯的化學合成方法主要是以正壬醇和丙烯酸(或丙烯酸甲酯)為底物,在引發劑和催化劑作用下經一系列化學反應生成羥基油酸,再環化成γ-十二內酯(圖3)[80]。Matsumoto等[81]對外消旋長鏈1,2-二醇單基酸酯進行酶法拆分并得到(S)-2-乙酰氧癸基甲磺酸酯(收率為94%),再在溴化銅的催化下得到(S)-1-十三烯-5-醇(收率為81%),然后在酸性條件下內酯化合成了(S)-γ-十二內酯(收率為55%)。化學合成法方法由于原料易得、操作簡單、產品收率高而成為研究的熱點。
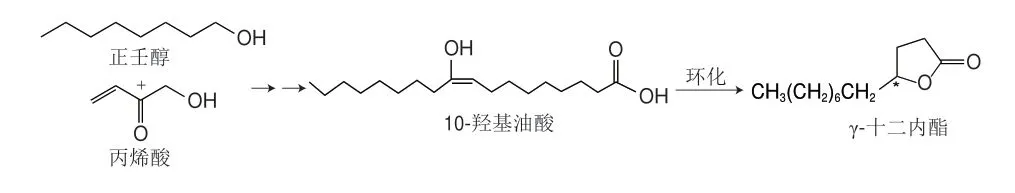
圖3 以正壬醇和丙烯酸為底物產γ-十二內酯Fig.3 Preparation of γ-dodecolactone from n-nonanol and acrylic acid as substrates
目前生物法制備γ-十二內酯主要是通過微生物催化轉化油酸獲得,其生物合成途徑如圖4所示,以油酸為底物,經假單胞菌催化轉化后產生10-羥基油酸,再以分離后的10-羥基油酸為底物,通過畢赤酵母的β-氧化和內酯化反應得到γ-十二內酯[82]。Marella等[70]以商品橄欖油為底物,利用解脂耶氏酵母催化,獲得了質量濃度為(1.62±0.54)mg/L的γ-十二內酯,為以植物油作為底物生產內酯提供了參考。Boratyński等[82]從12 種細菌中篩選出的藤黃微球菌(Micrococcus luteusPCM525)可以以油酸為底物經發酵代謝直接將其轉化為手性γ-十二內酯,轉化率達到50%。這是第一個具有產消炎活性因子細菌的報道。微生物轉化技術的研究為實現從羥基脂肪酸合成手性內酯化合物提供了新的發展方向。
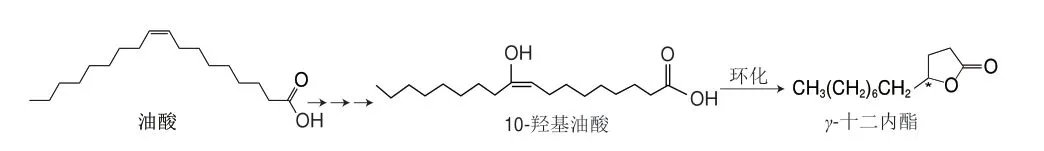
圖4 生物轉化催化油酸產γ-十二內酯Fig.4 Biotransformation of oleic acid to γ-dodecolactone
2.2 δ-內酯類化合物
δ-內酯類化合物在水果和乳制品中廣泛存在,具有椰香、花香、奶香等香味,是一種高價值的香料香精。δ-內酯類化合物被廣泛應用于飲料、雪糕、乳制品等食品中,此外還應用于日化產品中[83]。在食品中常見的手性δ-內酯類化合物主要為δ-癸內酯、δ-茉莉內酯和δ-十二內酯。
2.2.1δ-癸內酯
δ-癸內酯化學名稱為5-戊基戊內酯,廣泛存在于杏、油桃、覆盆子、樹莓、馬鈴薯、切達干酪、羊肉、牛奶及奶制品等食品中[84]。(R)-構型的δ-癸內酯主要在桃和杏中形成,該構型在桃子中的ee值高達96%、在杏中的ee值為90%;而(S)-構型的δ-癸內酯主要存在于樹莓中,其在樹莓中的ee值為94%。此外,牛奶、黃油、切達干酪和椰子中的δ-癸內酯都以不同的對映體存在[85]。不同構型的δ-癸內酯也具有不同的香氣特征,如(S)-(-)-δ-癸內酯具有甜香、水果香、桃子香、脂香和黃油香;(R)-(+)-δ-癸內酯具有甜香、水果香、牛奶香,其花香味比(S)-構型和外消旋體的香味更為強烈、濃郁[18]。δ-癸內酯不僅是一種高價值的香精香料,也可應用于害蟲防治中。有研究表明,δ-癸內酯是驅蚊劑二乙基甲苯酰胺(N,N-diethylmeta-toluamide,DEET)和檸檬桉樹油(p-menthane-3,8-diol,PMD)的潛在替代品[86]。
目前,δ-癸內酯的化學合成主要有2 種途徑:第一種是先合成δ-羥基酸,再經內酯化得到δ-癸內酯[87]。該方法的原料不易獲得且總得率低,難以實現工業化生產;第二種是先合成2-戊基環戊酮中間體,再經Baeyer-Villiger(BV)氧化得到δ-癸內酯[88]。該方法在BV氧化時所使用的催化劑易產生較多副產物,使得率較低。為了開發高效的催化劑,卜佳等[89]以環戊酮和正戊醛為原料經羥醛縮合、脫水和選擇性還原生成2-戊基環戊酮,最后以聚乙二醇-600為催化劑,經BV氧化反應合成δ-癸內酯,產率為86.3%。此外,Alam等[90]提出了一種從廢棄木質纖維素生物質(如甘蔗渣)生產δ-癸內酯的方法,為δ-癸內酯的合成向綠色和可持續方向發展奠定了理論基礎。該方法具體的合成路徑如圖5所示,首先從廢棄的甘蔗渣中發酵產生得到6-戊基-α-吡喃酮(6-amyl-α-pyrone,6PP),再進行氫化得到馬索亞內酯(massoia lactone,ML),再在以甲酸為原位氫源的Pd/C催化劑上連續氫化轉化為δ-癸內酯,其產率達到79%。羥基脂肪酸(hydroxy fatty acids,HFAs)是內酯生物合成的天然前體物質。因此,有必要提出針對HFAs的選擇性合成方法,較為理想的方法是直接通過脂肪酸氧化獲得。如圖6所示,Manning等[91]利用一種來源于Tepidiphilus thermophilus的野生型細胞色素P450單加氧酶(CYP116B46)對癸酸進行羥基化生成(S)-5-羥基癸酸,再通過酸催化內酯化生成(S)-δ-癸內酯,以0.4 mmol/L的癸酸為底物,轉化率為10%,且ee值>90%。
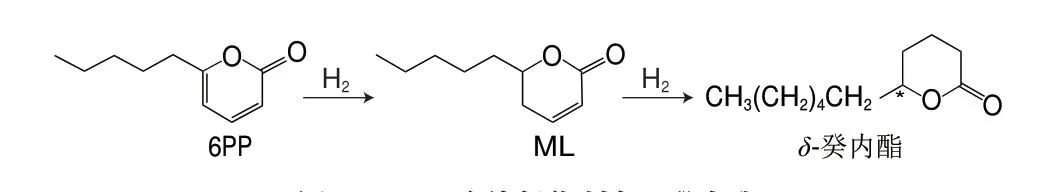
圖5 6PP連續氫化制備δ-癸內酯Fig.5 Preparation of δ-decalactone by continuous hydrogenation of 6PP
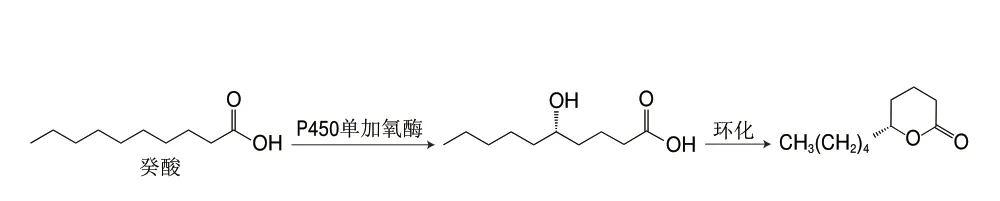
圖6 癸酸轉化制備(S)-δ-癸內酯Fig.6 Conversion of capric acid to (S)-δ-decalactone
以微生物為媒介轉化產δ-癸內酯,常見的是以亞油酸作為底物進行微生物催化轉化制備δ-癸內酯。例如,Kang等[92]以亞油酸為底物,先利用嗜酸乳桿菌中的亞油酸13水合酶將亞油酸轉化為13-羥基9(Z)-十八烯酸,再通過解脂耶氏酵母全細胞催化轉化為δ-癸內酯(圖7),質量濃度為10 g/L亞油酸轉化為1.9 g/Lδ-癸內酯,時空產率為106 mg/(L·h),這為以不飽和脂肪酸為底物生產δ-癸內酯提供了參考。在酶催化制備δ-癸內酯的研究中,Zhang Chao等[93]從粘質沙雷氏菌中克隆出一種羰基還原酶基因(SmCR),并在大腸桿菌中表達,該酶可對γ-和δ-酮酸/酯進行不對稱還原,還原為(R)-羥基酸,再環化為光學純(R)-γ-癸內酯(ee值為99%)和(R)-δ癸內酯(ee值為95%),2 種產物都具有較高的對映選擇性,產率分別為72%和77%,轉化率為98%。Szczepańska等[94]利用烯還原酶(OYE3)還原天然馬尾松內酯產(R)-(+)-δ-癸內酯。為了提高產物的轉化率,該研究者使用細胞固定化技術將細胞裂解物固定在水不溶性載體上進行反應,使底物轉化率提高至99%。自然界中微生物資源豐富,因此酶的種類繁多,經過一定的分離純化技術可實現內酯產業化生產。
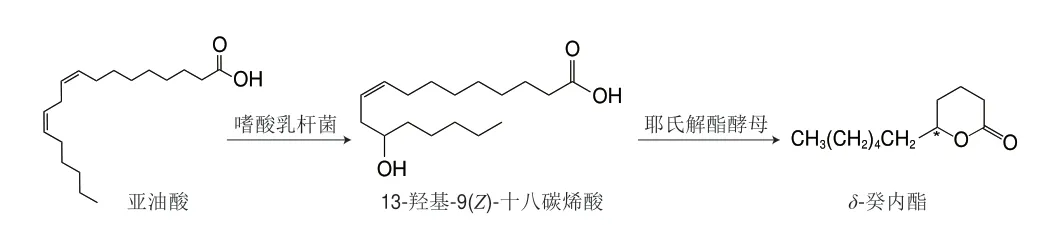
圖7 亞油酸轉化制備δ-癸內酯Fig.7 Conversion of linoleic acid to δ-decalactone
2.2.2δ-十二內酯
δ-十二內酯天然存在于椰子、覆盆子、黑莓和堅果等植物中,具有奶油香味。δ-十二內酯易溶于乙醇、植物油,但不溶于水,所以δ-十二內酯是調配奶油香精的主要成分[95]。除了作為食用香精,δ-十二內酯還具有良好的抗菌活性,可作為治療陰道念球菌病和鵝口瘡的推薦藥物[96]。
目前,化學合成δ-十二內酯最為常見的方法是先合成中間體2-庚基環戊酮,再氧化閉環得到δ-十二內酯。徐俊等[97]以環戊酮和正庚醛為原料,在有機堿催化下得到2-庚烯環戊酮,隨后在雷尼鎳催化下加氫得到2-庚基環戊酮,最后在有機過氧酸的環境下發生BV反應得到δ-十二內酯,產物回收率為55.2%。該合成方法中使用有機堿為催化劑,此催化劑可重復使用,大大降低了成本,且以過氧酸鈉和醋酐為BV反應中的氧化劑,相對于過去使用過氧乙酸為氧化劑更為安全且適合工業化生產。在合成過程中催化劑和氧化劑的選擇尤為重要,國內外眾多學者對此做了大量研究。Ma Qingguo等[98]以錫離子膨潤土為催化劑,再以雙氧水為氧化劑,將中間體2-庚基環戊酮氧化為δ-十二內酯。此外,還發現通過添加微量的甲基磺酸和十二烷基硫酸鈉可以提高中間體的轉化率,最后產物回收率高達81%[98]。
Murray等[99]使用溶劑輔助風味蒸發(solvent-assisted flavor evaporation,SAFE)和香氣提取物稀釋分析(aroma extract dilution analysis,AEDA)法鑒定了真菌斑柄乳牛肝菌(Suillus punctipes)的35 種氣味成分,δ-十二內酯是其中一種主要的香氣化合物。目前生物法制備合成δ-十二內酯以生物催化和生物轉化2 種方式為主,以長鏈脂肪酸或脂肪醇為底物進行羥基化,再使用酸或者內酯酶進行環化。細胞色素P450單加氧酶(P450s)用途廣泛,可催化多種脂肪酸產生芳香化合物,同時該酶還具有高度的區域選擇性和立體選擇性,Maseme等[100]使用細胞色素P450分別對十二酸和1-十二醇進行羥基化。十二酸經羥基化為5-羥基十二酸(24%區域選擇性)再在酸環境下內酯化為δ-十二內酯,1-十二醇轉化為1,5-十二烷二醇(55%區域選擇性)再在乙醇脫氫酶轉化為δ-十二內酯。由于植物油脂富含多種不飽和脂肪酸,且容易進行羥基化反應產HFA,許多研究者多以植物油脂作為底物進行生物轉化制備δ-十二內酯。Zia等[101]以葡萄籽油為底物,利用乳酸乳球菌乳亞種(Lactococcus lactis lactis)和乳酸乳球雙乙酰亞種(Lactococcus lactissub sp.diacetylactis)對其進行轉化制備δ-十二內酯,最終產量為0.046~1.330 mg/L。目前生物轉化δ-十二內酯的方法存在產量低的問題,不利于手性試劑將外消旋體中兩種對映體的拆分,但仍為未來開發以植物油為底物生物轉化產δ-內酯奠定了基礎。以生物法合成手性內酯類化合物主要是以脂肪酸為底物,再通過微生物催化和轉化為手性內酯,其存在一定的缺陷,例如底物需求量大、產量低(轉化率低)、實現分離純化的制備方法較少和可實現手性合成的微生物少等,因此,對于識別其構型有一定的困難。
2.2.3δ-茉莉內酯
δ-茉莉內酯主要存在于茉莉[102]、梔子花、晚香玉、芒果[103]和柑橘[104]等植物中,具有類似于乳、脂肪和蠟的香氣,是國際公認安全的香精香料。(R)-δ-茉莉內酯具有花香和水果香,而(S)-δ-茉莉內酯則具有濃郁的椰子香和木香,類似于奶油味的脂類香氣[18]。
目前,手性δ-茉莉內酯的合成主要是以化學法合成的。例如,Mase等[105]先利用L-蘇氨酸在1,4-二氧己烷中催化環戊酮進行α-羥甲基化作用合成(S)-α-(羥甲基)環戊酮(ee值為82%),再以其為底物,經過間氯過氧苯甲酸選擇性氧化和乙醇鈉處理制備得到δ-茉莉內酯兩種對映體的前體物質(一種二醇類化合物,產率為91%),最后內酯化可分別得到(S)-δ-茉莉內酯和(R)-δ-茉莉內酯。此外,還有學者使用化學拆分法對外消旋化合物直接拆分獲得具有高光學純度的δ-茉莉內酯。例如,Nohira等[106]以(1S,2R)-(+)-氨基-1,2-二苯乙醇作為拆分劑獲得(R)-δ-茉莉內酯(ee值為70%),產率為79.8%。然而,化學拆分法存在化學試劑污染和過程繁瑣等缺點,因此色譜拆分法成為首選方法。孫蕾等[107]使用填充柱超臨界CO2流體色譜拆分外消旋δ-茉莉內酯,經過拆分條件優化后,在320 min內進樣10 mg拆分得到6.6 mg 2 種高光學純度的對映體產物(ee值為100%),回收率為66%,實現了δ-茉莉內酯毫克級別對映體純品的快速制備。
了解內酯對映體的生物合成途徑對于體外利用生物法制備具有高光學純度的手性內酯類化合物是非常重要的。Haffner等[108]利用同位素標記法探究了酵母產δ-茉莉內酯的前體物質,發現手性δ-茉莉內酯的合成前體物質為亞麻酸(linolenic acid,LA)和13-羥基十八三烯酸。Zeng Lanting等[109]通過大腸桿菌表達和分離純化獲得脂氧合酶(CsLOX1)重組蛋白,并證實CsLOX1具有將LA轉化為13-羥基十八三烯酸的能力,這對手性δ-茉莉內酯前體物質羥基脂肪酸的合成有重要的參考價值。
3 結 語
綠色、安全的生物法雖能彌補化學法合成的不足之處,但其制備的香精香料濃度較低,難以滿足產業化需求,仍需進一步的研究和探索。因此,一種能高效制備具有高光學純度內酯類化合物的綠色方法對提高手性內酯類香精產品的品質和推動其廣泛應用有重要意義。盡管化學合成能夠選用更為安全的化學催化劑和酶拆分方法,但化學合成的產品香氣特征不鮮明,且光學純度低。微生物是很好的酶制劑來源之一,因此生物法制備手性內酯類化合物是未來的發展趨勢。此外,隨著對一些植物中的內酯化合物合成機制和信號通路的進一步解析,更有利于合成更加綠色安全的手性內酯類香精。
化學合成手性內酯類香精香料雖然在香精香料領域表現出潛在的應用價值,但是由于手性配體存在對稱性低、不易結晶、產量低的問題,合成和表征手性內酯類香精香料仍然存在很多困難,實現對框架結構的合理設計和精準調控仍然存在很多挑戰。目前,生物法制備手性內酯類化合物實現產業化以合成(R)-γ-癸內酯為主,對于其他構型仍處于研究階段。此外,其他內酯類化合物生物法制備存在產量低、產物種類繁多和難分離等問題。為了實現產業化生產,以大腸桿菌作為工程菌株,通過改造后進行生物轉化,產物γ-內酯和δ-內酯具有高轉化率和高光學純度的優勢,該生產技術將是未來發展趨勢之一。

