FDA胃腸道局部作用復雜仿制藥的等效性評價
魏赫,李曉鋒,李雪梅
(國家藥品監督管理局藥品審評中心,北京 100022)
仿制藥(generic drugs)是指具有與參比藥物(reference listed drugs,RLD)相同的活性成分、劑型、規格、適應證、給藥途徑和用法用量,并證明質量和療效與RLD相同的藥品[1-2]。仿制藥需要進行藥學等效性評價(pharmaceutical equivalence,PE)和生物等效性(bioequivalence,BE)評價,用以證明與參比藥物的治療等效性(therapeutic equivalence,TE)。
復雜仿制藥一般包括具有復雜活性成分的產品,具有復雜劑型或給藥途徑的產品,復雜的藥械組合產品等[3-4]。一般來說,結構相對簡單的小分子藥物比較容易通過藥學質量研究和人體生物等效性試驗進行PE和BE評價,而復雜仿制藥的研發和評價難度較大。對于具有復雜活性成分的一類仿制藥,如合成肽、復雜混合物等,由于其分子結構的復雜性需要進行充分的研究來證明仿制藥與RLD活性成分(active pharmaceutical ingredient,API)的相同性,從而確證PE[5]。
BE是評價藥物是否具有可替換性的重要指標。BE研究方法包括藥代動力學研究、藥效動力學研究、臨床研究和體外研究。以藥代動力學參數為終點的BE研究最為常用,但部分胃腸道局部作用的藥品,未進入血液循環,無法通過藥代動力學終點指標進行BE評價,而以藥效學參數為終點的BE研究和以臨床療效為終點的BE研究則具有較大的變異和較低的靈敏度。近年來隨著監管理念的提升和藥物評價的發展,對于胃腸道局部作用藥物,可根據產品特點、作用機制、體內外相關性等以體外方法來評價BE[6]。
國家衛生健康委聯合國家藥監局和國家知識產權局等部門制定了兩批鼓勵仿制藥品目錄清單,2019年發布的第一批目錄中包括格拉替雷、鹽酸考來維侖復雜仿制藥,但截至目前尚無批準。表1匯總了部分復雜仿制藥中美獲批情況對比,可以看出我國此類藥品的獲批情況與美國有一定的差距,上市時間較早的硫糖鋁則出現了過度仿制的情況[7]。

表1 中美部分復雜仿制藥獲批情況對比
本文主要以胃腸道局部作用的具有復雜活性成分的仿制藥為例,匯總了近年美國食品藥品監督管理局(FDA)發布的具體產品指南,以期為該類藥物的研發和等效性評價提供參考。
1 硫糖鋁
硫糖鋁為抗酸藥(結構示意圖見圖1),用于治療胃、十二指腸潰瘍及胃炎。在酸性環境下,解離出硫酸蔗糖復合離子,復合離子聚合成不溶性的帶負電荷的膠體,能與潰瘍面帶正電荷的蛋白質滲出物相結合,形成一層保護膜覆蓋于潰瘍面,促進潰瘍愈合。還具有吸附胃蛋白酶和膽汁酸的作用。FDA 硫糖鋁口服混懸劑生物等效性研究指南首次發布于2014年,目前現行有效的版本為2023年2月發布[8]。推薦的研究內容包括1項API相同性研究,1項理化特性對比研究和4項生物學測定研究。受試制劑和RLD的Q1和Q2應相同(具有相同的非活性成分,且用量差異在±5%以內),BE應建立在API相同性評估基礎上,并且受試制劑和RLD體外研究具有可比性。
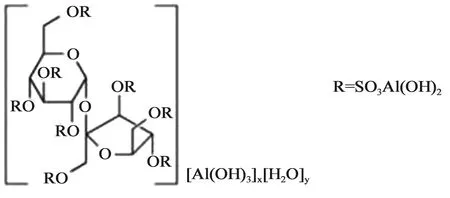
Al8(OH)16(C12H14O35S8)[Al(OH)3]x[H2O]y x=8 to 10,y=22 to 31
1.1 API相同性研究硫糖鋁結構式和分子式如圖1所示。仿制藥申請人應該對受試制劑的API進行表征,并且要證明其組成和分子式與RLD標簽中的結構信息是一致的。結構表征至少采用3批受試制劑,推薦的結構表征包括但不限于:①API的組成:辛硫酸蔗糖和鋁的含量;②元素分析測定 C、H、S、Al的數據,以及C/S比和C/Al比;③酸中和能力;④光譜學表征,例如傅立葉變換紅外光譜(FT-IR)、紫外光譜(UV)、固態27Al核磁共振、差式掃描量熱法(DSC)、熱重量分析法(TGA)、粉末X射線衍射法(PXRD)。
1.2 受試制劑和RLD的理化特性對比理化特性對比包括以下內容:pH,比重,未處理制劑的黏度分布,表觀黏度隨酸度的變化情況,再分散性(再分散的時間、沉降時間和體積),酸中和能力,鋁在pH 1.2介質中的釋放情況。
1.3 受試制劑和RLD的生物學測定在進行生物學測定之前受試制劑和RLD均用酸預處理,如果可能,在與體內生理條件相關的條件下進行試驗。應提供生物學測定的方法開發和方法學驗證資料。
1.3.1 體外膽鹽平衡結合研究該項研究是評估生物等效性的關鍵性研究。應在至少8種不同濃度的膽鹽中進行孵育,濃度應分布合理直到達到最大結合。每項結合研究應至少重復12次。此外,研究數據應該表明選擇的孵育時間長度可以產生最大的結合。生物等效性評價指標為 Langmuir結合常數k2的90%置信區間。
1.3.2 體外膽鹽動力學結合研究該項研究用以支持關鍵性的平衡結合研究。應在2種不同濃度的膽鹽溶液中孵育至少8個不同的時間長度,時間長度應分布合理直到達到最大結合。每項結合研究應至少重復12次。生物等效性評價指標是受試制劑和RLD硫糖鋁與膽鹽結合率的比較。
1.3.3 體外人血白蛋白(HSA)或牛血清白蛋白(BSA)平衡結合研究該項研究試驗設計和數據分析可參考體外膽鹽平衡研究。
1.3.4 體外酶(胃蛋白酶)活性研究該項研究應采用至少5種不同濃度的受試制劑和RLD進行。生物等效性評價指標是受試制劑和RLD關于胃蛋白酶活性降低百分比的比較。
1.4 討論表2為FDA對硫糖鋁產品指南的修訂情況,可以看出近年來FDA對該藥的BE評價觀念逐漸轉變,由體外評價方法替代以臨床終點為指標的評價方法,更加體現科學性,同時也降低了仿制藥企業的研發成本和時間成本。根據硫糖鋁作用機制,設計4種體外研究方法,隨著監管能力的提升,對體外BE研究的要求也越來越趨于完善。

表2 FDA硫糖鋁產品指南修訂情況
2 碳酸司維拉姆
碳酸司維拉姆(結構示意圖見圖2)是丙烯胺化合物的交聯聚合體,用于治療控制正在接受透析治療的慢性腎病成人患者的高磷血癥。口服后在胃腸道內水合膨脹成數倍于原體積的凝膠,胺根以質子化的形式存在,通過離子鍵和氫鍵與磷酸分子相互作用結合消化道中的磷酸根,降低血清中的磷酸根濃度,被聚合物結合的磷酸鹽不能吸收入體內,以糞便方式排出[9]。FDA碳酸司維拉姆片生物等效性研究指南首次發布于2008年,目前現行有效的版本為2015年9月發布[10]。推薦的研究內容包括1項API相同性研究,2項體外研究。
2.1 API相同性研究碳酸司維拉姆結構如圖2所示。API相同性研究通過合成路線以及理化性質對比研究建立。FDA鼓勵申請人采用與參比API相同的合成路線,即聚丙烯胺鹽酸鹽與環氧氯丙烷交聯來生產碳酸司維拉姆,如果采用不同的合成路線,則需要聯系仿制藥辦公室取得同意,并且可能需要指南以外的特性研究來證明API的相同性。申請人應該向監管機構提供生產工藝和工藝過程控制信息。應將至少3批仿制API與至少3批從RLD中提取的API進行背對背比較研究,用以評價API的相同性和生產工藝的穩定性。RLD中API的提取方法應該在申報資料中遞交。推薦的理化性質對比研究內容包括:①交聯度(即交聯氨基與總氨基的比例):建議采用C13固態核磁共振光譜(13C SSNMR),通過定量峰面積分析API的交聯度;②質子化程度(碳酸鹽含量):建議采用TGA;③總可滴定胺:建議采用滴定法;④粒徑分布;⑤元素分析:結果應該包括C、H、N元素;⑥溶脹指數;⑦鼓勵申請人進行更多的理化性質表征研究,包括但不限于FT-IR、拉曼光譜、PXRD和DSC等。
2.2 體外研究
2.2.1 體外平衡結合研究該項研究是評估生物等效性的關鍵性研究。應將受試制劑和RLD整片樣品,在pH 4和pH 7條件下采用酸預處理或不處理的方式,于至少8種不同濃度的磷酸鹽溶液中進行孵育,每種磷酸鹽溶液中應包含80 mmol·L-1的氯化鈉和100 mmol·L-1的N,N-雙(羥乙基)-2-氨基乙磺酸(BES)。磷酸鹽濃度應分布合理直到達到最大結合。試驗應該在37 ℃條件下進行。每一項結合試驗應重復至少12次。此外應提供數據,表明選擇的孵育時間長度可使磷酸鹽產生最大結合。
2.2.2 體外動力學結合研究該項研究用以支持關鍵性的平衡結合研究。應將受試制劑和RLD整片樣品,在pH 4和pH 7條件下采用酸預處理或不處理的方式,于2種不同濃度的磷酸鹽溶液中孵育至少8個不同的時間長度。磷酸鹽的濃度應選擇相應平衡結合研究中的最高和最低濃度。時間長度應分布合理直到達到最大結合。試驗應該在37 ℃條件下進行。每一項結合試驗應重復至少12次。
2.2.3 數據分析檢測濾液中未結合的磷酸鹽,間接計算出與碳酸司維拉姆結合的磷酸鹽量。在體外平衡結合研究中,計算Langmuir結合常數k1和k2,受試制劑與RLD k1比值、k2的90%置信區間。體外動力學結合研究中,比較不同時間受試制劑與RLD的磷酸鹽結合率,但可不計算90%置信區間。生物等效性的評價指標為平衡結合研究中k2的90%置信區間應在80%~120%范圍內。
2.3 討論仿制藥與RLD具有相同的活性成分是研發的第一步,也是能夠發揮相同治療作用的重要前提。碳酸司維拉姆是高度交聯的聚合物,不是單一分子,證明仿制藥與RLD API的相同性較為復雜,不僅需要進行API理化特性對比,更需要從合成路線、工藝控制等方面入手,利用質量源于設計的理念使API的質量從源頭得到保證。體外研究方面,根據隨餐服用的特點,建議在pH 4和pH 7條件下進行磷結合試驗,能夠反映體內生理條件。對于選用的磷酸鹽濃度,孵育時間長度等應進行合理優化,提供確定依據。采用的檢測方法應具有較高的專屬性和靈敏度,并開展完整的方法學驗證[11]。
3 鹽酸考來維侖
鹽酸考來維侖(結構示意圖見圖3)是一種膽汁酸螯合劑,用于治療原發性高脂血癥。非吸收性的聚合物鹽酸考來維侖在腸道中能與膽汁酸結合,阻滯膽汁酸的重吸收,從而加速肝內膽固醇經7-α-羥化酶向膽汁酸的轉化。肝細胞對膽固醇的需求增加,使膽固醇生物合成酶羥甲基戊二酰輔酶A還原酶(HMG-CoA)的轉錄和活性增加,肝臟低密度脂蛋白受體數量增加。這些代償作用導致血液中的低密度脂蛋白膽固醇(LDL-C)清除率增加,從而降低血清LDL-C水平[12]。FDA鹽酸考來維侖口服混懸劑生物等效性研究指南首次發布于2010年,目前現行有效的版本為2021年9月發布[13]。推薦的研究內容包括1項API相同性研究,4項體外研究。

A+a′=2;b=1;c+c′=7;d+d′=6;m=聚合物網狀結構的數量;基本聚合物單元的分子式為(C3H8NCl)2(C9H20N2OCl2)1(C13H28NCl)7(C12H28N2Cl2)6
3.1 API相同性研究鹽酸考來維侖結構如圖3所示。API相同性研究可以通過基本反應方案的相同性、化學結構和組成的相同性、理化性質相同性3方面進行確證。應將至少3批仿制API與至少3批從RLD中提取的API進行背對背比較研究,用以評價API的相同性和生產工藝的穩定性。RLD中API的提取方法應該在申報資料中遞交。
3.1.1 基本反應方案相同性研究FDA建議仿制藥申請人根據RLD標簽信息,采用聚丙烯胺鹽酸鹽與環氧氯丙烷交聯,與1-溴癸烷和(6-溴己基)-三甲基溴化銨烷基化的工藝生產鹽酸考來維侖。如果采用替代合成工藝,應該聯系FDA取得同意,并且可能需要指南以外的表征來證明API的相同性。
3.1.2 化學結構和組成相同性研究仿制藥申請人應定義API的結構,如a + a′,b,c + c′,d + d′的數值等,受試API和參比API應具有相同的化學結構和組成。僅從理化性質表征可能不足以確證API的化學組成,因此建議仿制藥申請人對交聯中間體進行表征,推薦的研究包括13C SSNMR和玻璃化轉變溫度(Tg),具體可參照司維拉姆產品指南;此外,應對烷基化試劑隨反應進行的消耗程度進行研究。
3.1.3 理化性質相同性研究API理化性質相同性研究包括以下內容:①13C SSNMR;②元素分析測定C、H、N、Cl和Br含量;③滴定法測定氯含量,確定質子化程度;④滴定法測定總可滴定胺;⑤滴定法測定溴含量;⑥粒徑分布;⑦溶脹指數;⑧FT-IR和拉曼光譜;⑨DSC法測定玻璃化轉變溫度;⑩TGA。
3.2 體外研究
3.2.1 體外平衡結合研究該項研究是評估生物等效性的關鍵性研究。應將受試制劑和RLD在pH 6.8條件下采用酸預處理或不處理的方式,于至少8種不同濃度的總膽鹽溶液中進行孵育,孵育介質總膽鹽中應含有甘氨膽酸(GCA)、甘氨鵝去氧膽酸(GCDA)和牛磺脫氧膽酸(TDCA)。總膽鹽濃度應分布合理直到達到最大結合。試驗應該在37 ℃條件下進行。每一項結合試驗應重復至少12次。此外應提供數據表明選擇的孵育時間長度可使總膽鹽產生最大結合。
3.2.2 體外動力學結合研究該項研究用以支持關鍵性的平衡結合研究。應將不經酸預處理的受試制劑和RLD,于2種不同濃度(0.3 mmol·L-1和3.0 mmol·L-1)的總膽鹽溶液中孵育至少8個不同的時間長度。時間長度應分布合理直到達到最大結合。試驗應該在37 ℃條件下進行。每一項結合試驗應重復至少12次。
3.2.3 水和飲料條件下的體外平衡結合研究在37 ℃條件下將樣品采用水、3種無糖軟飲、3種弱酸性或中性果汁(葡萄柚汁除外)處理后,離心棄去上清液,然后對樣品酸預處理或不處理,進行平衡結合研究,試驗設計與“3.2.1”項下一致。
3.2.4 水和飲料條件下的體外動力學結合研究在37 ℃條件下將樣品采用水、3種無糖軟飲、3種弱酸性或中性果汁(葡萄柚汁除外)處理后,離心棄去上清液,進行動力學結合研究,試驗設計與“3.2.2”項下一致。
3.2.5 數據分析檢測濾液中未結合的膽鹽,間接計算出與鹽酸考來維侖結合的膽鹽量。體外平衡結合研究及體外動力學結合研究需要進行數據分析的內容,以及生物等效性評價指標與碳酸司維拉姆相同(見“2.2.3”項下)。
3.3 討論FDA鹽酸考來維侖產品指南在2016年以后增加了API相同性研究要求,此前僅有體外結合研究要求。與碳酸司維拉姆類似,需要與從RLD中提取出來的API進行理化特性對比研究,除此之外還建議對交聯中間體進行研究,從工藝過程控制方面對API相同性研究提出了更高的要求,同時也更能保證物質基礎的一致性。鹽酸考來維侖混懸劑可以水、果汁或無糖軟飲送服,因此體外研究較片劑增加了水、3種無糖軟飲、3種弱酸性或中性果汁(葡萄柚汁除外)前處理條件下的體外平衡結合研究和體外動力學研究。模擬臨床應用條件,使得體外研究更加充分。
4 環硅酸鋯鈉
環硅酸鋯鈉(結構示意圖見圖4)用于治療成人高鉀血癥。環硅酸鋯鈉是一種不可吸收的非聚合物無機粉末,具有均勻的微孔結構,優先捕獲鉀,置換出氫和鈉。體外試驗中,即便存在鈣和鎂等其他陽離子,環硅酸鋯鈉仍對鉀離子具有高度選擇性。環硅酸鋯鈉可在整個胃腸道中捕獲鉀離子,并降低胃腸腔中游離鉀的濃度,從而降低血清鉀濃度并促進糞便鉀排泄以緩解高鉀血癥[14]。FDA 環硅酸鋯鈉口服混懸劑生物等效性指南首次發布于2020年,目前現行有效的版本為2021年8月發布[15]。推薦的研究內容包括一項API相同性研究,兩項體外研究。
分子式:Na~1.5H~0.5ZrSi3O9·2-3H2O
4.1 API相同性研究環硅酸鋯鈉的結構如圖4所示。API表征應包括范不限于化學組成、晶體結構、孔徑、粒徑分布、FT-IR、密度、TGA、DSC、鉀交換能力。仿制藥申請人應采用至少3批受試制劑與3批對照藥進行背對背比較研究。
4.2 體外研究
4.2.1 體外平衡結合研究該項研究是評估生物等效性的關鍵性研究。應將受試制劑和RLD在pH 1.2、pH 4.5、pH 6.8條件下,于至少8種不同濃度的鉀鹽溶液中進行孵育。每個研究中應選擇合適的鉀鹽濃度,以描繪吸附曲線,包括最大結合(即達到吸附平臺)。試驗應該在37 ℃條件下進行。每一項結合試驗應重復至少12次。此外應提供數據表明選擇的孵育時間長度能夠滿足吸附平衡條件。
4.2.2 體外動力學結合研究該項研究用以支持關鍵性的平衡結合研究。應將受試制劑和RLD在pH 1.2、pH 4.5、pH 6.8條件下,于至少3種濃度的鉀鹽溶液中孵育,包括平衡結合研究中的最高濃度、最低濃度、中間濃度(約50%最高濃度),每種條件下應該選擇8個時間點直至24 h,包括達到結合平衡的時間,以充分描繪結合率曲線。試驗應該在37 ℃條件下進行,并持續輕微振搖。每一項結合試驗應重復至少12次。
4.2.3 數據分析檢測濾液中未結合的鉀鹽,間接計算出與環硅酸鋯鈉結合的鉀鹽量。體外平衡結合研究及體外動力學結合研究需要進行數據分析的內容,以及生物等效性評價指標與碳酸司維拉姆相同(見“2.2.3”項下)。
4.3 討論環硅酸鋯鈉通過與胃腸道中的鉀結合而局部發揮其作用,不被全身吸收,從而使全身毒性的風險最小化或消除。采用離子阱技術,與現有高鉀血癥治療方案相比,提高了捕獲過量鉀離子的能力、選擇性和速度[16]。具有較明顯的臨床優勢。環硅酸鋯鈉口服混懸劑為2018年FDA批準的新藥,雖然上市時間較短,但推薦的體外BE研究方法已在多種藥物指南中應用,FDA對于此類研究的評價具有較為豐富的經驗。由于數據保護問題,國內外尚無仿制藥上市。
5 總結
不同于一般小分子化合物,復雜仿制藥需要進行API相同性研究,只有在滿足API一致的前提下進行的BE研究才有意義。FDA硫糖鋁產品指南在2019年修訂時增加了API相同性要求,鹽酸考來維侖產品指南在2016年修訂時增加了API相同性要求,2022年發布了仿制藥API相同性評估指南,FDA對API相同性研究的要求越來越明確。國內在此類藥品研發和評價時也應給予足夠重視。不同復雜仿制藥對于API相同性評估的要求不同,根據復雜程度和結構特點等,可能需要從工藝路線和過程控制入手,并采用不同的結構確證分析手段與RLD進行多批次對比研究,使API的相同性得到保證。
對于胃腸道局部作用的藥物,例如表3列舉的11種藥物,與磷酸鹽、鉀鹽、膽鹽等結合形成不溶性復合物隨糞便排出以產生治療效果,體外結合研究可以反映作用機制,已成為FDA比較成熟的體外BE研究方法。本文提及的胃腸道局部作用制劑硫糖鋁,國內仿制藥批準時間均約在2005年以前,推測未采用體外BE研究獲得批準。2020年以后,國內已有采用體外BE試驗獲批的碳酸司維拉姆片,目前仍有多家仿制藥在審。盡管如此,國內制藥企業和監管機構對于此類體外BE研究和評價的經驗仍有限,需要進行更深入的探討,具體案例具體分析,科學地進行更多的探索和實踐。
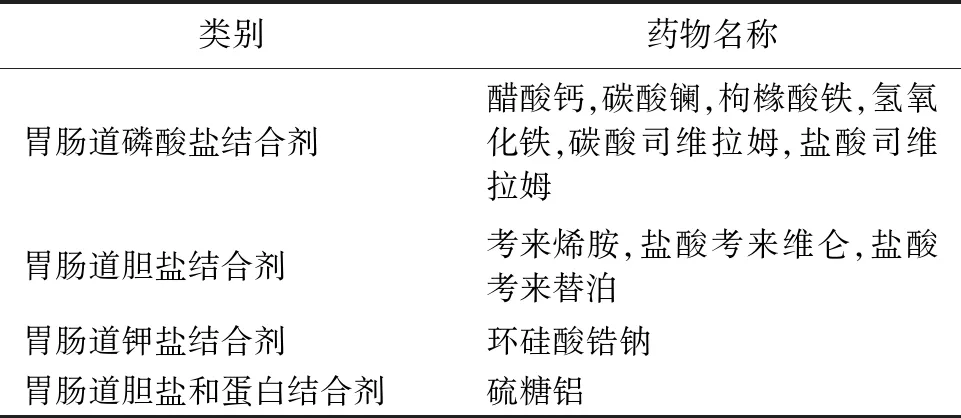
表3 FDA推薦采用體外結合研究的胃腸道局部作用藥物[17]
復雜仿制藥的研發面臨較大的挑戰,一方面由于仿制藥企業缺乏相關經驗,另一方面我國藥品監管機構對復雜仿制藥的研發缺少激勵政策,且相關的技術要求和法規文件等發布滯后,使得國產復雜仿制藥的可及性處于比較被動的狀態。建議相關部門及時發布具有較大臨床價值或專利即將到期等復雜仿制藥清單,并制定和發布與之相應的特定產品指南,加強行業指導,體現科學監管理念;完善注冊申請人與藥品監管機構的溝通交流機制。另外,仿制藥企業應結合市場需求制定合理的開發策略,及時跟進國內外監管機構發布的指南和法規文件,高質量研發,滿足廣大人民群眾的用藥需求。

