腫瘤中干細胞樣T細胞的調控研究進展
陳玉梅,楊勇
(1.中國藥科大學藥物科學研究院,江蘇 南京 211198;2.中國藥科大學基礎醫學與臨床藥學學院,江蘇 南京 211198)
T細胞參與并維持機體免疫反應和免疫記憶的建立,是適應性免疫應答系統中抵御感染和維持內穩態的關鍵成分。T細胞起源于骨髓中的造血干細胞(HSCs),并在胸腺中發育成熟,隨后輸出到外周淋巴器官定居[1-2]。外周中的T細胞由不同發育階段和功能的亞群組成,主要包括初始T細胞(TN)、細胞毒T細胞(CTL)、γδT細胞、輔助T細胞(Th)、調節T細胞(Treg)、效應T細胞(TEFF)和記憶T細胞(TM)等,它們在不斷變化的生理或疾病過程中發揮著不同的作用[3]。近年來,在慢性感染[4]、腫瘤[5]、糖尿病[6]等疾病中報道了一類新型的T細胞亞群——干細胞樣記憶T細胞(stem cell like memory T cells,TSCM),并發現了它在維持T細胞持續應答中的關鍵作用。
TSCM細胞是記憶T細胞早期分化階段的一群異質性細胞亞群,兼有記憶性細胞和干細胞的特點。以往研究發現記憶T細胞自我更新的轉錄本特征與造血干細胞相似[7],從而提出了“記憶干細胞”這一概念。記憶干細胞(即TSCM細胞)首次被發現是在小鼠移植物抗宿主病(GVHD)的研究中[8]。然而,TSCM細胞產生的機制和分化途徑仍有待完全闡明。
TSCM細胞在外周血中的比例很低。Gattinoni等[9]首次通過多色流式細胞術標記出健康人體外周血中的TSCM細胞亞群,約占所有循環CD8+和CD4+T淋巴細胞的2%~3%。而在慢性病毒感染的情況下,TSCMCD8+T細胞僅在淋巴組織中發現,在淋巴結中頻率最高,脾臟中數目最多[4]。近期的一項研究發現,腎癌和其他泌尿系統癌癥患者的腫瘤組織內也檢測到了TSCM細胞,并且這群細胞大多位于腫瘤內抗原提呈細胞生態位(APC niche)中,說明腫瘤內形成的特定生態位可作為免疫生發中心,這對維持TSCM細胞產生持久的免疫治療反應至關重要[5]。
本文綜述了TSCM亞群的分化來源和功能特征,同時關注人體不同生態位中TSCM的作用以及維持T細胞干性的潛在調控機制。基于TSCM細胞自身的自我更新能力、增殖能力和長久的持續性等,有望在癌癥免疫治療中發揮臨床應用價值。
1 TSCM的分化與表型
血液、淋巴和腫瘤組織中存在的記憶T細胞在腫瘤免疫中發揮了重要作用[10]。記憶T細胞群體具有異質性,分為中央記憶(TCM)、效應記憶(TEM)、組織駐留記憶(TRM)和干細胞樣記憶T(TSCM)細胞4個亞群[11]。在抗原依賴途經下人記憶T細胞的發育路徑為TN→TSCM→TCM→TEM。TSCM細胞是TCM細胞和TEM細胞的前體細胞,具有很強的擴增和自我更新能力,并能在體內長時間存活[12]。當機體遇到抗原再次刺激時,TSCM可以迅速分化為TCM和TEM,TEM細胞進一步分化為效應細胞,從而對抗原做出免疫應答。TSCM和TN細胞共有一些表型如CD45RA和CCR7,但它又具有CD95和IL-2Rβ等區別于TN的一些表面標志物。同時它們還高表達趨化因子受體CXCR3和淋巴細胞功能相關抗原LFA-1[9]。隨著記憶T細胞分化程度的增加,與TSCM和TN不同的是,TCM和TEM細胞逐漸丟失CD45RA這一表征幼稚T細胞的標記物,而上調CD45RO分子[13]。TCM與TN細胞相似,仍表達CCR7和CD62L,而分化程度更高的TEM則丟失了這兩個分子[14]。以上幾種記憶T細胞的表型詳見表1。
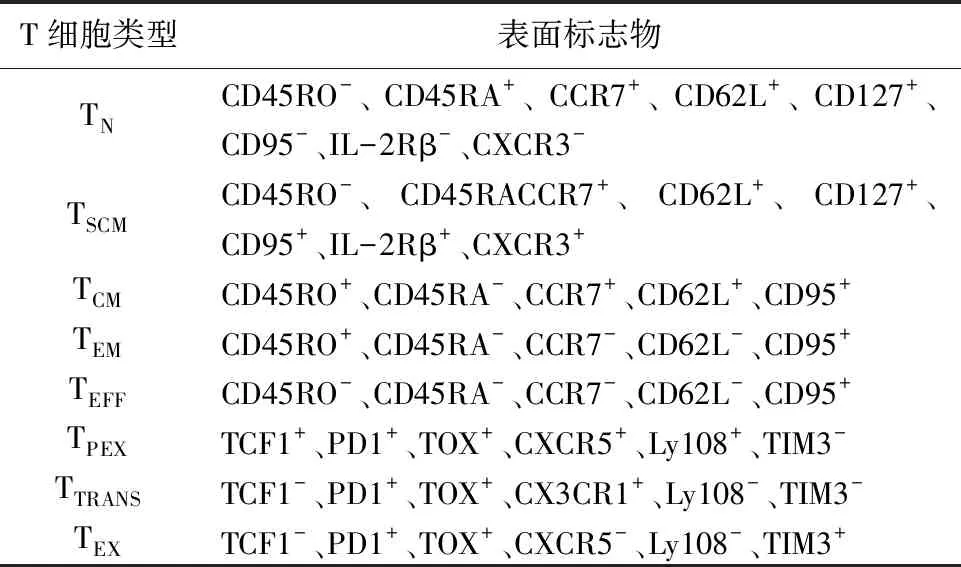
表1 幾種不同的人T細胞亞群及其特征性表面標志物
總之,TSCM是唯一一群具有干細胞特性的記憶細胞,位于T細胞分化層次樹的頂端。研究人員縱向追蹤了接受單倍型造血干細胞移植(HSCT)患者的TSCM動態,檢測到供體來源的TSCM在HSCT后早期高度富集。在抗原特異性、克隆水平和TCR測序多個層面中發現,TSCM細胞可以直接由移植細胞的前體分化而來,并且能夠重建HSCT后的免疫記憶多樣化的分化景觀[15-16]。不僅如此,TSCM細胞還高表達Wnt信號通路相關的基因如Prickl1、Kit、Sox4、Lef1[4],這些基因已知與細胞的自我更新和造血干細胞的維持有關。這些證據共同表明TSCM是直接由TN細胞產生,具有長期的自我更新能力和多能性的干細胞樣T細胞。
然而,在慢性病毒感染以及惡性腫瘤情形下,由于抑制性免疫微環境和持續的抗原刺激,激活后的T細胞通常被認為丟失了記憶分化的潛力,它們只能先分化為耗竭程度較低的耗竭前體細胞(progenitor of exhausted T cells,TPEX)[17]。這些耗竭前體T細胞具有和TSCM細胞類似的增殖和分化潛能,但又與典型的循環TSCM有所不同[18]。TSCM細胞在轉錄因子TOX參與的表觀遺傳調控下分化成為TPEX,繼而分化成短暫性耗竭T細胞(TTRANS),最終產生終末耗竭T細胞(TEX)[17,19]。以上這些發現揭示了TSCM與耗竭T細胞之間的關系,TSCM與幾種耗竭T細胞的表型總結見表1。
2 TSCM群體存在于特定的生態位中
2.1 淋巴結中的TSCM干細胞生態位在調節干細胞命運和組織穩態中起著重要作用。TSCM細胞顯示出對淋巴組織的趨向性,但TSCM細胞生態位的完整解剖特征仍有待解決。生理條件下,骨髓中的生態位能夠維持記憶性T細胞再循環[20],但目前還不清楚骨髓是否起到了支持TSCM細胞的作用。而機體在感染時產生的抗原特異性記憶T細胞大多定居在外周淋巴組織如脾臟和淋巴結中。2016年研究者們相繼發現并鑒定出慢性病毒感染中位于淋巴組織內的具有干細胞潛能的耗竭前體T細胞[17,21]。這群CXCR5+CD8+TSCM細胞主要位于淋巴結的內皮層區(也被稱為T細胞區),而非富含濾泡輔助性T(TFH )細胞和B細胞的外皮層區[4]。同時,內皮層中存在許多基質細胞,如成纖維細胞網狀細胞(FRCs)以及樹突狀細胞(DCs)與TSCM相互作用來維持淋巴結的穩態[22]。腫瘤引流淋巴結(TDLN)是腫瘤特異性T細胞的儲存庫,能夠驅動T細胞不斷浸潤到原發腫瘤中。在多種腫瘤模型中檢測到了TDLN中存在著一群干細胞樣的腫瘤引流淋巴結抗原特異性記憶CD8+T細胞(TDLN-TTSM),這群細胞在腫瘤進展過程中是穩定存在的[23]。研究者通過一系列腫瘤移植實驗和淋巴結切除實驗發現,TDLN-TTSM細胞呈現出顯著優于TPEX及TEX的響應ICB療法和抑制腫瘤的能力[24]。表明TDLN是TSCM細胞的生發中心,在腫瘤發展過程中維持了抗腫瘤T細胞反應持續存在。
2.2 腫瘤微環境中的TSCM近年來,許多研究表明TSCM細胞存在于腫瘤中的三級淋巴結構(tertiary lymphoid structures,TLSs)當中。TLSs是指個體出生后體內形成的位于非淋巴組織的組織性免疫細胞聚集結構。TLSs已在乳腺癌、結腸直腸癌、肺癌、肝細胞癌和胰腺癌等多種癌癥中被發現[25]。在具有豐富TLSs的轉移性黑色素瘤中檢測到了更多的TCF1+T細胞,并與腫瘤的高生存率成正相關[26]。這提示我們腫瘤TLSs的存在與免疫治療后更好的預后相關,可能是其中存在的TCF1+TSCM細胞做出了突出貢獻,但TLSs以及TSCM形成的驅動因素仍不完全清楚。最近有研究發現了腎細胞癌患者中的腫瘤內密集的APC生態位。與TLS不同的是,APC生態位是含有超過5個MHCII+APC細胞的密集小區域。這些區域中同樣分布著腫瘤反應性TCF-1+TSCM細胞,以保留TSCM細胞廣泛浸潤腫瘤的能力[5]。APC生態位結構的存在在控制腫瘤進展方面發揮著關鍵作用,但關于APC生態位構造是否是TLSs形成的早期階段仍然有待研究。
3 TSCM具有強大而持久的抗腫瘤作用
在慢性病毒感染或癌癥中抗原的持續性刺激下,CD8+T細胞會進入一種“耗竭”狀態從而不能有效清除病原體[27]。TEX細胞表面持續表達免疫抑制性分子如PD-1[28],靶向免疫抑制性分子的抗體或小分子抑制劑在治療多種類型的癌癥中取得了成功[29]。遺憾的是,并非所有的腫瘤類型都對PD-1治療敏感,甚至敏感腫瘤類型的患者臨床響應率也不高[30]。因此,提高PD-1阻斷療法的響應人群及臨床治愈潛力亟須對T細胞響應作用機制的更深入理解。
許多研究已經證實,腫瘤中的TEX群體具有異質性,這可能是導致PD-1治療復雜化的一個因素。TEX并不是由末端效應T細胞分化而來,而是由耗竭前體祖細胞(TPEX)分化形成[31]。在持續的激活信號之下,TPEX進一步形成終末耗竭T細胞[32]。終末耗竭T細胞處于功能嚴重失調狀態,并不能對PD-1治療產生應答[33]。相反,TPEX才是響應ICB療法而產生抗腫瘤作用的主要細胞群體[34]。TPEX細胞表現出自我更新以及干細胞樣特性[17],能夠提供長久的免疫應答增強T細胞抗腫瘤效應。然而,TPEX細胞在腫瘤組織中的浸潤數目極低[4],在慢性感染后期其記憶潛能受到很大損害[31]。最新研究表明,響應PD-1免疫檢查點治療的細胞主要來源于腫瘤組織外部新補充的CD8+T細胞克隆[35],受到PD-1阻斷抗體作用而產生爆發增殖的T細胞可能是一種系統性的作用,而不是TME局部性的CD8+T細胞應答[36]。總之,以上研究充分證明了TSCM細胞所具有的強大的抗腫瘤功能,也提示我們靶向、動員腫瘤或引流淋巴結中的TSCM細胞可以充分發揮PD-1療法的抗腫瘤作用。
4 誘導與維持TSCM的調控策略
4.1 細胞因子調控細胞因子作為T細胞功能的重要參與者,在TSCM細胞的維持中發揮著重要作用。細胞因子IL-2 是T細胞的生長因子,對T細胞的增殖至關重要。然而,高水平的IL-2降低了TCM細胞的產生,適當減少IL-2濃度是促進早期記憶T細胞分化的一種方法[37]。研究發現,IL-15可以維持T細胞的記憶特征而抑制分化,使用IL-15和IL-7結合CD3/CD28抗體培養的TN細胞可以分化形成TSCM細胞[38]。在IL-15存在的情況下,T細胞顯示出糖酵解酶表達降低和線粒體適應性增強的干性表型,這是由IL-15介導的mTORC1活性降低造成的[39]。此外,IL-21也能促進TSCM細胞的生成,IL-21誘導產生的TSCM在保留Tcf7、Lef1和CD62L表達的同時能夠維持IL-2。通過激活JAK信號和STAT3磷酸化,從而促進了T-bet的表達同時抑制Eomes和GATA3的表達[40]。IL-10-IL-21-STAT3信號通路對于急性LCMV感染后的記憶性T細胞的發育至關重要[41]。綜上,細胞因子對TSCM細胞的產生具有重要作用,采用恰當的重組細胞因子或抗體組合,可以在一定程度上阻滯T細胞的終末分化從而保證干性細胞的產生,這在T細胞過繼免疫治療中具有實際意義。
4.2 轉錄因子調控TCF1不僅是TSCM細胞的干性標志物,同時是調控T細胞干性的一個關鍵轉錄因子。在慢性病毒感染期間,TCF1缺失導致TPEX細胞的產生缺失[17]。在急性感染期間,抗原特異性CD8+T細胞分化為IL-7RaloKLRG1hi的末端效應細胞和IL-7RahiKLRG1lo的記憶前體細胞。TCF1缺陷小鼠能夠產生正常的效應T細胞反應,但在急性感染高峰時CD8+TM細胞缺失[42];這表明TCF1調控CD8+TM細胞的干性和命運。在機制上,TCF1抑制Blimp1、Tim3同時誘導轉錄抑制因子Bcl6的表達,從而促進了祖細胞的命運。Bcl6在CD4+和CD8+T細胞分化、存活和長期記憶形成中發揮著重要作用[43],TCF1-Bcl6軸的相互作用維持了腫瘤中TSCM細胞的存在[44]。
BACH2是bZip TF家族的一個轉錄抑制因子,參與了病毒感染后CD8+TM細胞的分化。BACH2通過與AP-1蛋白的增強子位點結合,調節AP-1對Jun家族參與的信號調控,從而在一定程度上阻止了TCR信號驅動的終末分化基因的表達,使病毒感染后能夠產生長壽的記憶細胞[45]。單細胞轉錄組學和表觀基因組學分析顯示,BACH2抑制了驅動耗竭的分子程序,建立了TSCM細胞獨特的轉錄和表觀遺傳程序[46]。通過過表達BACH2,促使CD8+T細胞向干細胞命運的分化,從而維持了TSCM細胞強大的抗腫瘤效應。
轉錄因子MYB對TPEX細胞的發育和維持至關重要。在LCMV-Cl13感染小鼠中檢測到,Myb基因在一群CD62L+PD-1+TIM-3loCD8+TPEX細胞中特異性富集,并且PD-1檢查點抑制引起的T細胞增殖爆發幾乎全部來自這群TPEX細胞并依賴于MYB[47]。在機制上,MYB作為Tcf7的轉錄激活因子來增強記憶發育,同時MYB也是Zeb2的抑制因子來阻礙效應器的分化[48]。以上研究充分說明了MYB可能是調控T細胞干性的關鍵性轉錄因子。
綜上,隨著對腫瘤中T細胞分化及耗竭的深入研究,許多參與調控T細胞命運的關鍵轉錄因子逐漸被揭示。抑制T細胞耗竭并維持其干性,對于CD8+T細胞的持續抗腫瘤應答至關重要。通過增強TSCM相關轉錄因子將TEX轉化為再生的TSCM細胞,從而抑制T細胞耗竭,這可能是增強T細胞功能的一條開創性途徑。
4.3 信號通路和代謝調控干細胞需要在自我更新和分化二者之間維持平衡。在這一過程中,許多信號通路參與促進了TSCM細胞的自我更新和分化。STAT3信號在記憶T細胞形成和維持中發揮作用,可能是通過誘導KLF促進細胞靜止和淋巴歸巢分子的表達來限制T細胞分化[49]。近期的許多研究發現了STAT3信號通路可以由一些細胞因子包括IL-6、IL-10和IL-21誘導激活,從而抑制TEFF的分化和衰竭,促進TSCM細胞的生成[41]。YAP是AKT和Hippo通路負調控的轉錄共激活因子,可以通過增強ID蛋白表達促進干細胞的自我更新[50],并通過與轉錄因子TEA結構域的結合,誘導LIF下游的YES-YAP-TEAD2信號響應[51]。YAP亞型的異位表達維持了IL-7Rα+KLRG1-記憶前體T細胞的形成[52],但YAP是否能夠增強干細胞轉錄調控因子的表達還有待進一步研究。
Wnt-β-catenin通路是促進造血干細胞自我更新和多能性的一條信號途徑。Wnt信號通路激活后,下游的β-catenin降解被抑制從而在細胞質中積累,隨后轉移到細胞核中TCF-1/LEF1轉錄因子結合,從而促進TCF-1的表達。研究發現,Wnt-β-catenin通路對記憶CD8+T細胞的形成和長期維持至關重要[53]。使用GSK3β抑制劑觸發Wnt-β-catenin信號激活可以抑制TN向TEFF細胞的分化,同時促進TSCM細胞的產生[54]。
越來越多的證據表明,代謝調控對T細胞分化有著重要影響。與TN、TM細胞類似,TSCM細胞主要依靠脂肪酸氧化(FAO)來滿足其相對較低的能量供應[55]。降低的ATP/AMP比值會激活AMPK并抑制mTOR信號傳導[56]。在TCR活化信號和細胞因子的作用下,PI3K-AKT-mTOR信號通路調控T細胞向有氧糖酵解轉化以支持其增殖和效應功能[57]。使用PI3K、AKT或mTOR的抑制劑都可以增強腫瘤特異性記憶T細胞的擴張,使T細胞向TSCM細胞分化[55,58]。此外,在T細胞激活過程中使用糖酵解抑制劑可以增強TM細胞的生成;體外短暫抑制乳酸脫氫酶(LDH)聯合IL-21促進了TSCM細胞的形成,在過繼細胞治療中產生了更強的抗腫瘤反應[59]。
4.4 表觀遺傳調控在免疫應答過程中,T細胞經歷了顯著的表觀遺傳重編程[60]。DNA甲基化和組蛋白翻譯后修飾這兩種主要的表觀遺傳機制對調節干性CD8+T細胞的分化至關重要。在CD8+T細胞分化過程中,組蛋白修飾的分布和積累發生了漸進式的變化[61]。CD8+TM中記憶相關基因的表達呈現出與H3K4me3水平正相關,與H3K27me3水平負相關的普遍聯系。在小鼠和人類中進行的多項研究中發現,組蛋白修飾參與調控許多干性相關基因(如Tcf7、Sell和Ccr7)的染色質開放性與轉錄活性[60]。組蛋白甲基轉移酶SUV39H1參與H3K9me3的發生,研究發現Suv39h1基因缺失的CD8+T細胞H3K9me3受損,在終末效應細胞分化過程中不能沉默干性基因,從而增強了T細胞干性和記憶重編程能力[62]。PRC2是H3K27甲基化的調控因子,PRC2的一個關鍵催化亞基是EZH2。研究發現在病毒感染期間CD8+T細胞向效應分化過程中,H3K27me3在許多干性和記憶基因上富集。Ezh2的缺失損害了終末效應細胞的分化[63]。
DNA甲基化通常會抑制細胞中的基因表達。通過分析正常和自身免疫反應中的全基因組DNA甲基化,Abdelsamed等[64]建立了人CD8+T細胞分化的全基因組甲基化圖譜,并觀察到DNA甲基化CpG島總數與細胞分化狀態呈負相關:TN>TSCM> TCM>TEM。在記憶CD8+T細胞向效應轉換的過程中,DNA甲基化的重塑在新生效應細胞中不斷活躍發生。具體體現在,TSCM細胞增殖產生TCM和TEM過程中,Ccr7和Tcf7啟動子位點的DNA甲基化增加,同時伴隨著TCF1蛋白表達水平的下降。在1型糖尿病(T1D)患者中,研究人員建立了基于DNA甲基化的T細胞“多能指數”,并發現β細胞特異性CD8+T細胞保留了類似干細胞的表觀遺傳多能性。這項研究開拓了基于甲基化的新型多能性指數在研究CD8+T細胞分化中的應用[65]。
5 靶向TSCM在腫瘤免疫治療中的應用
TSCM細胞因其強大的自我更新、增殖潛力和抗腫瘤能力,已經成為腫瘤免疫治療領域的研究熱點,靶向TSCM為腫瘤免疫治療提供了全新的策略和方案。目前已經有許多TSCM細胞的研究應用到過繼細胞療法(ACT)當中,顯示出長期持久的抗腫瘤治療作用。研究檢測到體外培養的基因編輯TSCM可在體內存活長達12年并具有良好的安全性[66]。在惡性B細胞瘤患者中,CD8+CD45RA+CCR7+TSCM細胞的頻率與CD19+CAR-T細胞回輸后的持續擴增相關[67]。但TSCM細胞在循環血液中的頻率很低,需要通過各種方法誘導其產生以更好地應用于臨床。采用IL-7和IL-15培養人外周血中的TN細胞是產生TSCM細胞的一種方法,可以結合嵌合抗原受體(CAR)編輯、TCR基因編輯來產生病毒特異性或腫瘤特異性的TSCM細胞[68]。一項有關B細胞淋巴瘤的CART臨床試驗(NCT02652910)數據表明,IL-7和IL-15能夠選擇性地擴增出具有不同記憶表型的TSCM細胞。使用CD3/CD28抗體短期激活(2 h)CD30-CAR T細胞后添加IL-7、IL-15和IL-21培養能夠產生更多的CD30-CAR TSCM細胞;接受高比例TSCM細胞治療的小鼠具有顯著的生存優勢[69]。此外,體外重塑CART細胞的代謝表型也是維持TSCM細胞持久性的一條途徑。使用GSK-3β抑制劑TWS119聯合IL-7、IL-21處理CD19 CART細胞,可以將CD8+CD62L+CD45RA+TN細胞誘導為TSCM細胞,這群細胞具有典型的低糖酵解和高備用呼吸能力的代謝特征,在體內表現出強大的代謝適應性和優越的抗腫瘤反應[70],目前相關產品正在進行針對淋巴瘤的臨床Ⅰ期試驗(NCT01087294)。在實體瘤的治療上,使用環磷酰胺結合IL-21誘導TSCM細胞過繼回輸治療黑色素瘤患者初步表現出良好的臨床效果(NCT01106235),但仍需進一步的數據支持。靶向實體瘤的TSCM-CAR-T療法能否成功增加T細胞向腫瘤部位的運輸和浸潤,促進腫瘤中T細胞的增殖,是未來研究領域內極具挑戰性的方向。
6 總結與展望
TSCM細胞具有自我更新和多重分化潛能,同時具有記憶樣特征,以TSCM細胞為主體的免疫治療將是未來癌癥臨床治療的一個新方向。然而,關于TSCM細胞維持其干性表型的分子調控機制仍未完全明晰。TSCM細胞在經過抗PD-1抗體治療后產生的“爆發性”增殖極大程度上促進了T細胞的免疫反應,對ICB療法具有重要意義。因此利用TSCM細胞放大免疫檢查點抑制劑的作用從而增強療效是未來優化ICB療法可行的策略;此外,通過體外誘導和培養以獲得臨床適用的TSCM細胞進行過繼轉移也是未來臨床應用的一個方向,但是如何獲得足夠數量級的TSCM細胞用于患者的治療,同時產生穩定、安全的抗腫瘤作用是一個亟須突破的技術問題。因此,還需要更多的研究來闡明腫瘤微環境及生態位對TSCM細胞的影響,以助于TSCM細胞更好地靶向腫瘤部位來發揮抗腫瘤作用。相信隨著對T細胞分化的深入了解,以及細胞培養、測序技術和基因編輯技術的發展,未來對TSCM細胞的研究將進一步深化。

