血清PG、G-17、IL-10 在不同菌型Hp 感染慢性非萎縮性胃炎中的表達及對預后評估的價值分析
陸瑛 楊曉軍
慢性非萎縮性胃炎為臨床上常見的消化系統疾病,于成年人中發病率高達80%, 患者主要表現為中上腹不適、消化不良等特征, 若未及時得到有效治療, 會出現腸上皮化生、異型增生, 嚴重者甚至會出現胃癌, 威脅患者生命安全。研究數據表明, Hp 感染于胃腸道疾病中發揮關鍵作用, 且Hp 感染率高達30%~50%, Hp抗體主要可分為Ⅰ型與Ⅱ型, 不同菌型Hp 感染會導致不同的疾病發展情況[1]。血清PG 為評估胃黏膜功能的血清學指標, G-17 為胃泌素的主要存在形式, IL-10為人體重要的免疫調節因子, 臨床發現, 慢性非萎縮性胃炎患者的PG、G-17、IL-10 表達水平會隨病情的變化而變化[2]。現階段, 臨床探究血清PG、G-17、IL-10 在不同菌型Hp 感染慢性非萎縮性胃炎中的表達及對預后的評估價值, 基于此, 本文選擇本院2020 年11 月~2022 年1 月164 例Hp 陽性的慢性非萎縮性胃炎患者作為探討對象, 展開以下分析。
1 資料與方法
1.1 一般資料 選擇無錫市錫山人民醫院2020 年11 月~2022 年1 月收治的164 例Hp 陽性的慢性非萎縮性胃炎患者作為研究對象, 其中男89 例、女75 例;年齡38~62 歲, 平均年齡(50.00±5.34)歲, 發病時間12~32 個月, 平均發病時間(22.00±3.43)個月;體質量指數17~24 kg/m2, 平均體質量指數(20.50±1.21)kg/m2;文化程度:初中及以下38 例、高中72 例、大專及以上54 例。
診斷標準:參考《慢性胃炎基層診療指南(實踐版·2019)》[3], 確診為慢性非萎縮性胃炎。納入標準:已明確確診;均Hp 陽性;患者近1 年內未曾進行抗Hp 治療;患者均知曉且自愿參與本次研究。排除標準:慢性萎縮性胃炎;合并胃癌、胃泌素瘤、消化性潰瘍等疾病;肝腎功能不全;嚴重心血管系統疾病史;合并惡性腫瘤疾病;近期服用抑酸劑、糖皮質激素、鉍劑等藥物;具有神經系統疾病或病史;資料不完整;依從性差。
1.2 方法
1.2.1 Hp 抗體分型檢測方法 抽取所有患者4 ml清晨空腹靜脈血, 注入抗凝管, 于常溫環境下靜置2 h, 待其凝固后, 以300 r/min、4℃的條件持續離心處理15 min, 取上層血清, 按照Hp 抗體分型檢測試劑盒(深圳市伯勞特生物制藥有限公司)操作步驟, 以免疫印跡法進行檢測。
結果判讀標準:①細胞毒素相關基因A(CagA)陽性:116KD 位置出現條帶;②空泡細胞毒素A(VacA)陽性:95KD/91KD 位置出現條帶;③尿素酶A(UreA)陽性:30KD 位置出現條帶;④尿素酶B(UreB)陽性:66KD 位置出現條帶。
Hp 感染分型標準:①Ⅰ型Hp 抗體陽性:CagA、VacA 2 條區帶單獨或同時顯現;UreA、UreB 2 條區帶單獨或同時顯現。②Ⅱ型Hp 抗體陽性:UreA、UreB 2 條區帶單獨或同時顯現;未見CagA、VacA。③Hp感染陰性:CagA、VacA、UreA、UreB 抗體均為陰性[4]。
1.2.2 血清學指標檢測方法 抽取所有患者清晨空腹靜脈血3 ml, 以3000 r/min 轉速、7 cm 離心半徑持續離心處理10 min, 選取上層血清, 放置于-20℃冰箱中保存, 以待檢測。采用微孔雙抗體夾心法, 按照PGⅠ定量檢測試劑盒(艾維可生物科技有限公司)操作步驟檢測血清PGⅠ水平, 依據PGⅡ定量檢測試劑盒(上海市瑞番生物科技有限公司), 以微孔雙抗體夾心法檢測血清PGⅡ水平, 計算PGR 值。采用人G-17 定量檢測試劑盒(鎮江博研生物科技有限公司), 按照操作步驟, 以酶聯免疫吸附試驗法(ELISA)檢測血清G-17 水平。采用人IL-10 檢測試劑盒(上海聯邁生物工程有限公司),按照操作步驟, 以ELISA 法檢測血清IL-10 水平。
1.2.3 預后情況 持續對患者隨訪1 年, 統計兩組病情發展情況, 若病情得到有效控制則判定為預后良好,若病情發展為胃癌則判定為預后不良。
1.3 觀察指標 分析Hp 抗體分型檢測結果, 對比不同菌型Hp 感染患者血清PGⅠ、PGⅡ、PGR、G-17、IL-10 水平, 不同預后患者血清PGⅠ、PGⅡ、PGR、G-17、IL-10 水平。
1.4 統計學方法 采用SPSS22.0 統計學軟件進行統計分析。計量資料以均數±標準差(±s)表示, 采用t 檢驗。P<0.05 表示差異具有統計學意義。
2 結果
2.1 Hp 抗體分型檢測結果 164 例慢性非萎縮性胃炎患者中, Ⅰ型Hp 感染125 例, 占比76.22%;Ⅱ型Hp 感染39 例, 占比23.78%。見表1。

表1 Hp 抗體分型檢測結果(n, %, n=164)
2.2 不同菌型Hp 感染患者血清PGⅠ、PGⅡ、PGR水平比較 Ⅱ型Hp 感染患者的PGⅠ、PGR 水平均高于Ⅰ型Hp 感染患者, PGⅡ水平低于Ⅰ型Hp 感染患者,差異有統計學意義(P<0.05)。見表2。
表2 不同菌型Hp 感染患者血清PGⅠ、PGⅡ、PGR 水平比較( ±s)
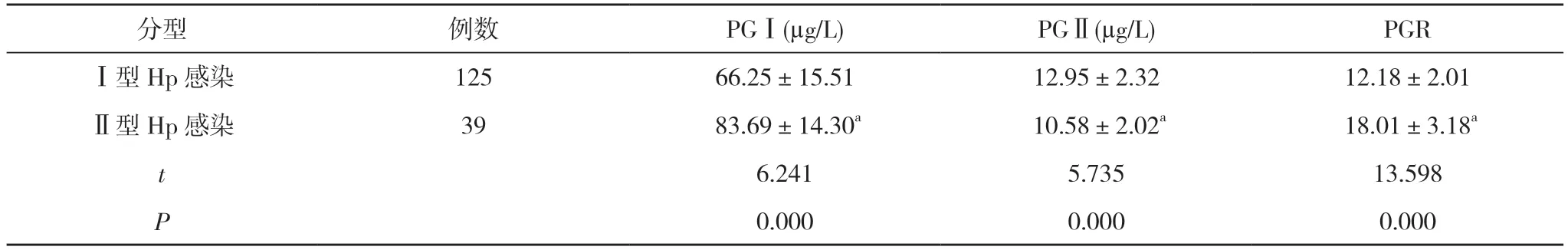
表2 不同菌型Hp 感染患者血清PGⅠ、PGⅡ、PGR 水平比較( ±s)
注:與Ⅰ型Hp 感染比較, aP<0.05
分型 例數 PGⅠ(μg/L) PGⅡ(μg/L) PGRⅠ型Hp 感染 125 66.25±15.51 12.95±2.32 12.18±2.01Ⅱ型Hp 感染 39 83.69±14.30a 10.58±2.02a 18.01±3.18a t 6.241 5.735 13.598 P 0.000 0.000 0.000
2.3 不同菌型Hp 感染患者血清G-17、IL-10 水平比較 Ⅱ型Hp 感染患者IL-10 水平高于Ⅰ型Hp 感染患者, 差異有統計學意義(P<0.05);Ⅰ型、Ⅱ型Hp 感染患者G-17 水平比較, 差異無統計學意義(P>0.05)。見表3。
表3 不同菌型Hp 感染患者血清G-17、IL-10 水平比較( ±s)

表3 不同菌型Hp 感染患者血清G-17、IL-10 水平比較( ±s)
注:與Ⅰ型Hp 感染比較, aP<0.05
分型 例數 G-17(pmol/L) IL-10(pg/ml)Ⅰ型Hp 感染 125 16.58±2.53 35.11±4.23Ⅱ型Hp 感染 39 15.90±3.02 39.54±3.16a t 1.397 6.031 P 0.164 0.000
2.4 不同預后患者血清PGI、PGII、PGR 水平比較持續對患者隨訪1 年, 164 例患者預后良好134 例、預后不良30 例。預后不良患者PGⅠ、PGR 水平低于預后良好患者, PGⅡ水平高于預后良好患者, 差異有統計學意義(P<0.05)。見表4。
表4 不同預后患者血清PGⅠ、PGⅡ、PGR 水平比較( ±s)
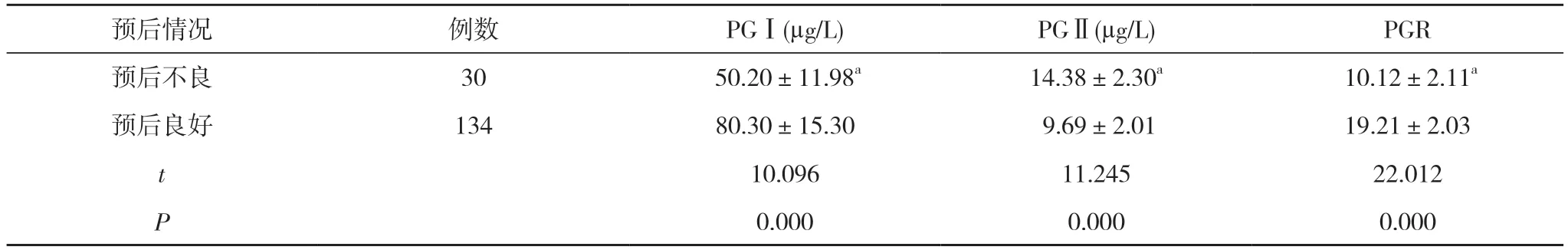
表4 不同預后患者血清PGⅠ、PGⅡ、PGR 水平比較( ±s)
注:與預后良好比較, aP<0.05
預后情況 例數 PGⅠ(μg/L) PGⅡ(μg/L) PGR預后不良 30 50.20±11.98a 14.38±2.30a 10.12±2.11a預后良好 134 80.30±15.30 9.69±2.01 19.21±2.03 t 10.096 11.245 22.012 P 0.000 0.000 0.000
2.5 不同預后患者血清G-17、IL-10 水平比較 預后不良患者G-17、IL-10 水平明顯低于預后良好患者,差異有統計學意義(P<0.05)。見表5。
表5 不同預后患者血清G-17、IL-10 水平比較( ±s)

表5 不同預后患者血清G-17、IL-10 水平比較( ±s)
注:與預后良好比較, aP<0.05
預后情況 例數 G-17(pmol/L) IL-10(pg/ml)預后不良 30 14.92±3.02a 33.10±4.25a預后良好 134 18.60±2.55 40.20±3.18 t 6.901 10.350 P 0.000 0.000
3 討論
近些年來, 隨著人們生活習慣及飲食結構的不斷變化, 慢性非萎縮性胃炎發病率明顯上升, 嚴重降低了我國國民生活質量。目前一致認為, 該病在演變至胃癌的過程中, 胃黏膜經歷了Hp 感染、慢性非萎縮性炎癥、萎縮性炎癥等一系列階段, 而Hp 感染為此病的重要致病因素。Hp 感染可分為不同菌型, 其中Ⅰ型Hp可產生細胞毒素, 毒力較強, 致病性強, Ⅱ型Hp 不產生細胞毒性, 毒力弱, 致病性弱, 因此, 明確慢性非萎縮性胃炎的具體Hp 感染菌型具有必要性[5]。
李清清等[6]報道發現, 170 例Hp 感染消化性潰瘍(PU)患者中, Hp Ⅰ型占比57.06%, Hp Ⅱ型占比15.29%。本文結果顯示, 164 例慢性非萎縮性胃炎患者中, Ⅰ型Hp 感染125 例, 占比76.22%;Ⅱ型Hp 感染39 例, 占比23.78%。這與李清清等[6]研究一致, 提示慢性非萎縮性胃炎患者中主要以Ⅰ型Hp 感染為主, 可能是因為Ⅰ型Hp 為Hp 感染相關性胃炎的優勢菌種,在臨床上更多見。
了解不同菌型Hp 感染慢性非萎縮性胃炎患者的血清相關因子表達情況, 對于監測病情發展情況具有重要意義[7-9]。本文數據顯示, Ⅱ型Hp 感染患者的PGⅠ、PGR 水平均高于Ⅰ型Hp 感染患者, PGⅡ水平低于Ⅰ型Hp 感染患者, 差異有統計學意義(P<0.05)。結果提示, 慢性萎縮性胃炎患者Ⅰ型Hp 感染對胃癌的發生誘導作用更強。主要是因為, Ⅰ型Hp 毒力更強,會加速向萎縮性胃炎、腸上皮化生、胃癌的轉化, 因此, 加強Ⅰ型Hp 根除治療非常重要。本文研究還發現,Ⅱ型Hp 感染患者IL-10 水平高于Ⅰ型Hp 感染患者,差異有統計學意義(P<0.05)。提示Ⅰ型、Ⅱ型Hp 感染均會對胃竇G 細胞分泌功能產生影響, 可能會有胃竇萎縮性炎癥;Ⅰ型Hp 感染的抗炎能力較Ⅱ型Hp 感染更低。
本文研究還發現, 預后不良患者PGⅡ水平高于預后良好患者, PGR、PGⅠ、G-17、IL-10 水平均低于預后良好患者, 差異有統計學意義(P<0.05), 表明該類指標對于評估Hp 感染慢性非萎縮性胃炎患者的預后情況有一定指導意義。分析原因主要是, PG 為胃蛋白酶的前體, 于胃酸作用下會形成胃蛋白酶, 具有水解蛋白質的功能, 可體現胃黏膜功能[10-12]。Hp 感染后,主細胞內磷酸肌醇、環狀核苷酸(cAMP)濃度增加, 從而使主細胞分泌PG 增加, 且PGⅡ水平升高明顯, 使PGR 失調, PGR 明顯下降, 而PGR 降低為胃癌的高危因素之一[13]。G-17 為胃泌素的主要活性成分, 可刺激胃酸及胃蛋白酶分泌, 促使黏膜生長, 調節胃腸功能[14,15]。Hp 帶菌者多會有高胃泌素血癥, 若血清G-17 表達持續降低, 提示胃竇黏膜萎縮, 血清G-17持續降低為胃癌的高危因素[16,17]。IL-10 為機體重要免疫調節因子, 可對Hp 感染過程中促炎因子的合成、活性進行抑制, 與抗炎介質發揮協同作用, 在活動期胃炎的炎癥程度、抗Hp 治療中具有重要作用, 若機體IL-10 水平明顯降低, 提示胃炎炎癥程度有所加重, 為胃癌的高危因素[18,19]。
綜上所述, 慢性非萎縮性胃炎患者中Ⅰ型Hp 感染更多見, Ⅰ型與Ⅱ型Hp 感染患者G-17 水平表達基本一致, 但Ⅰ型Hp感染患者的胃黏膜抗炎免疫機制更低,更易發展為胃癌。PGⅠ、PGR、PGⅡ、G-17、IL-10水平表達情況與患者預后情況有一定關系, 可作為評估患者預后情況的有效指標。

