生鮮乳中優勢嗜冷菌對UHT乳蛋白濃度的影響
王 輝,邵 偉,張少穎,王富蘭,王 帥,武亞婷,范 雪,趙艷坤
(1.新疆農業大學動物科學學院/新疆肉乳用草食動物營養實驗室,烏魯木齊 830052;2.新疆農業科學院農業質量標準與檢測技術研究所/新疆農產品質量安全實驗室,烏魯木齊 830091)
0 引 言
【研究意義】在生鮮乳低溫貯藏過程中,嗜冷菌成為優勢菌,隨貯藏時間的增加而快速生長繁殖,開始代謝產生耐熱的脂肪酶和蛋白酶,這些酶經巴氏殺菌甚至超高溫滅菌后仍能保留一部分活性[1-4],蛋白酶水解乳蛋白將帶來苦味、異味、果味和酵母味[5]等非正常風味,導致生鮮乳和乳制品質量的改變。對解決嗜冷菌分泌的蛋白酶導致UHT乳中蛋白水解而改變產品質量有重要意義。【前人研究進展】嗜冷菌分泌的蛋白酶經巴氏殺菌后都有較強的恢復能力,經77℃/15s加熱處理仍可以保留55%~65%的活性,即使超高溫140℃/5s 處理后,也有一定的活性殘留。恢復活性的蛋白酶殘留在產品中,緩慢作用于牛乳蛋白,分解α-酪蛋白和κ-酪蛋白,失去穩定作用,酪蛋白膠束聚集,輕微的出現少量蛋白質沉淀,嚴重的會導致UHT乳在貯存過程中出現蛋白質凝膠和乳清析出現像[6-7]。【本研究切入點】UHT乳作為眾多乳制品中的重要角色,其貨架期嚴重的受到嗜冷菌的影響。嗜冷菌影響奶制品貨架期,需要分析嗜冷菌影響奶制品品質。【擬解決的關鍵問題】可視鑒定優勢嗜冷菌的產蛋白酶能力,研究BCA蛋白定量與UHT乳樣本稀釋濃度間的最優線性關系,分析嗜冷菌分泌的耐熱蛋白酶引起蛋白水解這一現象與溫度、細菌添加量之間的關系,為延長UHT乳貨架期提供依據。
1 材料與方法
1.1 材 料
嗜冷菌計數平板瓊脂MPC購自北京路橋技術股份有限公司,營養肉湯和磷酸鹽緩沖液(PBS)均購自北京路橋技術股份有限公司,高蛋白脫脂奶粉購自內蒙古伊利實業股份有限公司,UHT乳購自新疆西域春乳業有限責任公司,BCA蛋白定量試劑盒夠自新疆鼎楓生物科技有限公司,磷酸鹽緩沖液(PBS),葡萄糖蛋白胨水均購自北京路橋技術股份有限公司,天根細菌基因組提取試劑盒購自天根生化科技(北京)有限公司。
1.2 方 法
1.2.1 原料乳中嗜冷菌的分離純化
原料乳收集之后需要對其進行酸鹽緩沖液對原料乳進行梯度稀釋,對稀釋后的原料乳進行混培,取1 mL奶樣與9 mLPBS混合震蕩均勻制成10-1梯度稀釋液,每個樣品做原液和10-1至10-5稀釋梯度,每個稀釋梯度吸取1 mL于培養皿中,每個稀釋梯度做兩個平行,將嗜冷菌計數瓊脂培養基冷卻至40℃的嗜冷菌計數瓊脂培養基,緩慢倒入培養皿,充分搖勻、靜置凝固,置于6.5℃培養箱中培養10 d[8]。10 d后將平板取出,仔細觀察其菌種菌落形態、顏色、光滑程度等,并按其菌落形態編號進行嗜冷菌純化保存備用[9]。
1.2.2 嗜冷菌基因組DNA提取與PCR反應
樣品中基因組DNA采用天根細菌基因組試劑盒按照說明書方法提取,以2%瓊脂糖凝膠電泳檢測DNA的完整性、純度、片段大小及濃度[10]。
嗜冷菌16S rDNA序列根據文獻[10]設計合成引物,引物序列選擇嗜冷菌通用引物,引物序列為:16S(F)5′-AGAGTTTGATCMTGGCTCAG-3′;16S(R):5′-CGGYTACCTTGTTACGACTT-3′PCR反應體系:根據文獻報告[11]確定25 μL的PCR最佳反應體系和反應程序。PCR反應體系25 μL:2×Taq·Mix12.5 μL,上、下游引物(10 μmol/mL)各1 μL,模板DNA為2 μL,無菌水為8.5 μL。PCR反應程序:95℃預變性5 min;95℃變性30 s;54℃退火30 s;72℃延伸2 min;循環35次;72℃延伸10 min;冷卻4℃。PCR擴增產物可參考《分子克隆試驗指南(第三版)》[12]使用濃度為2.0%的瓊脂糖凝膠進行電泳檢測。將擴增后的16S rDNA序列送至北京鼎國昌盛生物技術有限責任公司測序。所得擴增序列登陸(www.ncbi.nlm.nih.gov/)應用BLAST程序與數據庫中的已有細菌16S rDNA序列同源相似性分析[13]當待檢菌株的身份鑒定%ID>99代表鑒定結果準確,%ID>90代表同源性較強[14-15]。
1.2.3 脫脂乳平板法鑒定假單胞菌的產蛋白酶能力
3 g脫脂高蛋白奶粉+2.35 g嗜冷菌平板計數瓊脂+100 mL蒸餾水,攪拌均勻,121℃高壓滅菌15 min,冷卻至40℃倒入培養皿,靜置冷卻,制成含3%脫脂高蛋白脫脂奶粉的乳平板。在乳平板中心做一圓孔,圓孔中注入30 μL活化好的菌液,將乳平板21℃培養25 h, 觀察是否形成蛋白水解圈[16]。
1.2.4 BCA蛋白濃度測定標準曲線的制作
通過BCA蛋白試劑盒測定不同嗜冷菌添加量、儲存溫度、時間點的乳蛋白含量,在堿性條件下,蛋白將Cu2+還原為Cu+,Cu+與BCA 試劑形成紫藍色的絡合物,測定其在562 nm 處的吸收值,根據標準曲線,計算消化產物蛋白的濃度。
BCA工作液的配置:將試劑A與試劑B按照體積比50∶1比例混合,配成BCA工作液。如:50 mL試劑A與1 mL試劑B混合,配制成51 mL BCA工作液。
(1)將總體積為20 μL的待測樣品注入到96孔酶標板中,每樣3份。向微孔板中加入200 μL BCA工作液,混勻,37℃放置30 min。
(2)測定562 nm處的吸光值,并記錄讀數。以不含標準溶液的樣品吸光值作為空白對照。
(3)以A562吸光值為縱坐標,樣品含量作為橫坐標,繪制標準曲線。表1
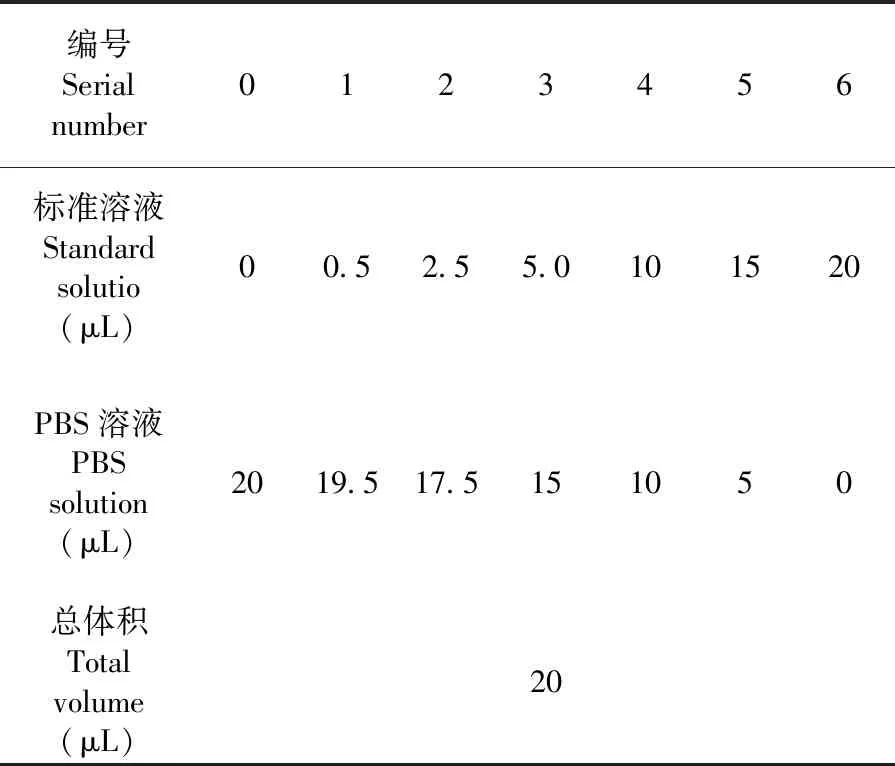
表1 標準曲線制作
1.2.5 不同稀釋倍數的UHT乳在蛋白濃度測定試驗中的線性關系
設計UHT乳稀釋PBS磷酸緩沖液中的稀釋倍數為8、12、16、20、24、28倍,制作線性關系圖。
1.2.6 UHT乳中蛋白濃度變化與嗜冷菌添加量和儲存溫度的關系
選擇同一批次的UHT乳為基礎液態奶。
將產蛋白酶能力最強菌株的磁珠復活在嗜冷菌平板計數瓊脂上21℃恒溫培養25 h,用PBS緩沖液沖洗培養皿上的菌落,將菌液轉至空無菌玻璃管中,將菌液調至酶標儀450 nm波長下吸光值為0.5,將菌量調整為103、104、105CFU/mL。
取200 mL UHT乳加入無菌錐形瓶共計9瓶,共分為3組,每組3瓶,每組分別接入103、104、105CFU/mL的菌液1 mL。放入不同溫度下4、7及21℃培養168 h(7 d),每隔24 h取樣測定1次,測定樣品中蛋白濃度。
1.2.7 假單胞菌胞外蛋白酶對UHT乳中蛋白質的影響
取15 mL UHT乳于無菌瓶中,共3份,每份添加1 mL 105CFU/mL的菌液后密封,置于21℃的恒溫箱中,培養7 d后,除去上層乳樣,留沉淀部分。
2 結果與分析
2.1 嗜冷菌篩選及鑒定結果
研究表明,經過培養、純化,在33份生鮮乳樣品中,篩選出212株嗜冷菌,其中11株菌所占比例較大,確定為優勢嗜冷菌。圖1
圖1 嗜冷菌PCR鑒定的凝膠電泳圖譜
2.2 假單胞菌產蛋白酶能力脫脂乳平板法鑒定
研究表明,透明圈的大小反應了菌株分泌胞外蛋白酶的能力。其中99號菌的產蛋白能力最強,其次是93號菌和36號菌,最后為6號菌產蛋白酶的能力最弱,其余菌株產蛋白酶能力極弱,選擇產酶能力最強的99號菌株做為原料乳中具有的代表性的優勢嗜冷菌進行后續試驗。測序后所得到的基因序列通過BLAST數據庫比對并建系統發育樹,99號菌株與假單胞菌同源性達到100%,確定99號菌株為假單胞菌。圖2,圖3,表2

圖2 乳平板鑒定結果

圖3 進化樹構建結果
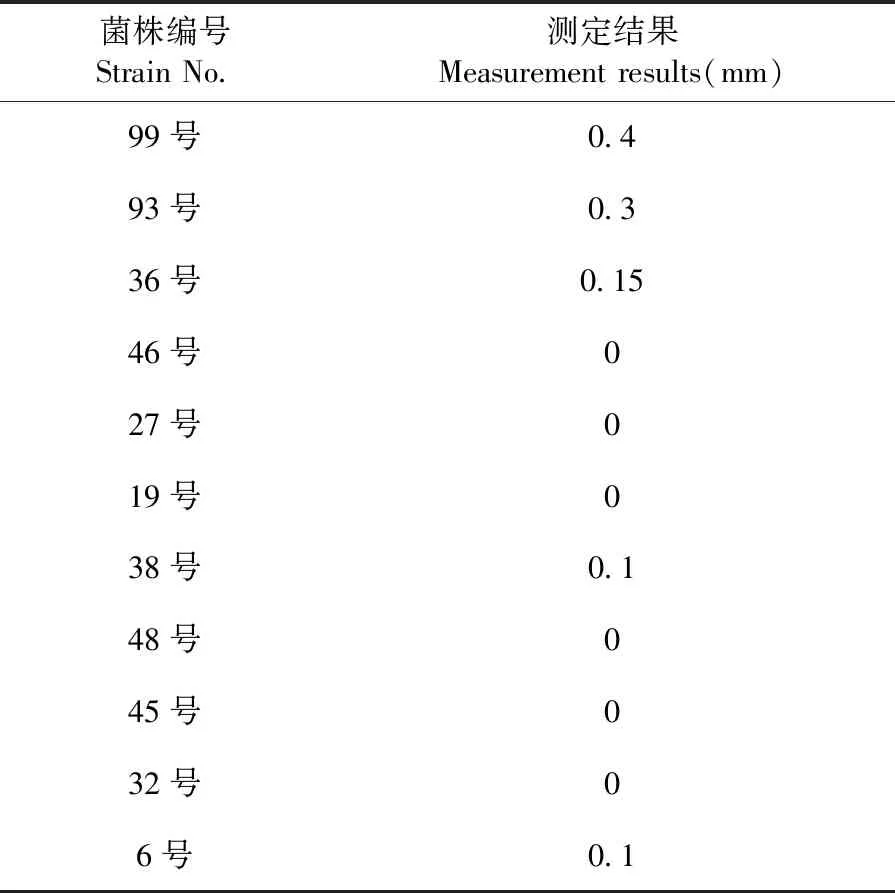
表2 乳平板鑒定結果
2.3 BCA蛋白濃度測定標準曲線結果
研究表明,標準曲線線性關系良好,相關系數R2達到0.993 3。圖4

圖4 蛋白濃度測定標準曲線
2.4 UHT乳不同稀釋倍數對蛋白濃度測定影響
研究表明,UHT乳在28倍稀釋濃度下,相關系數R2達到了0.998,線性關系最好,后續蛋白濃度測定試驗均采用經過稀釋28倍的UHT乳。圖5~10
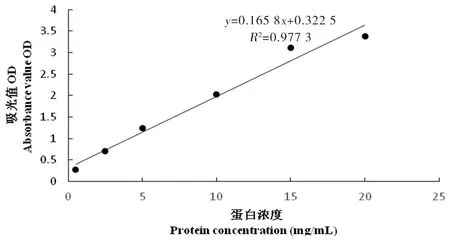
圖5 8倍稀釋濃度標準曲線
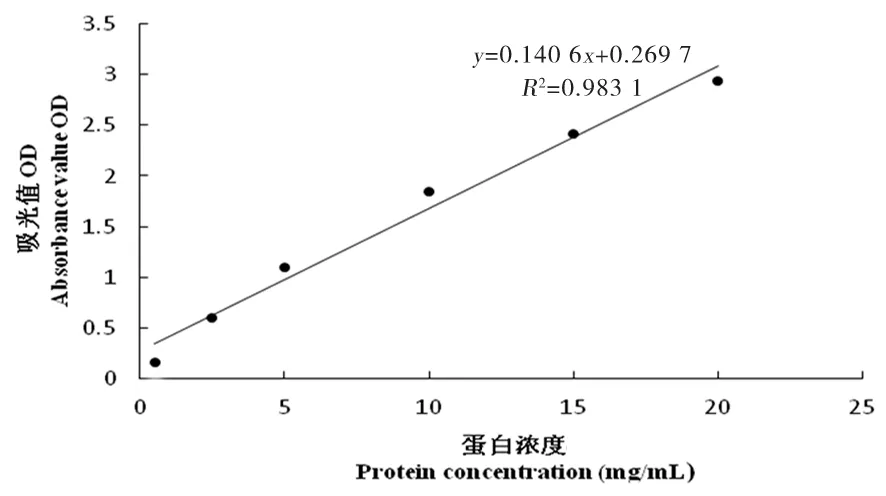
圖6 12倍稀釋濃度標準曲線
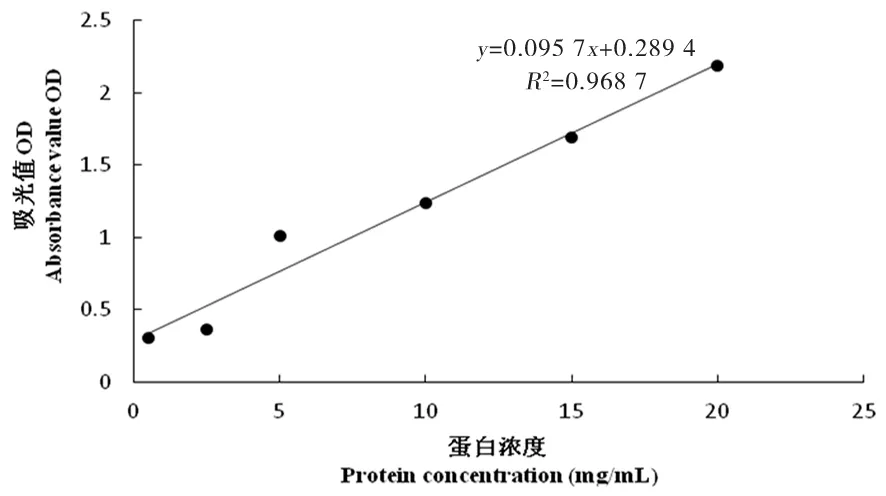
圖7 16倍稀釋濃度標準曲線
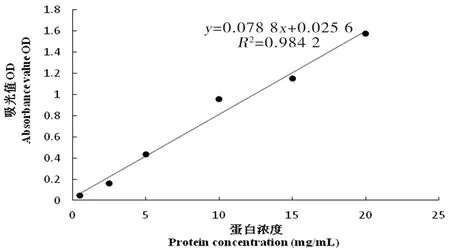
圖9 24倍稀釋濃度標準曲線

圖10 28倍稀釋濃度標準曲線
2.5 蛋白濃度與儲存溫度和接菌量的關系
研究表明,細菌添加量為103CFU/mL的試驗組在第7 d時,21℃條件下蛋白濃度0.136 mg/mL度顯著(P<0.05)低于7℃條件下的蛋白濃度0.143 mg/mL,4℃試驗組隨著時間的推移蛋白濃度的變化差異不顯著(P>0.05)。當樣品乳添加菌量為104CFU/mL時,7℃蛋白濃度在第6 d出現顯著(P<0.05)下降,蛋白濃度為0.143 mg/mL,在第7 d為最低值0.141 mg/mL;21℃時蛋白濃度在第3 d開始顯著(P<0.05)下降,在第5 d時蛋白總濃度極顯著(P<0.01)下降,并在第7 d達到最低值0.137 mg/mL。當樣品乳菌液濃度為105CFU/mL在21℃條件下儲存第7 d時,蛋白濃度在所有試驗組中達到最低值0.128 mg/mL,蛋白濃度極顯著(P<0.01)低于103CFU/mL試驗組在相同條件下的蛋白濃度0.136 mg/mL。圖11~13

注:按蛋白濃度由高到低a、b、c、d、e(P<0.05),按順序排序,字母相同為不顯著(P>0.05),大寫字母為極顯著(P<0.01)。下同
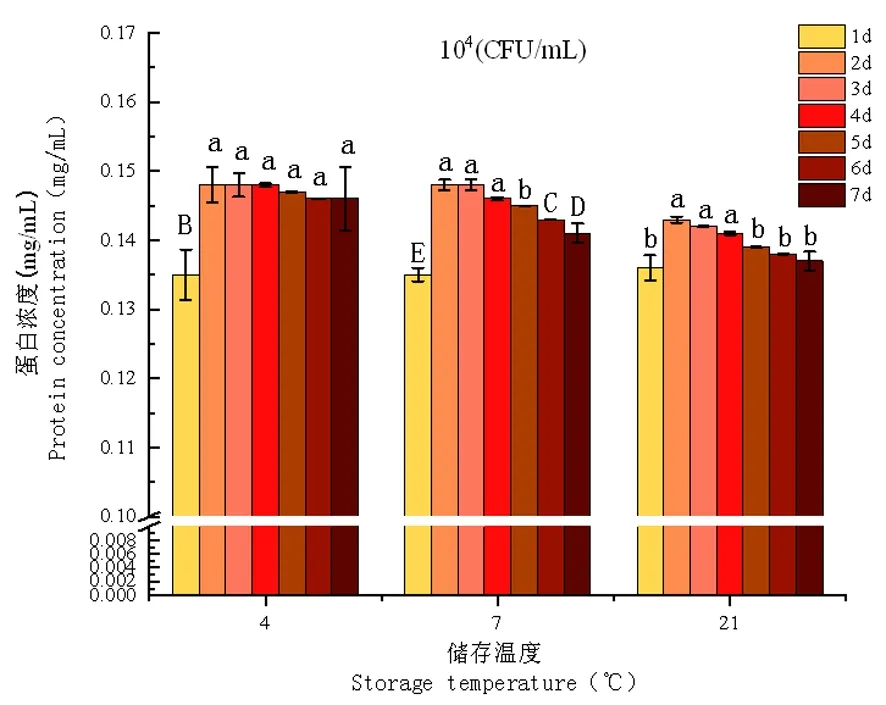
圖12 104CFU/mL接菌量下UHT乳蛋白濃度變化

圖13 105CFU/mL接菌量下UHT乳蛋白濃度變化
2.6 樣品在不同條件下蛋白濃度的顯著性
研究表明,4℃條件儲存下,添加菌量為103、104、105CFU/mL的試驗組蛋白濃度變化差異均無顯著性(P>0.05);添菌量在103CFU/mL時,21℃試驗組的蛋白濃變化差異度極顯著(P<0.01);在添菌量在104CFU/mL時,7℃和21℃試驗組的蛋白濃度變化差異顯著(P<0.05);在添菌量在105CFU/mL時,21℃試驗組蛋白濃度變化差異極顯著(P<0.01)。
2.7 假單胞菌胞外蛋白酶導致的UHT乳中蛋白質沉淀
研究表明,假單胞菌蛋白酶水解了酪蛋白膠粒外層的κ-casein后,蛋白膠粒的穩定性遭到破壞,造成牛奶在貯存過程中出現沉淀、凝膠、蛋白水解等,縮短牛奶的貨架期。添加1 mL含105CFU/mL假單胞菌菌液的UHT乳在21℃的恒溫箱中培養7 d后,UHT乳出現了明顯蛋白沉淀。圖14

圖14 胞外蛋白酶導致的乳蛋白沉淀變化
3 討 論
3.1生鮮乳作為嗜冷的優良培養基,在低溫下得益于生鮮乳的營養成分可迅速繁殖[11],其代謝產生的耐熱蛋白酶,破壞乳中營養成分,改變蛋白質結構使結構發生變性[4]。
結合16Sr DNA序列同源性分析鑒定出嗜冷菌212株,其中11株假單胞菌為優勢嗜冷菌,此前報道的假單胞菌是對乳制品品質影響最主要的因素[17-18]與試驗結果一致。
嗜冷菌菌株之間產蛋白酶能力有所不同,為保證試驗的可靠性與準確性,試驗采用乳平板可視鑒定法鑒定出產蛋白酶能力最強的菌株為99號菌株假單胞菌,其產生的耐熱蛋白酶可分解培養基中的蛋白質,出現明顯的水解圈,魏超[19]等研究結果與試驗結果相符。
儲存溫度升高時,乳樣品內的蛋白濃度相應的降低[20]。試驗中,添加菌量為103、104和105CFU/mL的試驗組,均在儲存溫度為21℃時達到蛋白總量最低值,與相關文獻[21-23]報道相一致。
3.2試驗添加嗜冷菌模擬被污染的生鮮乳,隨著添菌量的加大和時間的延長,添加菌量為105CFU/mL試驗組在第7 d時,最低蛋白濃度為0.128 mg/mL,極顯著(P<0.01)低于103CFU/mL試驗組的第7 d蛋白濃度0.136 mg/mL,與王嬌等[24-25]通過在滅菌原料乳中接入經篩選得到的優勢嗜冷菌菌株,檢測得到隨著反應時間的增加,得到乳中蛋白濃度明顯降低的結果與試驗得到結論一致。
3.3生鮮乳中的嗜冷菌來源主要是因其生產環節的污染導致生鮮乳在運送的過程中會出現大量繁殖,從而使乳品質遭到破壞[26-27]。但運送過程中的儲存溫度,對嗜冷菌的生長繁殖也非常重要。試驗中,在4℃條件儲存下的103、104和105CFU/mL的試驗組蛋白濃度變化差異均無顯著性(P>0.05),蛋白濃度變化平穩。而在21℃儲存條件下,3組試驗組的蛋白濃度都有顯著和極顯著的變化。在2℃下貯藏和運輸的生鮮乳生產的UHT乳要比在6℃下貯藏運輸的生鮮乳生產的UHT乳的保質期要長[28],應盡量將生鮮乳避免光線下保存以及在4℃以下貯藏為最佳;與洪青等[29]所闡述的生鮮乳進入貯存罐迅速冷卻到4℃是抑制乳中嗜冷菌生產蛋白酶從而達到預防乳制品蛋白降解。
應避免乳制品在生產環節中受到細菌的污染,生鮮乳采集過程中奶牛乳房和擠奶設備的清洗和消毒是必不可少的,更要避免運輸和加工過程的二次污染[30-31],盡快運輸到工廠,防止嗜冷菌大量的繁殖代謝,使原料乳中嗜冷菌含量保持在最低水平,減少蛋白酶的產生,從而延長UHT乳的貨架期[32-33]。
4 結 論
在33份生鮮乳樣品中,共篩選出212株嗜冷菌。假單胞菌為生鮮乳中優勢嗜冷菌,分離率為5.19%。99號菌株假單胞菌產蛋白酶能力最強,在UHT乳樣品接菌量相同的情況下,儲存溫度高的試驗組蛋白濃度明顯低于低溫儲存的試驗組,UHT乳低溫儲存的重要性。在儲存溫度相同時,乳樣品接菌量越大,相同時間內的蛋白濃度越低。

