小麥品種衡觀35抗莖基腐病EMS突變及其鑒定
秦鵬亮,周 霄,Kahsay Tadesse Mawcha,王 爽,李佳琪,劉 穎,張 娜,楊文香
(1.河北農業大學植物保護學院植物病理學系/河北省農作物病蟲害生物防治技術創新中心/國家北方山區農業工程技術研究中心,河北保定 071001;2.河北省植保植檢總站,石家莊 050000)
0 引 言
【研究意義】由假禾谷鐮孢菌(Fusariumpseudograminearum)引起的莖基腐病已成為嚴重危害小麥生產品質的重要病害[1-2]。該病從苗期到成熟期均可發生,造成小麥種植期爛種、死苗,成株期莖基部褐變,發病嚴重時可見白穗癥狀,產量減少20%~30%[3]。近些年該病害呈嚴重發生趨勢,2018年在陜西關中的部分地區田塊出現30%以上白穗率[4]。2020年山東省發生面積133.33×104hm2(2 000×104畝)以上,河北中南部小麥主產地域2015年部分地塊的白穗數量達到50%[5]。應用種植抗病品種是防治該病害的高效、安全、經濟的方法,創制抗小麥莖基腐病的種質資源顯得非常重要[6]。由優勢致病菌假禾谷鐮孢菌(Fusariumpseudograminearum)引起的莖基腐病已成為影響小麥生產的重要病害。抗病品種的應用是控制該病害高效、安全、經濟的方法。但由于小麥抗莖基腐病抗性資源匱乏,創制小麥莖基腐病的抗病種質資源對于培育抗病品種,高效防控小麥莖基腐病具有重要意義。【前人研究進展】化學誘變是資源創制的最有效的方法之一[7]。目前小麥種質資源創新工作中使用最廣泛的化學誘變劑甲基磺酸乙酯(EMS,Ethyl Methane Sulfonate)具有誘變成本低、操作簡單便利、突變率高、對材料的損傷小、不易引起染色體畸變、突變譜較廣等特點[8-10],被廣泛應用于誘導突變研究中[11-17]。EMS溶液的濃度與處理時間是影響小麥誘變率的關鍵因素,在EMS誘變濃度與處理時間等做了探索[12]。薛芳等[13]在對新春11號的誘變研究中發現,0.3%是最適宜新春11號小麥的誘變濃度。Mago等[14]用EMS處理小麥種子,選用不同的濃度進行發芽試驗,最終以濃度0.4%進行誘變處理,得到一部分突變體。張維宏等[15]用1.0% EMS處理小麥抗葉銹病等基因系TcLr19的種子,通過表型和分子標記輔助篩選,從M3中篩選到了6個TcLr19的感病突變體,為Lr19基因和功能研究提供理想的材料。孫玉龍等[16]采用0.4% EMS誘導盛農1號小麥,經過M3代驗證獲得可穩定遺傳的突變株系18個,為小麥品種改良和遺傳研究提供了新的材料。Yasui等[17]利用0.5% EMS處理面包小麥種子,在M2材料中發現了糯質突變體,最終育成了糯質普通小麥新品系K107wx1和K107wx2。EMS誘變可以產生較為豐富的突變后代,而且不同的品種誘變的最佳EMS濃度不同。【本研究切入點】經過適宜濃度的EMS誘變可篩選得到一些抗病材料。然而高效準確的接種鑒定方法是篩選抗病材料的關鍵環節之一。霍燕等[18]比較了培養皿幼苗直接接種培養法、水培苗接種法、棉球接種法和菌液浸種接種法4種接菌方法,發現棉球接菌法為最佳的接種方法。在苗期鑒定病級是判斷小麥莖基腐病發病嚴重性有效的方法之一,苗期鑒定結果與成株期鑒定結果具有較高的相關性[11],但由于發病程度受多種因素的影響,苗期鑒定的結果與成株期的鑒定結果可能存在一定差異。需研究小麥品種衡觀35抗莖基腐病EMS突變及其鑒定。【擬解決的關鍵問題】采用在河北主麥區大面積種植的小麥品種衡觀35為誘變品種,參照張紀元等[19]方法通過對EMS最佳處理濃度的篩選。篩選出適宜的誘變濃度,通過濕紙巾接種法[20]和棉球接種法[18]接菌并于后期對小麥抗莖基腐病抗病突變材料進行抗病性鑒定分析,明確其抗病特性,對誘變材料進行加代繁殖,同時跟蹤鑒定。
1 材料與方法
1.1 材 料
以感莖基腐病小麥品種衡觀35為誘變材料,非誘變的衡觀35為感病對照,石優17為中抗對照。
所用藥品、試劑:EMS試劑(ALFA AESAR(A Johnson Matthey Company))、磷酸二氫鈉(NaH2PO4·2H2O)、磷酸氫二鈉(Na2HPO4·12H2O)和硫代硫酸鈉(Na2S2O3)(天津福晨化學試劑有限公司)。
假禾谷鐮刀菌(F.pseudograminearum, Fp)為致病力強菌株,由河北農業大學植物保護學院小麥創新團隊實驗室保存。
1.2 方 法
1.2.1 小麥品種的誘變處理
選取籽粒飽滿的感病材料衡觀35種子 2 000粒,先用75%酒精對種子進行消毒,再用滅菌水清洗3次,將衡觀35種子在室溫條件下分別放入配置好的EMS磷酸緩沖液濃度為0.4%、0.6%、0.8%、1.0%的溶液中,在26℃下110 r/min,振蕩處理8 h,加入5%硫代硫酸鈉進行終止反應,用流動的自來水沖洗3次,每次間隔15 min。放入4℃冰箱中,3 d后觀察并統計其萌發率。以磷酸緩沖液浸泡的種子作為對照。通過不同濃度EMS對小麥萌發率的影響,選擇相對萌發率為50%左右的濃度作為最適誘變濃度。
1.2.2 假禾谷鐮刀菌懸浮液的制備
根據王佐乾等[21]方法制備綠豆培養基,經121℃滅菌30 min。用滅菌的打孔器在PDA培養基上擴繁的Fp菌種,將5個菌餅轉移至綠豆湯培養基,28℃條件下180 r/min振蕩培養72 h,之后將紗布折疊成多層用于過濾,在顯微鏡下用血球計數板觀察并計算孢子濃度,調節菌液孢子濃度至106/mL。
1.2.3 誘變后小麥萌發種子的接種鑒定
小麥萌發后,采用濕紙巾法[20]對其接種,待其芽長至5 mm左右,篩選萌發率較好的小麥種子浸于孢子懸浮液中,接種10 min后,將種子呈直線均勻置于滅菌的濕潤紙巾上,芽的生長方向一致,指向紙巾邊緣,芽上端離紙巾邊緣2 cm左右,將紙巾從一端向另一端卷起,然后將其置于泡沫盒中,在22~25℃,90%的相對濕度環境中進行培養。小麥成功接菌35 d后,參考Wildermuth[22]的改進方法進行鑒定。采用5級鑒定標準對每個品種的處理的苗子進行鑒定,0級為未發病;Ⅰ級為第一葉鞘病斑長度小于1.0 cm;Ⅱ級為第一葉鞘病斑長度在1.0~2.0 cm;Ⅲ級為第一葉鞘病斑長度大于2.0 cm,幼苗未萎蔫;Ⅳ級為幼苗出現萎蔫病癥;Ⅴ級為幼苗死亡。
1.2.4 突變材料的加代
采用0.4% 的EMS對衡觀35進行誘變,將誘變后的M0幼苗采用Li等[24]的方法接種假禾谷鐮刀菌的懸浮液,在接種35 d后對品種M0的發病級別進行鑒定,M0抗病的幼苗轉入花盆,低溫處理后完成春化,轉至溫室進行加代。收獲后繼續加代,直至獲得M3代。
1.2.5 誘變加代幼苗的接菌
經溫室加代培養篩選獲得M3代的種子播種于盆中,在小麥播種15 d左右后,挑選健康、長勢相似的小麥,采用棉球接種法[18]在距土表0.5~1 cm的莖基部纏繞適量醫用脫脂棉球,用移液槍在棉球內側與莖基部接觸的地方注射0.5 mL菌液,后用適量的保鮮膜包裹潤濕的脫脂棉球,外再纏繞適量透明膠帶進行固定,于20℃條件下進行迷霧保濕72 h。在小麥成功接菌35 d后,將麥苗輕輕拔出然后沖洗干凈,查看病害等級程度,根據改進后Wildermuth[22]方法鑒定。
健康的植株繼續生長到成株期,利用Raju等[23]鑒定標準進行鑒定。0級:莖基部無腐爛壞死病斑;Ⅰ級:第一莖節局部腐爛;Ⅱ級:第一莖節完全腐爛,第二莖節局部腐爛或完全腐爛;Ⅲ級:腐爛癥狀上升至第二莖節及以上;Ⅳ級:麥穗以下腐爛;Ⅴ級植株整株死亡或不抽穗或白穗。
病情指數=(∑(各級病株數×相對級數值) /調查總株數×最高病級)×100。
采用0.4% 的EMS對衡觀35進行誘變,將誘變后的M0幼苗采用Li等[24]的方法接種假禾谷鐮刀菌的懸浮液,在接種35 d后對品種M0的發病級別進行鑒定。
1.3 數據處理
收獲M3成熟小麥種子進行千粒重測定。采用SPSS 19.0軟件對病情指數和千粒重進行Duncan's新復極差法方差分析。
2 結果與分析
2.1 適宜EMS處理濃度的確定
研究表明,小麥品種衡觀35經0.4% EMS誘變后其萌發率為49.00%(相對萌發率為52.13%),其它濃度造成萌發率偏低,衡觀35誘變適宜濃度為0.4%。
2.2 苗期病級鑒定
研究表明,品種M0衡觀35 中0級株數最多,共計106株,占突變總株數的14.50%,并且比兩個對照組高出3倍。M0衡觀35的病情指數比中抗品種石優17低19.02%。表1
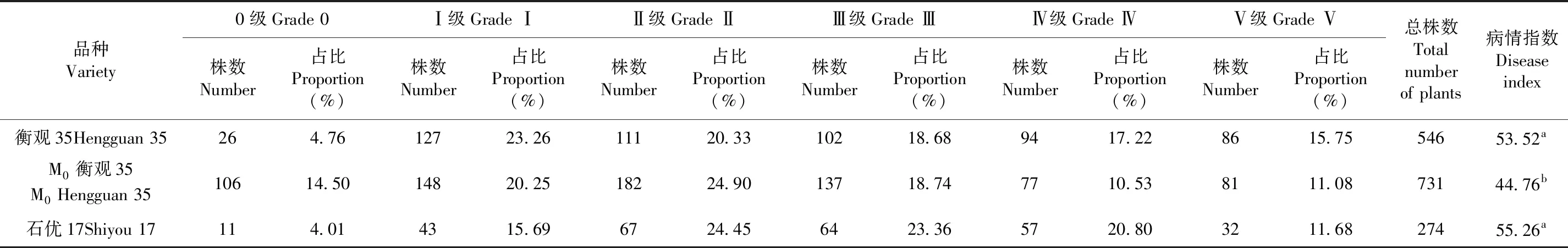
表1 M0小麥人工接菌后苗期的病級鑒定
對選擇出0~Ⅱ級的材料進行繁殖,保留病害Ⅱ級以下的材料,收獲種子,繁殖直至M3代。對M3代的小麥粒播種,進行苗期接菌鑒定,從120株M3衡觀35中獲得25株免疫材料,占該品種突變材料的20.83%,比對照感病衡觀35和中抗石優17免疫株數所占百分比分別高出1倍和3倍。M3衡觀35苗期的病情指數顯著低于對照感病衡觀35的病情指數,并且與對照中抗石優17的病情指數沒有顯著性差異。M3衡觀35品種在苗期能夠抵抗莖基腐病的發生。表2,圖1

A:衡觀35;B:M3衡觀35;C:石優17
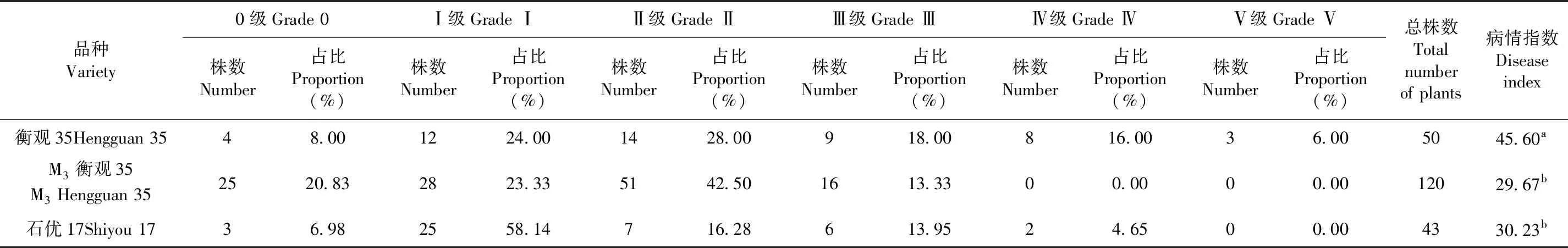
表2 M3突變品種苗期病級鑒定
2.3 M3突變品種成株期病級鑒定結果
研究表明,M3衡觀35各發病等級株數有所變化,病情指數高于苗期的病情指數,但與對照感病衡觀35的病情指數存在顯著性差異,小麥莖基腐病發生的嚴重程度隨著生育期的延長而加重,共獲得突變免疫抗性資源7株,占測試突變株材料的5.83%。表3和圖2

注:A:衡觀35;B:M3衡觀35;C:石優17
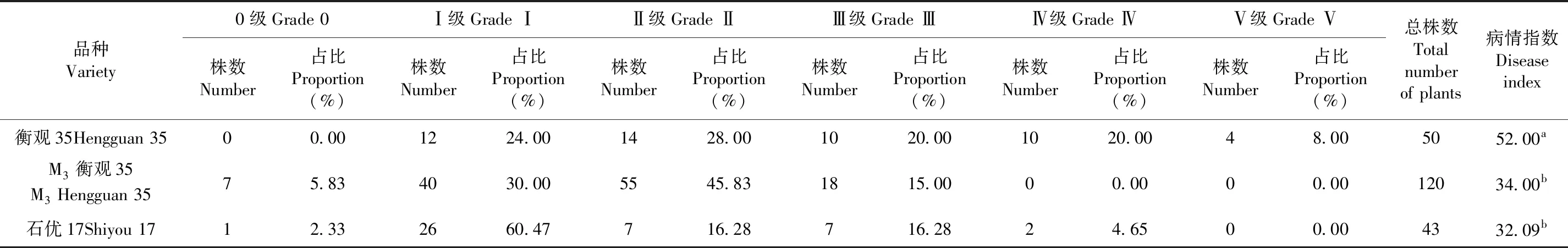
表3 M3突變品種成株期病級鑒定
2.4 M3突變株的農藝性狀和抗莖基腐病材料的千粒重變化
研究表明,小麥品種衡觀35的EMS誘變突變株在農藝性狀和抗病性上均發生了變化。在測試的小麥突變材料中,植株出現抽穗晚、矮化、分蘗增多及畸形穗等癥狀。與對照相比,M3衡觀35小麥抗莖基腐病的病能力增強,而且同一小麥品種千粒重隨其病害級別的增大而降低,與感病衡觀35和中抗石優17對照相比,同一病害等級下的不同品種間千粒重差異顯著。圖3,表4

注:A:少分蘗;B:半矮化;C:少分蘗、抽穗晚;D:抽穗晚,冬性增強;E:畸形穗
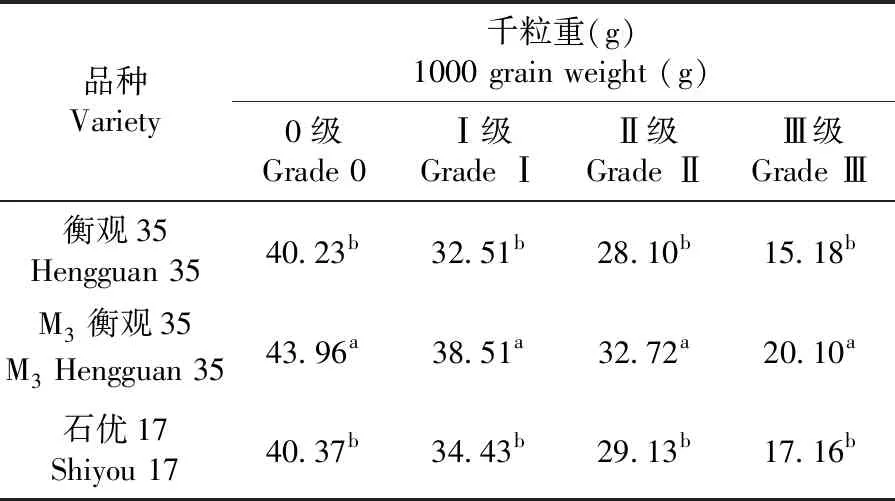
表4 M3突變品種不同病害級別的千粒重變化
3 討 論
3.1EMS誘變劑是目前最為有效的植物化學誘變技術方法之一[8]。目前利用該技術獲得抗性基因突變體,Mago等[25]報道,利用EMS誘導在基因組中產生隨機點突變獲得抗銹病基因敏感型突變體。李韜等[26]使用EMS對抗赤霉病的小麥地方品種進行誘變處理,發現處理小麥的發病率都比相應株野生型的高得多。趙天祥等[27]利用EMS技術對小麥偃展4110種子進行誘變,對其M2代整個的生育期田塊表現型進行抗性鑒定及實時觀察,從而其獲得了特殊性狀的突變體。
3.2溫日宇等[28]用EMS 處理后使藜麥幼苗種子細胞產生許多生理生化反應,生成了大量有害自由基及其他分子。而在誘變劑過程中,其化學誘變物質會導致植物內部的生理損傷,在某種程度上,增加誘變劑劑量和延長誘變劑處理的時間可能會提高誘變劑的效力;當其誘變劑的劑量超過劑量限制時,植物本身就會受到嚴重的生理損害,導致更多的死亡和失常。現已知EMS誘變對種子的萌發產生一定的影響。EMS作為應用最廣、效果最好的誘變劑,已經用于多種作物的誘變育種及抗病選擇。盧銀等[29]采用不同濃度 EMS 誘變大白菜種子萌發及幼苗生長的研究,發現誘變的最佳濃度為 0.4%~0.6%。曲高平等[30]用不同濃度的EMS處理甘藍油菜種子發現隨著 EMS濃度的增大,發芽率降低,發芽時間延長。研究采用不同濃度EMS對衡觀35進行誘變來篩選莖基腐抗性突變體,試驗選擇了0.4%、0.6%、0.8%和1.0% 4個濃度的誘變試驗,隨著EMS濃度的提高,種子的發芽率降低,考慮到誘變效率,以小麥的相對萌發率在50%左右,確定處理組小麥品種衡觀35的誘變適宜濃度為0.4%,獲得了抗莖基腐病免疫突變株M0衡觀35。經溫室盆栽進行加代繁殖,以病害級別為選擇依據,得到M3代。對于M3代的苗采用霍燕等[18]方法接菌,分別于苗期和成株期鑒定病級篩選抗病資源,共從供試突變品種M3代中篩選獲得7份免疫的抗小麥莖基腐病的資源。發現突變獲得的M3材料在鑒定中仍然存在免疫和不同級別的抗病性,可能是由于決定小麥莖基腐病抗病性的基因是微效基因決定的。而金京京[31]通過對普通小麥品種抗莖基腐病全基因組關聯分析篩選出的04中36和石優17等抗性品種豐富了我國小麥莖基腐病抗病資源,并篩選出抗病相關蛋白及其編碼基因。Yang等[32]通過EMS誘變建立突變體庫,利用GWAS(Genome-wide association study)和QTL定位分析發現了小麥莖基腐病相關基因TaDIR-B1,并通過基因沉默技術,發現該基因的功能缺失能顯著增強小麥莖基腐病的抗病能力,且可能通過調節植株中木質素含量來調控植株抗病能力。然而參與小麥莖基腐病調控基因的表達受環境的影響,或者目前所得到的M3代尚不穩定,需要后期通過分子技術進行進一步的確認。
3.3此外,許云峰等[33]利用EMS處理小麥品種煙農15,得到了一些具有不同性狀的突變體,而且出現了一些優良農藝性狀突變。
4 結 論
4.1在苗期表現免疫的植株,有些到成株期則不再表現免疫,鑒定中發現苗期抗病性和成株抗病性存在差異,隨著接種時間的延長,病害發生程度加重,成株期測試的突變植株僅為7株表現免疫,成株期的鑒定結果更能代表植株的抗病性。
4.2EMS突變小麥衡觀35,適宜的突變濃度為0.4%,共從供試突變品種M3代中篩選獲得了7份免疫的抗小麥莖基腐病的資源。

