腹腔鏡胃腔外楔形切除與開腹手術治療低危險度胃間質瘤對患者胃腸功能、免疫功能的影響*
劉 軍,胡 斌,陳 巍
陜西省西安市中心醫院普外科,陜西西安 710003
低危險度胃間質瘤(LRGST)是十分常見且發病率較高的一種消化道間葉組織型腫瘤,并且這一腫瘤發生率較高的一個生理位置就是胃部[1]。目前臨床中對于LRGST的主要治療方式之一就是外科切除,但是因為LRGST發生轉移的概率以及風險較低,因此相對于傳統的器官全切,臨床中往往都會優先選擇局部切除[2]。所以,胃腔外楔形切除術成為絕大部分外科醫生治療LRGST的常用手術方式[3]。依據目前臨床相關指南,在LRGST的治療過程中可以應用腹腔鏡手術,但是會因為醫生在腹腔鏡下的操作增加患者腫瘤發生破裂并播撒的風險與概率[4]。隨著近幾年社會經濟的持續發展與進步,臨床中的一系列微創器械和醫療技術也隨之得到了長足的發展,并且出現了一系列全新的相關腹腔鏡設備,包括單孔腹腔鏡、腹腔鏡輔助以及懸吊式腹腔鏡等。這一系列全新腹腔鏡設備的出現以及應用也推動了臨床中對于LRGST治療的發展與進步[5]。但是目前臨床對LRGST是使用腹腔鏡治療還是用開腹術治療并沒有普遍一致的觀點。基于此,本文主要是針對性地探討并分析使用腹腔鏡與開腹手術分別進行胃腔外楔形切除治療LRGST對患者免疫功能以及胃腸功能所產生的影響。
1 資料與方法
1.1一般資料 選取2021年5月至2022年5月本院收治的LRGST患者68例為研究對象,依據術式不同分為對照組和研究組,每組34例。對照組:男12例,女22例;年齡35~65歲,平均(52.1±2.1)歲;腫瘤位置,胃竇5例,胃體11例,胃底8例,賁門10例。研究組:男13例,女21例;年齡35~65歲,平均(52.3±2.2)歲;腫瘤位置,胃竇6例,胃體12例,胃底7例,賁門9例。兩組一般資料比較,差異均無統計學意義(P>0.05),有可比性。本研究經本院醫學倫理委員會批準。
納入標準:(1)符合臨床中對胃間質瘤的診斷[6];(2)符合手術指征;(3)年齡>20歲;(4)患者術前免疫功能正常;(5)患者意識清晰且精神正常,可配合進行研究。排除標準:(1)合并嚴重的心肺疾病;(2)患有惡性腫瘤;(3)術前腫瘤發生轉移或周圍侵犯;(4)既往有腹部手術史;(5)長期使用活血及抗凝藥物。
1.2方法
1.2.1對照組 采用開腹胃腔外楔形切除術。手術體位為平臥位,在患者的腹部正中進行一個手術切口,然后依據不同患者實際的腫瘤位置實施楔形切除。
1.2.2研究組 腹腔鏡胃腔外楔形切除術。以胃底部腫瘤為例:手術體位為向右傾斜、腳低頭高體位。首先,從患者的胃大血管弓下位置對大網膜進行分離,一直分離至結腸脾曲位置,將患者的脾門和脾胃韌帶充分地暴露在手術者的視野中。然后在脾下極周邊及胰尾末端位置將胃網膜左側的血管進行完全顯露,使用血管夾將該血管夾斷。對患者的胃底后壁進行牽拉,然后將脾胃韌帶拉緊,同時將胃短動脈離斷,直至完全分離脾上極和胃底。將脾上極和胃底完全分離之后將胃底、胃壁往右下方牽拉,順著膈肌的方向將胃膈韌帶往食管裂孔的方向分離,并充分游離胃底賁門。完成游離操作之后,將胃底賁門往右上方的位置牽拉,使胃底部的腫瘤能夠充分地顯露在操作者視野中。假如此時無法有效、準確定位患者的腫瘤位置,可以在術中視情況聯合胃鏡更加準確地對腫瘤位置定位。腫瘤定位之后將腫塊基底部的胃壁往左上腹提拉,在提拉的過程中要注意不能鉗夾到腫瘤。使用無創鉗夾將腫瘤周圍的胃壁鉗夾,然后往左上方牽拉胃壁與腫瘤,使胃底部能夠充分地張緊。將切割閉合器置入,并調整位置使閉合器能夠將胃壁夾住并與腫瘤下方位置接近;確認位置無誤之后激發閉合器,切割并閉合胃壁。提起已經完全切斷的腫瘤側胃壁,使首次切割線的終點能夠顯露,同時將首次切割線的終點作為二次切割的起點。再次將閉合器置入,確認位置無誤后激發閉合器,楔形切除胃壁部分和腫瘤。假如完成切割后,切端位置有出血時,給予常規止血縫扎。最后將成功切除的腫瘤病灶送入取物袋中,并常規送檢。
1.3觀察指標
1.3.1兩組胃腸功能比較 比較兩組術后首次排氣及術后飲食恢復時間。術后首次排氣:術后3~4 d患者放屁,腹脹癥狀消失或減輕,同時可伴隨排便,患者腹部癥狀如噯氣、呃逆等明顯好轉;經腹部聽診提示患者的腸鳴音已恢復至正常,每分鐘至少3~4次,同時給予患者實施腹部平片檢查,片中未見出現相關腸梗阻表現,如氣液平面等。術后飲食恢復時間:指患者在術后首次開始進食流食的時間。
1.3.2兩組并發癥比較 比較兩組的并發癥發生情況,并發癥包含切口感染、胃排空延遲、胃出血。切口感染:手術切口出現紅、腫、熱、痛等表現;在為患者換藥時可以發現患者的切口周圍出現明顯紅腫,且伴有滲出;患者通常還會出現發熱。胃排空延遲:患者會表現出相關臨床癥狀,如上腹痛、腹脹感、噯氣、早飽、嘔吐及惡心等;76%的復方泛影葡胺胃部造影檢查結果提示,胃部存在明顯潴留,且在20 min之內患者胃部沒有發生蠕動或蠕動明顯減弱,沒有流出道梗阻。胃出血:術后24 h胃液>300 mL,且胃液的顏色與術后剛開始時相比沒有明顯變清變淡,則可診斷為胃出血。
1.3.3兩組免疫功能比較 比較兩組T淋巴細胞總值(CD3+T淋巴細胞)、分化決定族抗原4(CD4+T淋巴細胞)、白細胞分化抗原8(CD8+T淋巴細胞)比例,以及CD4+T淋巴細胞/CD8+T淋巴細胞比值。在患者接受手術治療前及患者術后出院前1 d抽取患者的空腹靜脈血,常規離心(3 800 r/min離心10 min)得到血清標本,采用流式細胞儀檢測CD3+、CD4+、CD8+T淋巴細胞。
1.3.4兩組術后復發情況比較 分別在術后4個月及術后9個月對患者進行隨訪,統計兩組患者的復發情況,并進行記錄。復發診斷:做CT或胃鏡等檢查,影像能夠明顯看到腫瘤病灶或轉移病灶。
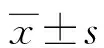
2 結 果
2.1兩組胃腸功能比較 與對照組相比,研究組術后首次排氣時間、術后飲食恢復時間更快(P<0.05)。見表1。
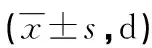
表1 兩組胃腸功能比較
2.2兩組并發癥比較 研究組并發癥發生率低于對照組(P<0.05)。見表2。

表2 兩組并發癥比較
2.3兩組免疫功能比較 治療后研究組CD3+、CD4+T淋巴細胞比例及CD4+T淋巴細胞/CD8+T淋巴細胞比值高于對照組(P<0.05),CD8+T淋巴細胞比例低于對照組(P<0.05)。見表3。

表3 兩組免疫功能比較
2.4兩組術后復發情況比較 兩組術后總復發率比較,差異無統計學意義(P>0.05)。見表4。

表4 兩組術后復發情況比較
3 討 論
LRGST在臨床當中具有一定的惡性潛質,使用放射治療對于LRGST進行干預并不能獲得十分理想的效果,因此當前臨床對LRGST的治療方法主要有藥物治療、內鏡治療以及手術治療[7]。內鏡治療主要適用于體積及尺寸較小的LRGST,但是在使用胃鏡對胃底部的較大腫瘤進行處理時,十分容易導致患者在術中或者術后發生胃穿孔以及胃出血,同時還會導致出現不完整腫瘤切除的風險[8]。目前對LRGST進行藥物治療時主要是應用分子靶向類藥物進行干預,而藥物治療主要是對患者術前治療的輔助。通過采用分子靶向類藥物治療能夠使患者腫瘤體積在術前得到有效減小,使臨床分期有效降低,從而在使手術范圍大大縮小的同時也能夠盡可能地避免聯合臟器切除的風險,使患者得到根治性切除的概率大大增加[9]。
就目前的醫療條件以及現狀分析而言,絕大部分的LRGST患者都需要通過外科手術治療。既往對于LRGST的治療,絕大部分都是采用開腹手術。開腹手術能夠使術者在手術過程中獲得更加清晰的視野,并且也能夠更加徹底地切除腫瘤病灶[10]。但是隨著社會的不斷發展以及開腹手術的逐漸應用,人們開始逐漸發現使用開腹手術之后患者會出現一系列的相關并發癥,同時還會使患者術后的恢復時間大大延長[11]。隨著醫療技術與設備的不斷進步以及發展,腹腔鏡設備與技術開始日漸成為前外科臨床中所關注的一個重點及熱點。在腹腔鏡的臨床應用過程中,其表現出了一系列開腹手術所無法比擬的優勢,比如恢復快、創傷小、患者術后并發癥低等。但是腹腔鏡在臨床應用的過程中也存在著部分的缺點,主要表現:當前的腹腔鏡技術以及經驗相對于開腹手術而言偏少,因此絕大部分患者的腹腔鏡手術時間明顯更長;并且還有部分學者指出,使用腹腔鏡手術進行治療時手術者的視野相對較差,因此無法實現對腫瘤的徹底切除。因此目前臨床中對于LRGST使用開腹手術或者是腹腔鏡手術進行治療,依舊存在爭議。
絕大部分LRGST患者在接受腹部手術之后,不管是開腹手術或者是腹腔鏡手術都會表現出十分明顯的胃腸功能異常現象[12]。導致這一現象發生的主要因素就是在手術過程中的相關操作以及麻醉等都會使患者原有的胃腸功能受到影響,此外,術后的疼痛也會對患者的胃腸功能恢復產生一定的影響。而術后胃腸功能是否能夠及時且有效地恢復將直接影響到患者術后的康復治療以及康復速度[13]。因此,越來越多的學者開始關注如何在保障療效的同時盡可能地使患者在術后更快地恢復胃腸功能。本研究結果提示,研究組患者胃腸功能恢復更快。導致這一結果的原因是相對于開腹手術而言,腹腔鏡手術在操作過程中視野更加清晰,因此其也會更加有效地避免對患者手術周圍組織以及臟器的損傷,患者正常的腸胃功能所受到的影響也更小[14]。
雖然手術與免疫力降低之間并沒有直接關系,但是手術之后免疫力降低是十分常見的一種現象。最可能的原因就是在手術過程中,術者的一系列操作對患者的正常臟器以及生理功能產生的影響,從而導致免疫力降低;同時在手術過程中所導致的出血也會使患者身體的內環境平衡受到影響,從而影響患者的免疫功能[15]。本研究結果提示,治療后研究組CD3+、CD4+T淋巴細胞比例及CD4+T淋巴細胞/CD8+T淋巴細胞比值高于對照組(P<0.05),CD8+T淋巴細胞比例低于對照組(P<0.05)。由本研究結果分析可以得知,兩組患者不管是接受開腹手術還是接受腹腔鏡手術,術后患者的免疫功能均發生了不同程度的降低,但是研究組患者的降低程度明顯更小。這也提醒,腹腔鏡胃腔外楔形切除術對于患者免疫功能所產生的抑制程度更加輕微。分析其可能的原因:相對于開腹手術,腹腔鏡胃腔外楔形切除術的傷口更小,術中對患者造成的組織創傷也更小,對患者術后免疫功能的影響也小。
目前臨床中較有爭議的一項內容就是腹腔鏡胃腔外楔形切除術能否實現與開腹手術同等的療效。本研究結果提示,兩組術后總復發率比較,差異無統計學意義(P>0.05)。但是本研究僅僅對兩組患者進行了短期的隨訪,未對患者進行長期隨訪來進一步驗證本研究的結論,后期若條件以及時間允許,將會對患者進行長期隨訪,從而進一步確認腹腔鏡胃腔外楔形切除術治療LRGST患者的效果。
腹腔鏡胃腔外楔形切除術在臨床應用時的注意事項主要包括以下幾方面:首先,需要嚴格掌握手術適應證。胃底近賁門位置的腫瘤一定要預防在切除之后繼發形成賁門狹窄。因此,胃底近賁門位置的腫瘤更加適合使用開腹手術進行治療。假如腫瘤體積太大,也十分容易導致腫瘤破裂并種植,且取標本時的切口尺寸太大,對患者的損傷加大。其次,準確定位腫瘤病灶的位置是關鍵。在患者接受手術治療之前需要接受胃鏡治療和CT檢查,從而進一步明確患者體內的腫瘤病灶位置和大小;在手術過程中可以使用相關手術器械進行探查和觸診,進一步明確腫瘤病灶的定位。第三,一定要維持胃腔通暢,避免發生狹窄。在手術過程中,假如需要使用切割器進行楔形切割時,一定要盡可能地進行橫形切割,特別是胃竇和胃底的腫瘤病灶。第四,手術操作過程中一定要及時且徹底地進行止血。胃擁有十分豐富的血運,使用切割器進行切割之后,創面會不可避免地出現滲血;滲血量較少是正常的,但是如果出現活動性出血時,則需要通過縫合來止血。對胃系膜進行分離操作時,如果血管尺寸較大需要充分地配合使用相關器械,如鈦夾和超聲刀等,確保能夠徹底地止血。
綜上所述,使用腹腔鏡胃腔外楔形切除術治療LRGST時,患者術后腸胃功能恢復更快,且使用腹腔鏡胃腔外楔形切除術治療對于LRGST患者免疫功能所產生的影響更小,該術式術后短期復發率與開腹手術相當。

