C-TIRADS聯合cfDNA鑒別診斷甲狀腺結節價值及臨床效用評價
侯婷婷 夏燕妮 張紅偉
甲狀腺結節是甲狀腺外科常見一種病變,準確鑒別結節性質是管理患者的關鍵與依據。目前甲狀腺細針穿刺是鑒別甲狀腺結節性質常用手段,但為有創性檢查,在初步篩查方面應用受限[1]。超聲具有無創、實時、無輻射、經濟性和重復性高等優點,是甲狀腺首選的一種影像檢查工具[2]。中國超聲甲狀腺結節惡性危險分層指南(Chinese guidelines for ultrasound malignancy risk stratification of thyroid nodules,C-TIRADS)是基于超聲檢查提出的甲狀腺診斷報告系統,可通過觀察回聲、方位、邊緣、結構等特征對結節定性,但其敏感度、特異度有較大提升空間,加之C-TIRADS系我國的最新版本,相關報道仍較少,故有必要進行進一步驗證分析[3]。循環游離DNA(cell-free DNA,cfDNA)來源于腫瘤細胞、凋亡壞死細胞等,攜帶有腫瘤組織基因,已被證實對乳腺癌、消化系統癌癥等具有重要的應用價值[4,5]。當前關于C-TIRADS聯合cfDNA鑒別診斷甲狀腺結節的報道鮮見,二者聯合能否進一步提高準確性尚不明確。基于此本研究分析C-TIRADS聯合cfDNA鑒別診斷甲狀腺結節價值和臨床效用,為臨床無創性篩查甲狀腺結節性質提供參考。
1 資料與方法
1.1 一般資料 本研究為診斷試驗的評價研究,回顧性選取2020年3月至2022年9月于我院甲狀腺外科有明確病理結果的395例甲狀腺結節患者的臨床資料,其中良性結節303例(良性組),惡性結節92例(惡性組)。
1.2 納入與排除標準
1.2.1 納入標準:①甲狀腺結節;②單發結節;③有明確病理結果;④既往無甲狀腺手術史;⑤臨床資料完整。
1.2.2 排除標準:①超聲圖像質量不佳,無法評價;②轉移性甲狀腺癌;③伴其他惡性腫瘤;④超聲檢查前有131I等相關治療史。
1.3 方法
1.3.1 超聲檢查:指導研究對象去枕仰臥,使用超聲診斷儀(美國GE Logiq E9、Philips EPIQ7),頸前區顯露后,線陣探頭ML6-15、L12-5,頻率9~15 MHz,橫縱切全面掃查甲狀腺。由兩名經驗>10年的超聲科醫生,參考C-TIRADS指南[6],在雙盲狀態下,對圖像的回聲、方位、邊緣、結構等特征進行獨立分析,如有結果無法統一,兩人可協商討論決定,若仍不能達成一致,則邀請一位更高年資醫生共同討論后決定。C-TIRADS標準:垂直位(加1分)、極低回聲(加1分)、微鈣化(加1分)、彗星尾偽像(減1分)、邊緣模糊或不規則或甲狀腺外侵犯(加1分)、實性(加1分),各征象和為總分,無分值、-1分、0分傾向于良性結節,從1分開始有惡性可能,分值越高,惡性可能越大。
1.3.2 cfDNA檢測:就診時采集5 ml抗凝空腹靜脈血,3 000 r/min常溫離心10 min,取上清置于1.5 ml離心管中,再以5 000 r/min離心2 min,取上清用以檢測cfDNA。用兩步法磁珠提取cfDNA,得到純化的cfDNA。用Qubit熒光定量儀(馬來西亞Thermofisher 3.0)測定cfDNA,試劑盒購于江萊生物,按照試劑盒說明書逐步完成檢測。
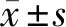
2 結果
2.1 2組一般資料比較 良性組年齡、體質量指數、性別、結節直徑、合并疾病、總三碘甲狀腺原氨酸、甲狀腺激素、促甲狀腺激素與惡性組比較,差異無統計學意義(P>0.05);惡性組有甲狀腺癌家族史患者多于良性組(P<0.05)。見表1。
2.2 2組C-TIRADS、cfDNA比較 惡性組超聲征象垂直位、極低回聲、微鈣化、邊緣模糊或不規則或甲狀腺外侵犯、實性表現患者多于良性組,彗星尾偽像患者少于良性組(P<0.05);惡性組C-TIRADS評分、cfDNA高于良性組(P<0.05)。見表2,圖1、2。
圖1 良性結節的超聲圖,超聲提示實性結節,邊緣不規則,C-TIRADS評分2分 圖2 惡性結節的超聲圖:超聲提示實性結節,極低回聲、微鈣化、邊緣不規則,C-TIRADS評分4分
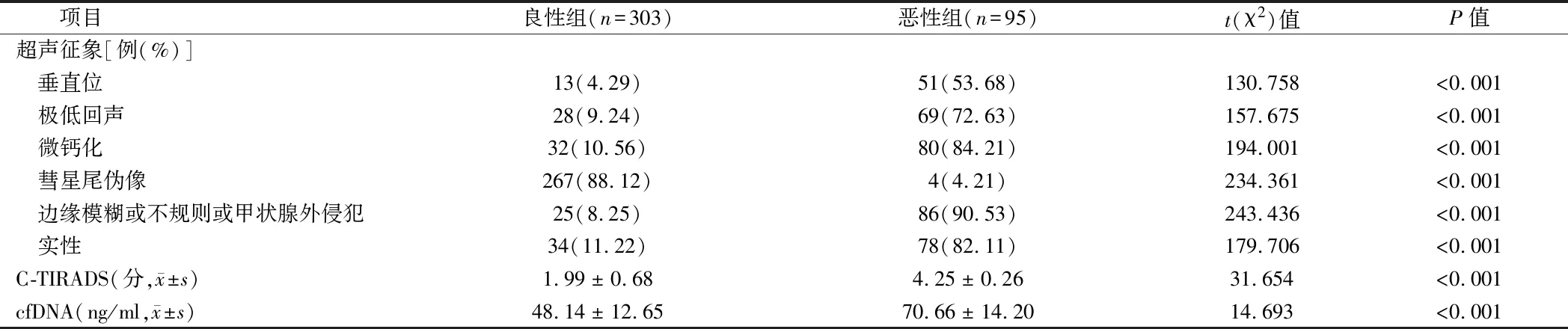
表2 2組C-TIRADS、cfDNA比較
2.3 C-TIRADS聯合cfDNA鑒別診斷甲狀腺結節價值 C-TIRADS、cfDNA及二者聯合鑒別診斷甲狀腺結節的AUC分別為0.843、0.812、0.939,C-TIRADS聯合cfDNA的AUC大于C-TIRADS、cfDNA(P<0.05);C-TIRADS、cfDNA的AUC比較,差異無統計學意義(P>0.05)。見圖3,表3、4。
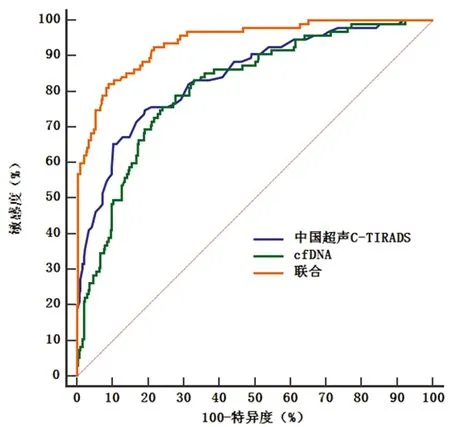
圖3 C-TIRADS聯合cfDNA鑒別診斷甲狀腺結節的ROC曲線

表3 C-TIRADS聯合cfDNA鑒別診斷甲狀腺結節ROC分析結果

表4 各鑒別診斷方法的AUC比較
2.4 C-TIRADS、cfDNA與甲狀腺結節惡性風險的關系 C-TIRADS≥4分患者甲狀腺結節惡性的風險是<4分患者的12.496倍(P<0.05);cfDNA≥63.70 ng/ml患者甲狀腺結節惡性的風險是<63.70 ng/ml患者的9.863倍(P<0.05)。見表5。
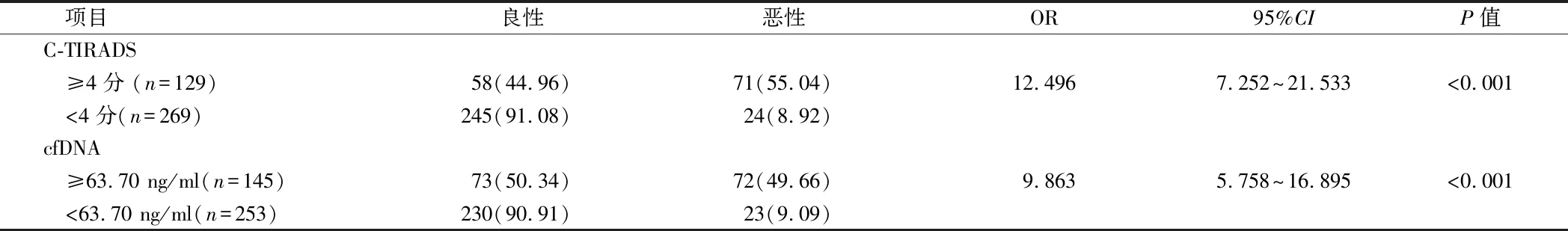
表5 C-TIRADS、cfDNA與甲狀腺結節惡性風險的關系 例(%)
2.5 C-TIRADS、cfDNA及聯合鑒別診斷甲狀腺結節的臨床效用 繪制DCA曲線顯示,C-TIRADS、cfDNA及二者聯合鑒別診斷甲狀腺結節均具有正向的臨床凈獲益,且采用C-TIRADS聯合cfDNA鑒別診斷時,臨床效用進一步提高。見圖4。
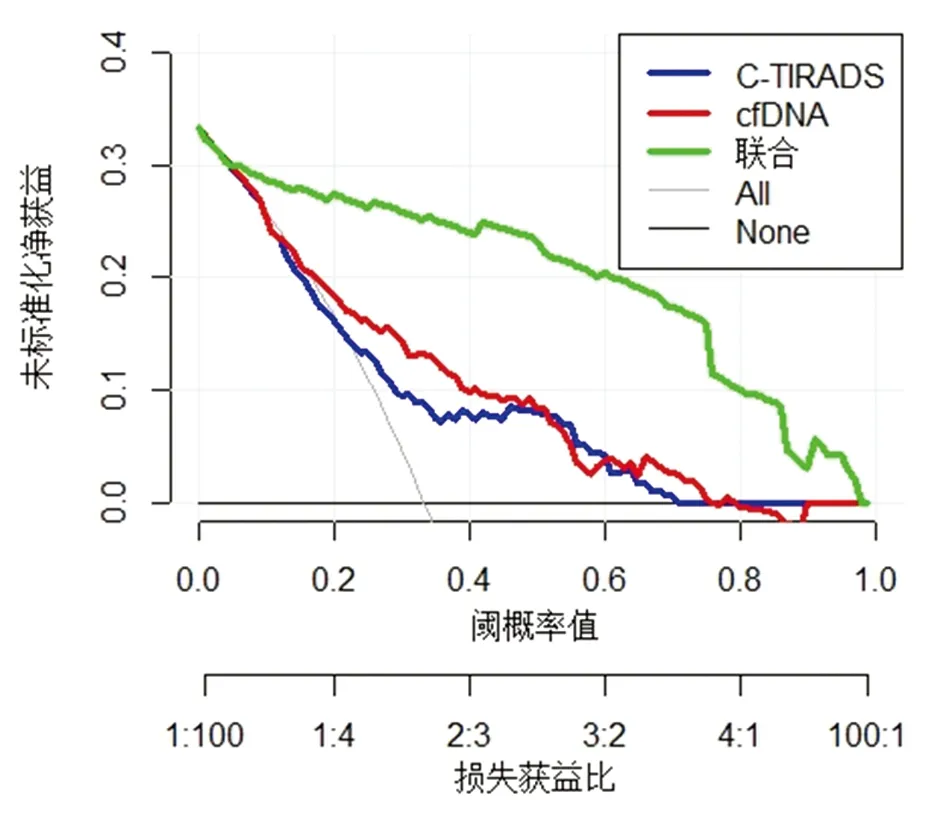
圖4 C-TIRADS、cfDNA及聯合鑒別診斷甲狀腺結節的DCA曲線
3 討論
甲狀腺癌發病率位居惡性腫瘤第九位,盡管與其他系統癌癥相比,其預后相對較好,但仍會威脅患者生命安全,因此早期準確診治是必要的[7]。
本研究結果顯示,惡性組超聲征象垂直位、極低回聲、微鈣化、邊緣模糊或不規則或甲狀腺外侵犯、實性表現患者多于良性組,彗星尾偽像患者少于良性組,C-TIRADS評分高于良性組,提示C-TIRADS標準界定的良性和惡性征象在不同性質結節中有明顯的差異,具有一定的診斷參考價值。垂直位常在橫切面或縱切面評估,其判斷惡性的準確度優于單一切面,水平位則良性趨向較大,但應注意乳頭狀癌的濾泡亞型也可表現為水平位[8]。惡性結節纖維組織顯著增生,甲狀腺濾泡破壞嚴重,聲阻抗差變化大,表現為低回聲,且回聲越低,惡性風險越高[9]。微鈣化是惡性結節靈敏度較高的一個征象,尤其是彌漫性微鈣化、“暴風雪樣”微鈣化[10]。由于惡性結節增殖速度快,常累及甲狀腺包膜,使甲狀腺包膜破壞,甚至侵犯臨近軟組織和血管,故邊緣模糊或不規則或甲狀腺外侵犯是惡性表現[11]。實性是描述結節結構的,不含囊性成分或囊性成分占結節的比例較小,是可疑惡性特征[12]。彗星尾偽像多由濃縮膠質、碎屑所致,出現在囊性區域的混合偽像高度提示良性,若出現在實性結構內不能用來排除惡性可能[13]。后續的ROC分析顯示,C-TIRADS鑒別診斷結節性質的AUC為0.843,cut-off值>4分,與鄭琳琳等[14]報道類似,證實了C-TIRADS的應用價值。但因良惡性甲狀腺結節在超聲特征上具有不確定性和部分重疊性,導致單純依賴C-TIRADS有一定局限。如C-TIRADS將囊實性視為良性結節,但部分囊實性改變出現在惡性結節中,易導致誤診、漏診;部分惡性結節缺乏典型惡性超聲特征,亦會引起誤診、漏診,這也是該標準鑒別診斷敏感度、特異度仍存在較大提升空間的一個原因,所以考慮聯合其他手段進行鑒別。
cfDNA可由腫瘤細胞主動分泌,攜帶的生物學信息與原發灶或轉移灶相同,與腫瘤負荷、預后等有關,還能用于腫瘤治療后的療效監測[15,16]。Dutta等[17]報道,甲狀腺惡性結節患者cfDNA高于良性結節,本研究發現了相同的結論,提示cfDNA的定量對性質不明的甲狀腺結節具有鑒別診斷價值。生理狀態下cfDNA處于低水平狀態,當發生甲狀腺癌時,腫瘤細胞的不斷增殖,使cfDNA釋放增加,引起外周循環cfDNA升高,所以cfDNA被視為腫瘤的液體活檢手段[18]。本研究發現,cfDNA鑒別診斷甲狀腺結節的AUC為0.812,與C-TIRADS評分相比,差異無統計學意義(P>0.05),呈現出較高的鑒別診斷價值。且本研究首次將C-TIRADS評分與cfDNA聯合應用于甲狀腺結節的鑒定,結果顯示,二者聯合的AUC為0.939,高于二者單獨應用的AUC,進一步提高鑒別診斷效果,有助于減少不必要活檢,避免過度診斷和過度治療,提高甲狀腺結節診療水平。C-TIRADS是從腫瘤形態學進行直接評估,cfDNA是從腫瘤循環學進行評估,二者聯合使用能克服自身的不足,起到相互彌補作用,所以診斷價值提高。同時繪制DCA曲線顯示,C-TIRADS、cfDNA及二者聯合鑒別診斷甲狀腺結節均具有正向的臨床凈獲益,且采用C-TIRADS聯合cfDNA鑒別診斷時,臨床效用進一步提高,可作為甲狀腺結節的一種有效鑒別診斷方法。值得注意的是,由于超聲醫生診斷經驗的不同,可引起評估結果在觀察者間不同,本研究未分析不同觀察者之間差異對C-TIRADS鑒別診斷的影響,這是本研究的局限之處,下一步仍需深入分析。
綜上,C-TIRADS聯合cfDNA能相互彌補,提高對甲狀腺結節的鑒別診斷價值,具有良好的臨床效用,為臨床鑒別惡性結節提供了一個無創、準確、便捷的方案,有助于提高甲狀腺結節的診療水平。

