油茶葉多酚的提取及其對常見植物病原真菌抑制作用研究
謝水香,雷彩燕
河南農業大學植物保護學院,鄭州 450002
油茶(Camelliaoleifera)是山茶科(Theaceae Mirb),山茶屬(CamelliaL.)的一種多年生常綠灌木。油茶中含有大量的活性物質,比如多酚、角鯊烯、黃酮以及微量元素等[1]。目前人們對油茶的開發和利用主要集中在油茶籽和油茶籽油[2],而油茶的葉子則成了廢料。
多酚(polyphenol)是指分子結構中具有若干個酚羥基的化合物的總稱,在植物的根、莖、葉以及果實中都有廣泛的分布。多酚主要的衍生物是兒茶素類(catechins),還含有酚酸類(phenolic acids)、黃烷醇類(flavanols)等物質。多酚作為一類植物次生代謝產物,是植物抵御病原菌入侵的重要生化物質之一。目前關于茶多酚對動物細菌的抑菌活性研究較多,而且已經得到普遍公認[3, 4]。而對于油茶多酚的研究,大多數僅僅是山茶籽油中多酚的提取及含量測定[5,6],關于其抑菌活性的研究相對缺乏。因此,本研究對油茶葉多酚進行提取,研究其對植物病原真菌的抑制活性及機理,為植物源農藥的開發以及病害的綠色防控提供基礎。研究有利于拓寬油茶資源的綜合開發利用以及多酚在生物農藥領域的應用[7]。
1 材料與方法
1.1 供試材料
實驗所用油茶葉均采自江西省贛州市興國縣興江鄉江口村的油茶樹。
供試植物病原菌包括:假禾谷鐮刀菌(Fusariumpseudograminearum)[8]、新月彎孢霉(Curvularialunata)[9]、鏈格孢(Alternariaalternata)[10]、草莓多主棒孢霉(Corynesporacassiicola)[11]、大麗輪枝菌(Verticilliumdahliae)[12]、葡萄座腔菌(Botryosphaeriadothidea)[13]、尖孢鐮孢菌苦瓜專化型(Fusariumoxysporumf.sp.momdicae)[14]。
病原菌由河南農業大學植物保護學院病理實驗室純化,在PDA培養基(馬鈴薯葡萄糖瓊脂培養基)上倒置培養,培養溫度28 ℃,光照和黑暗培養各12 h,純化兩代以上。
酒石酸亞鐵溶液、磷酸鹽緩沖液:根據國家標準茶多酚測定方法(GBT8313-2002),制作酒石酸亞鐵溶液和磷酸鹽緩沖液。
1.2 實驗方法
1.2.1 多酚的提取
將采摘好的油茶葉用水清洗干凈,然后放置工作臺瀝干,在60 ℃下烘干至恒重,用高速離心粉碎機研磨成粉,過60目篩后置于密閉環境,低溫、遮光保存[15]。參考文獻[16,17]的方法進行多酚提取,提取溫度為40 ℃,超聲波功率為300 W,液料比為1∶10、1∶20、1∶30、1∶40,乙醇體積分數為20%、40%、60%、80%,超聲波時間為20、40、60、80 min,每個提取條件重復4次。浸提完,離心(4 ℃,3 000 r/min),取上清液進行多酚含量測定。根據國家標準茶多酚測定方法(GBT8313-2002),使用沒食子酸標準品,在540 nm波長處,采用0.5 cm比色皿測定上清液吸光度。根據多酚標準曲線測定多酚質量,按照公式(1)計算多酚提取率。
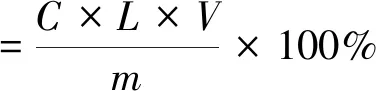
(1)
式中:C為由標準曲線計算得出的樣品質量濃度,g/mL;V為樣品溶液的體積,mL;L為樣品的總稀釋倍數;m為樣品的質量,g。
1.2.2β-環糊精對多酚的保護作用
按照“1.2.1”的方法,在1.0 g油茶葉粉末中添加不同質量β-環糊精(0.0、0.2、0.4、0.6、0.8、1.0 g),提取和測定多酚提取率并研究β-環糊精對其影響[18, 19],每個濃度設置4個重復。
1.2.3 多酚的分離純化
采用文獻[20,21]的方法進行多酚樣品的分離純化。離心后的上清液旋轉蒸發至原體積的1/3,加入等體積氯仿,振蕩萃取;取上層液體;加入等體積的乙酸乙酯萃取上層液體,在旋轉蒸發儀中蒸干,多酚固體用去離子水溶解,利用凍干儀得到精制的多酚樣品[22]。
1.2.4 多酚對植物病原真菌抑制效果研究
參考文獻[23,24]的方法進行試驗。供試植物病原真菌在PDA培養基上活化培養,待菌株即將長滿平板后,轉板繼續培養,培養至長滿整個平板后備用。在溫度為40~50 ℃的PDA培養基中,加入多酚溶液混勻,制成有效濃度為10%、5%、2%、0%的多酚PDA培養基。用內徑9 mm的打孔器打取培養好的病原真菌菌餅置于平板中央,放入培養箱中倒置培養。每個處理設置四個重復。從第三天開始,采用十字交叉法測定各菌株的菌落直徑(D),待空白對照組長滿整個平板后停止測量,按照公式(2)計算多酚的抑菌率。
抑菌率=

(2)
1.2.5 多酚對植物病原真菌菌落形態的影響
方法步驟與“1.2.4”一致,當空白對照組即將長滿整個平板時,使用相機拍攝處理組與對照組的菌落,比較各菌落顏色及形態。
1.2.6 多酚對真菌孢子萌發的影響
用打孔器打取培養好的病原真菌菌餅放在50 mL的PDB培養基中振蕩培養(28 ℃,160 r/min),對照組PDB培養基中放入空白PDA餅塊。菌液開始渾濁后,吸取0.2 mL原液,在顯微鏡下觀察孢子數量。待PDB培養液中孢子量滿足實驗要求,過濾得到孢子懸浮液,在生物顯微鏡下采用血球計數板法統計孢子數量,按照公式(3)、(4)計算數據。每個處理設置四個重復。
孢子量=孢子平均數×500
(3)
抑制率=

(4)
采用凹玻片計數法[25]觀察孢子萌發情況。在培養皿上面鋪一層濕潤的濾紙,每個凹玻片中打入60 μL的孢子懸浮液后,將凹玻片放在濾紙上面,隨即放入培養箱中培養(溫度28 ℃,光照∶黑暗 = 12∶12),每隔2 h在生物顯微鏡下觀察孢子萌發情況,按照公式(5)、(6)計算數據[26]。每個處理設置四個重復。

(5)
抑制率=

(6)
1.2.7 油茶多酚對病原真菌可溶性蛋白含量的影響
用打孔器打取培養好的病原真菌菌餅放入多酚有效濃度為10%的PDB培養基中,對照組為放入空白PDA餅塊的PDB培養基,28 ℃,160 r/min振蕩培養。待菌液開始渾濁后,在超凈工作臺過濾得到處理組原液和對照組原液。分別吸取0.01 mL對照組和處理組上清液于離心管中,隨即加入0.09 mL的蒸餾水以及0.50 mL的考馬斯亮藍G-250溶液,充分混合。室溫下靜置2 min后比色,并記錄吸光值(OD595)。通過標準曲線計算出空白對照組和多酚處理組的可溶性蛋白含量[27]。每個處理設置四個重復。
1.2.8 數據分析
使用WPS office Excel、GraphPad Prism 8.0整理數據和繪圖,利用SPSS 26.0進行數據差異顯著性分析,采用單因素ANOVA檢驗,事后比較采用Bonferroni、Tamhane分析方法。
2 結果與分析
2.1 多酚提取條件的優化
目前人們對油茶葉的利用率較低,對油茶葉多酚的研究更少,不同的提取條件影響多酚的提取率[15,28,29]。為了提高油茶葉中多酚的提取率,分析了不同料液比、乙醇濃度和超聲時間下的提取率變化。從實驗結果(見圖1)看出,多酚的最佳提取方案為1∶30 g/mL的料液比,60%的乙醇濃度以及60 min的超聲波時間,多酚提取率達14.10%。
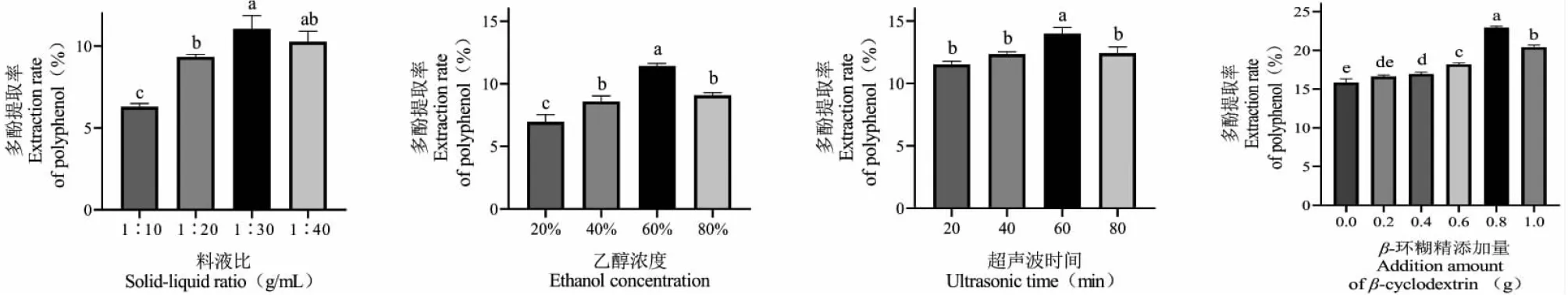
圖1 料液比、乙醇濃度、超聲波時間和β-環糊精添加量對多酚提取率的影響Fig.1 Solid-liquid ratio,ethanol concentration,ultrasonic time and addition amount of β-cyclodextrin on the extraction rate of polyphenols注:不同字母表示差異顯著(P<0.05)。Note:Different letters indicate significant differences (P <0.05).
本實驗發現在多酚提取過程中,在多酚的最佳提取方案中加入0.80 g的β-環糊精,多酚提取率可提升至22.92%。添加β-環糊精可以提高多酚的提取率,這與前人報道相一致,即β-環糊精可以和多酚形成超分子復合物,可保護多酚,避免多酚降解[19,30],從而提高多酚的提取率,但是否影響多酚對植物病原菌的抑制作用尚未可知,還需進一步研究。
2.2 多酚對常見植物病原真菌抑菌率的影響
從結果(見表1)看出多酚對不同病原真菌的抑菌率不同,濃度越高,抑菌作用越明顯。有效濃度為10%的多酚對假禾谷鐮刀菌、新月彎孢霉、鏈格孢、草莓多主棒孢霉、大麗輪枝菌、葡萄座腔菌的抑菌率達到50%以上;有效濃度為5%的多酚對假禾谷鐮刀菌、新月彎孢霉、草莓多主棒孢、大麗輪枝菌、葡萄座腔菌的抑菌率達到40%以上;有效濃度為2%的多酚對草莓多主棒孢、大麗輪枝菌、尖孢鐮孢菌苦瓜專化型的抑菌率達到30%以上。
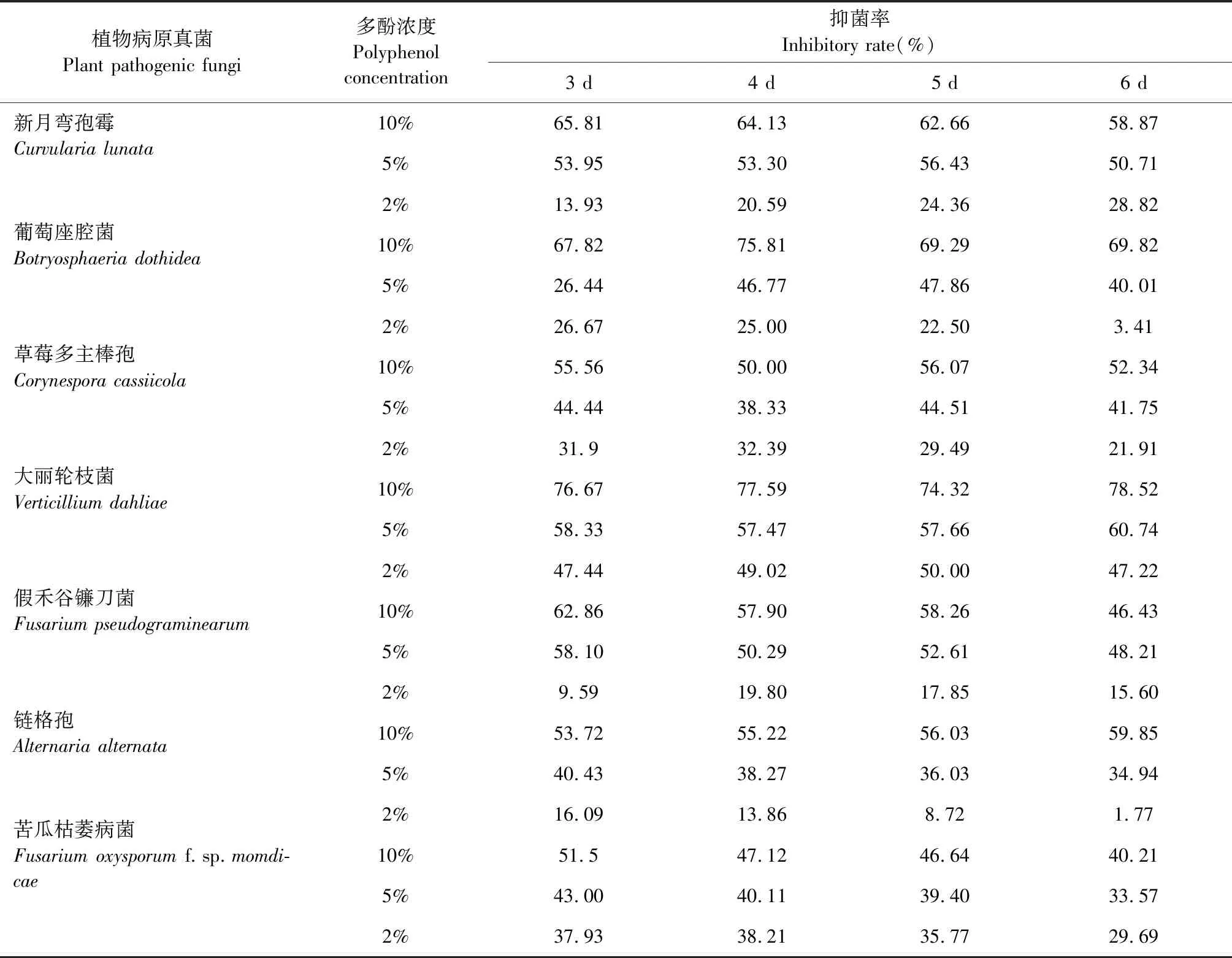
表1 多酚對植物病原真菌生長速率的影響
根據文獻可知,多酚的抑菌效果隨著濃度的增加而增強[31]。本實驗結果與先前文獻報道一致,即多酚提取物對植物病原菌具有一定的抑制作用,且多酚對不同病原菌的抑菌效果會隨著多酚有效濃度的增加而增加。
2.3 多酚抑菌機理研究
2.3.1 多酚對常見植物病原真菌菌落的影響
在研究多酚對常見植物病原真菌的抑菌作用時,發現處理組的菌落顏色發生變化,因此拍攝了植物病原真菌的菌落。結果(見圖2)顯示,經多酚處理后的菌落顏色和形態都發生變化,其中有效濃度為10%的差異最為明顯,5%的有效濃度也有較明顯差異。
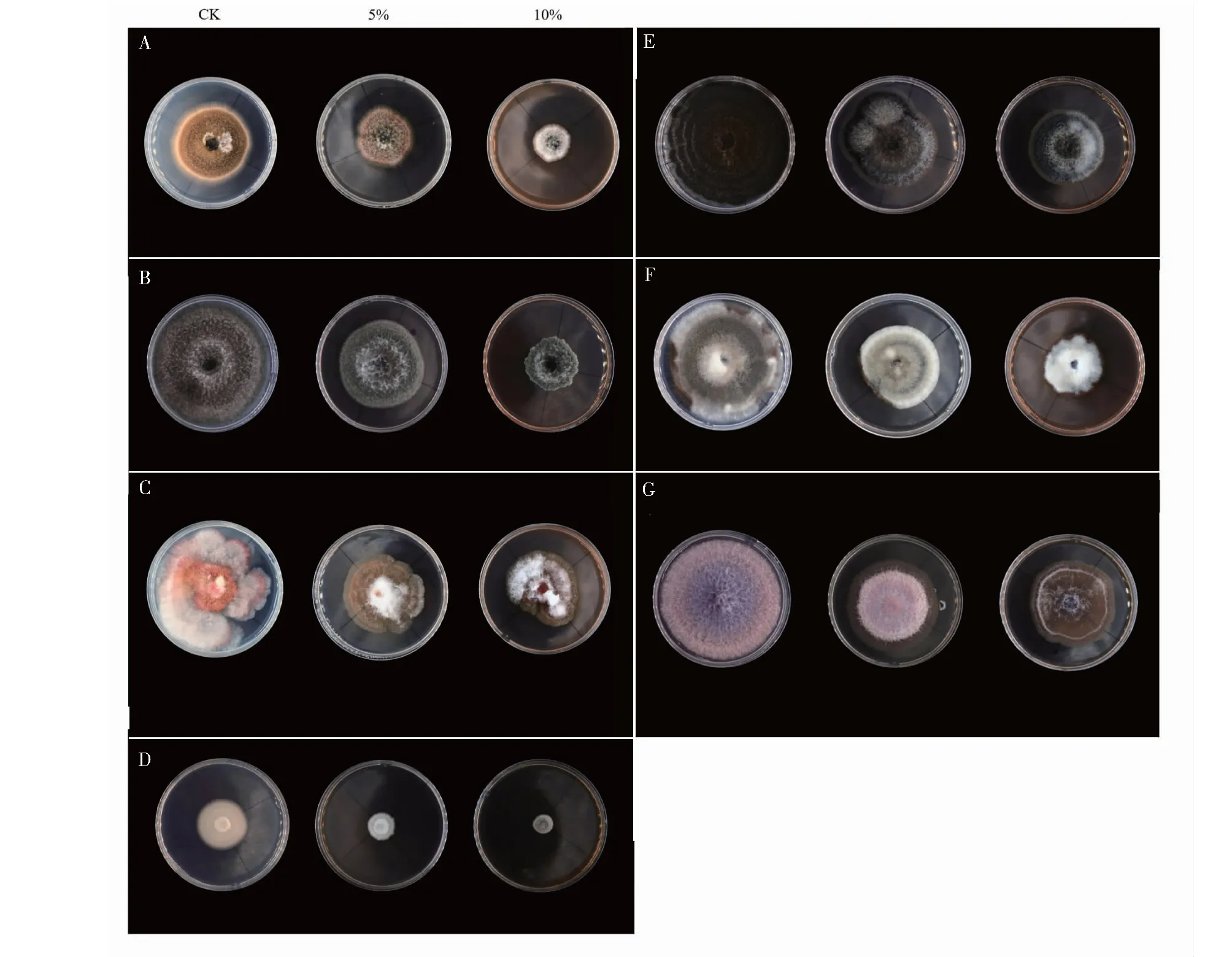
圖2 多酚對菌落形態的影響Fig.2 Effect of polyphenols on colony morphology注:CK:對照組;10%:多酚有效濃度為10%的處理組;5%:多酚有效濃度為5%的處理組;A:葡萄座腔菌;B:鏈格孢;C:假禾谷鐮刀菌;D:大麗輪枝菌;E:新月彎孢霉;F:草莓多主棒孢霉;G:尖孢鐮孢菌苦瓜專化型。Note:CK:control group;10%:polyphenol with effective concentration of 10% of treatment group;5%:polyphenol with effective concentration of 5% of treatment group;A:Botryosphaeria dothidea;B:Alternaria alternata;C:Fusarium pseudograminearum;D:Verticillium dahlia;E:Curvularia lunata;F:Corynespora cassiicola;G:Fusarium oxysporum f.sp.momdicae.
2.3.2 多酚對常見植物病原真菌孢子數量、萌發以及形態的影響
多酚處理后,菌落顏色和形態發生了改變,為了進一步探究多酚抑制常見植物病原真菌的機理,以抑菌效果最強的植病原真菌-大麗輪枝菌為研究對象,用有效濃度為10%的多酚對大麗輪枝菌進行培養,觀察植物病原真菌的產孢量以及孢子萌發情況。結果顯示,多酚處理后,大麗輪枝菌的孢子抑制率達97.79%,孢子萌發抑制率達81.77%,說明多酚對大麗輪枝菌孢子量和孢子萌發都具有抑制作用。
在探究多酚對植物病原真菌孢子量以及萌發是否有影響時,發現經多酚處理后的植物病原真菌孢子形態發生變化(見圖3)。光學顯微鏡下可見孢子形態呈現畸形,孢子變細、產生芽管,且在孢子一端或兩端聚集許多顆粒或小球等現象;而對照組孢子粗細均勻且無膨大等情況,如圖3所示。文獻報道多酚影響病原菌的菌絲形態、孢子數量,例如紅豆皮多酚提取物處理李斯特菌ATCC19119和沙門氏菌ATCC14028后,能夠觀察到菌體細胞表面出現明顯的褶皺和凹陷;烏藥葉多酚處理金黃色葡萄球菌后,可以觀察到細胞變形、皺縮和塌陷等現象[32];茶多酚處理玉米小斑病菌、香蕉炭疽病菌和蓮腐敗病菌后,能夠抑制三種病原菌的孢子萌發,并且觀察到孢子產生芽管以及在孢子的端部聚集了許多顆粒或小球,菌絲則扭曲、畸形[33],與本研究結果推測的多酚抑菌機理一致。
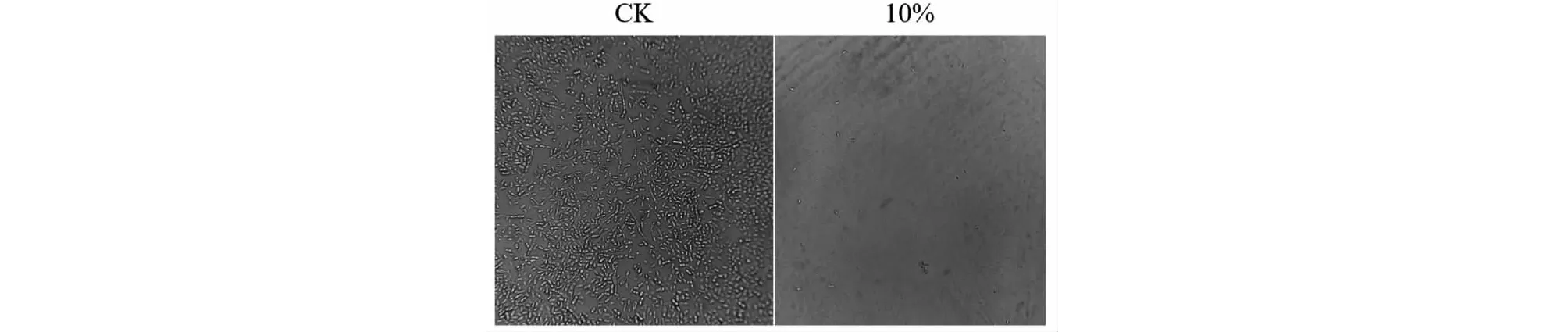
圖3 大麗輪枝菌對照組與處理組孢子形態對比Fig.3 Comparison of spore morphology between control group and treatment group of Verticillium dahlia注:CK:對照組;10%:多酚有效濃度為10%的處理組。Note:CK:control group;10%:treatment with polyphenol of 10% effective concentration.
2.3.3 多酚對常見植物病原真菌可溶性蛋白含量的影響
選擇有效濃度為10%的多酚處理后抑菌率在50%以上的病原真菌進行培養,研究多酚對植物病原菌可溶性蛋白含量的影響。從結果(見表2)可以看出,經過10%的多酚處理后的病原真菌可溶性蛋白含量從高到低依次為:新月彎孢霉>葡萄座腔菌>草莓多主棒孢霉>大麗輪枝菌>假禾谷鐮刀菌>鏈格孢,其中新月彎孢霉的可溶性蛋白增量最高,處理組的可溶性蛋白質含量約為空白對照組的5 443.00倍。經多酚處理后,新月彎孢霉、草莓多主棒孢霉、大麗輪枝菌、葡萄座腔菌和假禾谷鐮刀菌的可溶性蛋白含量增加,而鏈格孢可溶性蛋白含量減少。
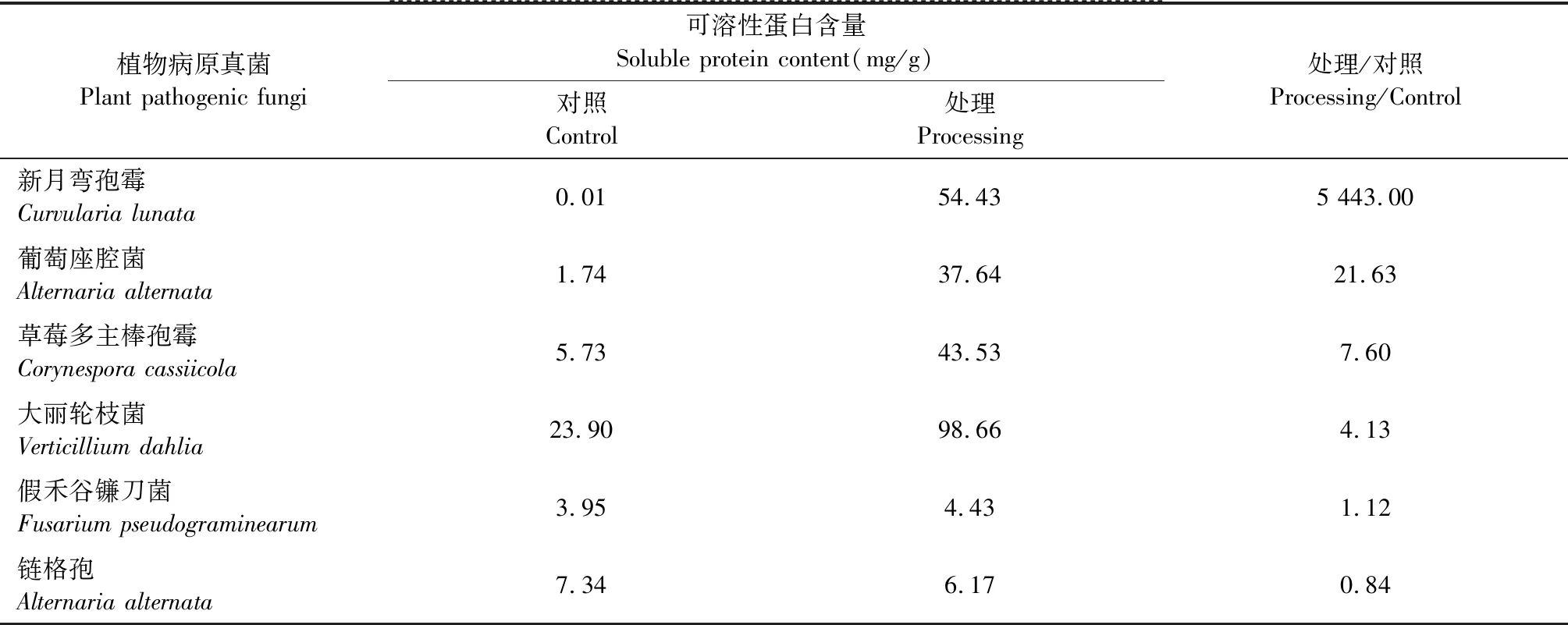
表2 多酚對植物病原真菌可溶性蛋白含量的影響
在研究茶葉中的茶多酚對細菌蛋白質含量的過程中,發現茶多酚阻礙了蛋白質的正常表達,影響了酶的催化活性及其細胞結構的組成,導致細菌喪失正常的生理活性[34,35]。前人研究及本文的研究均表明,多酚對多種植物病原真菌具有不同程度的抑制作用,多酚對不同病原真菌的抑制效果存在很大的差異,這可能與病原真菌本身的生物學特性有關。對植物病原真菌進行多酚處理后,可溶性蛋白質含量增加,可能是多酚提取物破壞了細胞膜的通透性,菌落顏色改變、菌絲形態畸形和孢子原生質外溢的現象能夠支持上述假設;也可能是病原真菌對化學脅迫做出的一種自我適應和調節方式,當這種脅迫超過植物病原真菌自身的一定極限時,可能會導致病原真菌病變或死亡。然而鏈格孢可溶性蛋白含量減少這一現象的出現,對其作用機理還未知,需進一步研究。
3 結論
油茶葉多酚提取實驗結果表明,料液比、乙醇濃度和超聲波時間對多酚的提取影響較大,應用β-環糊精能夠提高多酚的提取率。β-環糊精輔助提取油茶葉多酚的最優工藝條件為:料液比為1∶30、乙醇濃度60%、超聲波時間為60 min、β-環糊精添加量為0.80 g,該條件下多酚物質的提取率為22.92%,該研究結果可為β-環糊精輔助提取油茶葉多酚提供理論基礎和參考。本研究表明多酚提取物能夠抑制常見植物病原真菌的生長和孢子的形成與萌發,改變菌絲形態和菌落顏色,以及改變病原真菌細胞膜的通透性,這為抗真菌新藥、轉基因抗病植物的研發提供了新選擇。

