NCOA5通過調控上皮間質轉化促進卵巢癌細胞的侵襲轉移能力*
劉俊 成潔 莊珩之 王圣坦 劉曉行
(海南省人民醫院婦科,海南 海口 570311)
卵巢癌是女性生殖系統中常見的惡性腫瘤,其死亡率較高,全球每年約有14萬患者死亡[1],且由于缺乏早期臨床癥狀和有效的篩查策略,大約75%的病例確診時通常分期較晚[2]。目前減瘤手術和鉑/紫杉醇聯合化療是卵巢癌的標準療法,而隨著醫療技術的持續發展,卵巢癌的治療已在一定程度上得到改善,但是大多數患者5年生存率仍低于50%[3]。卵巢癌的發病機制尚未完全明確,核受體共激活因子5 (Nuclear Receptor Coactivator 5,NCOA5)是一種廣泛表達的核受體共同調節劑,也是雌激素受體和孤兒核激素受體共激活因子BD73的共同調節劑[4]。NCOA5基因表達異常可導致腫瘤的發生,在乳腺癌中NCOA5表達增加,促進乳腺癌細胞的增殖和侵襲轉移能力[5]。NCOA5在宮頸癌組織中表達減少,并與宮頸癌患者不良臨床病理參數和預后相關,抑制宮頸癌細胞增殖和轉移能力[6]。由此可見,NCOA5在不同腫瘤中發揮的作用可能相反,其參與了幾種惡性腫瘤的發生發展。但是它在卵巢癌中的作用仍然未知。因此本文在卵巢癌中研究NCOA5的表達及發揮的生物學功能,以表明NCOA5作為促進卵巢癌惡性進展的重要分子,具有作為抗卵巢癌治療分子靶點的潛力。
1 材料與方法
1.1 試劑來源 卵巢癌細胞株SKOV-3、A2780、OC3、HO-8910和正常卵巢上皮細胞系IOSE80購自中國科學院細胞庫(中國上海);RPMI-1640培養基、胎牛血清和青鏈霉素雙抗購自美國Gibco公司;NCOA5 siRNA購于Santa Cruz生物技術有限公司;基質膠購自美國BD公司;Transwell小室購自美國Corning公司;二辛可寧酸 (BCA)蛋白質測定試劑盒和PVDF膜購自美國Thermo試劑公司;NCOA5、E-cadherin、N-cadherin、vimentin、Slug、GAPDH和HRP偶聯的二抗購于英國Abcam公司。
1.2 細胞培養、分組和轉染 卵巢癌細胞株SKOV-3、A2780、OC3、HO-8910和正常卵巢上皮細胞系IOSE80快速復蘇后均采用RPMI-1640細胞培養基重懸,并加入胎牛血清(10%)和青霉素/鏈霉素的混合物(1%),放置在含有5% CO2的37 ℃培養箱中培養,細胞長至90%左右時,胰酶消化進行細胞傳代。SKOV3及A2780細胞生長較好時,胰酶消化后以每孔2×105個細胞接種于6孔板內,分為si-NC組和si-NCOA5組。按照Lip 2000轉染試劑說明書分別將NC siRNA和NCOA5 siRNA轉染至對應組的細胞中。轉染48 h后,通過western-blot檢測沉默效率。
1.3 Boyden實驗 將BD基質膠在4 ℃下解凍,采用無血清培養基稀釋基質膠(稀釋比例為1∶10),取10 μL稀釋的基質膠均勻加至Transwell小室的上室聚碳酸酯膜上,放置37 ℃培養箱中30 min備用。胰酶消化si-NC組和si-NCOA5組SKOV3及A2780細胞重懸,采用無血清培養基洗3次并重懸細胞,將細胞密度調整為1.5×106個細胞/mL,接種至鋪好的基質膠上,并在Transwell小室的下室中加入100 μL含有10% 胎牛血清的培養基。在培養箱中孵育12 h后,用棉簽去除上室中的細胞,將聚碳酸酯膜放置4%多聚甲醛中固定,并采用結晶紫染料染色。在顯微鏡下隨機選擇5個不重疊的視野計算侵襲細胞數目。
1.4 Transwell實驗 胰酶消化si-NC組和si-NCOA5組SKOV3及A2780細胞重懸,采用無血清培養基洗3次并重懸細胞,將細胞密度調整為1×106個細胞/mL,接種至Transwell小室的上室聚碳酸酯膜上,并在Transwell小室的下室中加入100 μL含有10% 胎牛血清的培養基。在培養箱中孵育6 h后,用棉簽去除上室中的細胞,將聚碳酸酯膜放置4%多聚甲醛中固定,并采用結晶紫染料染色。在顯微鏡下隨機選擇五個不重疊的視野計算轉移細胞數目。
1.5 Western-blot實驗 胰酶消化si-NC組和si-NCOA5組SKOV3及A2780細胞,PBS洗3次后,加入含有蛋白酶/磷酸酶抑制劑混合物的蛋白裂解液,經高速離心獲得蛋白裂解液。根據二辛可寧酸 (BCA) 蛋白檢測試劑盒檢測和計算蛋白質濃度。吸取50 μg等量的蛋白質加入十二烷基硫酸鈉 (SDS) 聚丙烯酰胺凝膠中進行電泳,并將凝膠轉移到聚偏二氟乙烯膜 (PVDF) 上。采用封閉液封閉PVDF膜上的非特異蛋白,TBST洗3次后,將PVDF膜與NCOA5、E-cadherin、N-cadherin、vimentin、Slug、GAPDH一抗稀釋液(稀釋濃度均為1∶5000)于4 ℃中孵育過夜。TBST洗3次后,將PVDF膜與兔、鼠二抗(稀釋濃度均為1∶8000)孵育。采用ECL試劑盒檢測蛋白條帶。
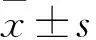
2 結果
2.1 NCOA5在卵巢癌細胞系中表達上調 Western blot檢測NCOA5在卵巢癌細胞株SKOV-3、A2780、OC3、HO-8910中的表達分別為0.89±0.08、0.91±0.10、0.19±0.03、0.21±0.04,顯著高于在正常卵巢上皮細胞系IOSE80中的表達(0.08±0.03)(F=103.79,P<0.001)。其中在SKOV-3和A2780細胞中的表達相對較高(P<0.05),見圖1。
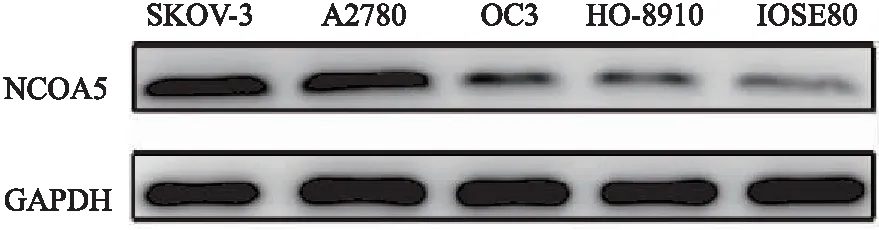
圖1 Western blot檢測NCOA5蛋白在卵巢癌細胞中的表達
2.2 NCOA5 siRNA轉染卵巢癌細胞效果 Western-blot結果顯示,NCOA5蛋白在si-NC組和si-NCOA5組SKOV3細胞中的表達分別為0.31±0.04和0.11±0.02,與si-NC組相比,si-NCOA5組卵巢癌細胞中NCOA5的表達顯著降低(t=7.746,P=0.001),見圖2A。在si-NC組和si-NCOA5組A2780細胞中的表達分別為0.40±0.08和0.10±0.03,與si-NC組相比,si-NCOA5組卵巢癌細胞中NCOA5的表達顯著降低(t=6.082,P=0.002),見圖2B。

圖2 Western-blot檢測顯示與si-NC組相比,si-NCOA5組細胞中NCOA5的表達顯著降低
2.3 NCOA5 siRNA對細胞侵襲能力的影響 Boyden實驗檢測顯示,si-NC組和si-NCOA5組SKOV3穿膜細胞數目分別為67.33±6.11和41.67±4.98,與si-NC組相比,si-NCOA5組卵巢癌細胞侵襲能力顯著降低(t=7.974,P<0.001),見圖3A。si-NC組和si-NCOA5組A2780穿膜細胞數目分別為72.67±7.32和22.67±5.98,與si-NC組相比,si-NCOA5組卵巢癌細胞侵襲能力顯著降低(t=9.162,P<0.001),見圖3B。
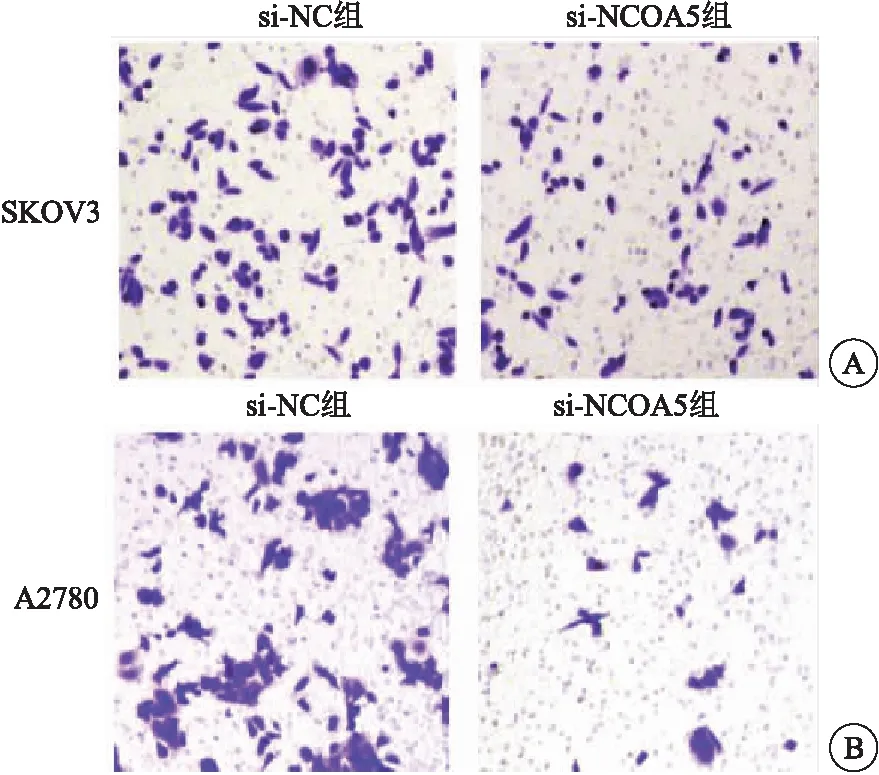
圖3 Boyden實驗檢測顯示與si-NC組相比,si-NCOA5組SKOV3細胞侵襲能力顯著降低
2.4 NCOA5 siRNA對細胞轉移能力的影響 Transwell實驗檢測顯示,si-NC組和si-NCOA5組SKOV3穿膜細胞數目分別為73.67±9.04和40.67±5.78,與si-NC組相比,si-NCOA5組卵巢癌細胞轉移能力顯著降低(t=15.752,P<0.001),見圖4A。si-NC組和si-NCOA5組A2780穿膜細胞數目分別為88.93±8.96和33.64±7.43,與si-NC組相比,si-NCOA5組卵巢癌細胞轉移能力顯著降低(t=8.227,P<0.001),見圖4B。
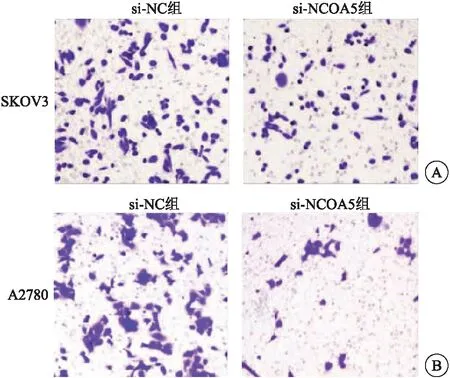
圖4 Transwell檢測顯示與si-NC組相比,si-NCOA5組SKOV3細胞轉移能力顯著降低
2.5 NCOA5 siRNA對細胞EMT的影響 Western-blot檢測結果顯示,與si-NC組相比,si-NCOA5組卵巢癌細胞SKOV3中EMT相關蛋白E-cadherin表達增加,N-cadherin、vimentin和Slug蛋白表達減少(均P<0.05),見圖5A。與si-NC組相比,si-NCOA5組卵巢癌細胞A2780中EMT相關蛋白E-cadherin表達增加,N-cadherin、vimentin和Slug蛋白表達減少(均P<0.05),見圖5B。
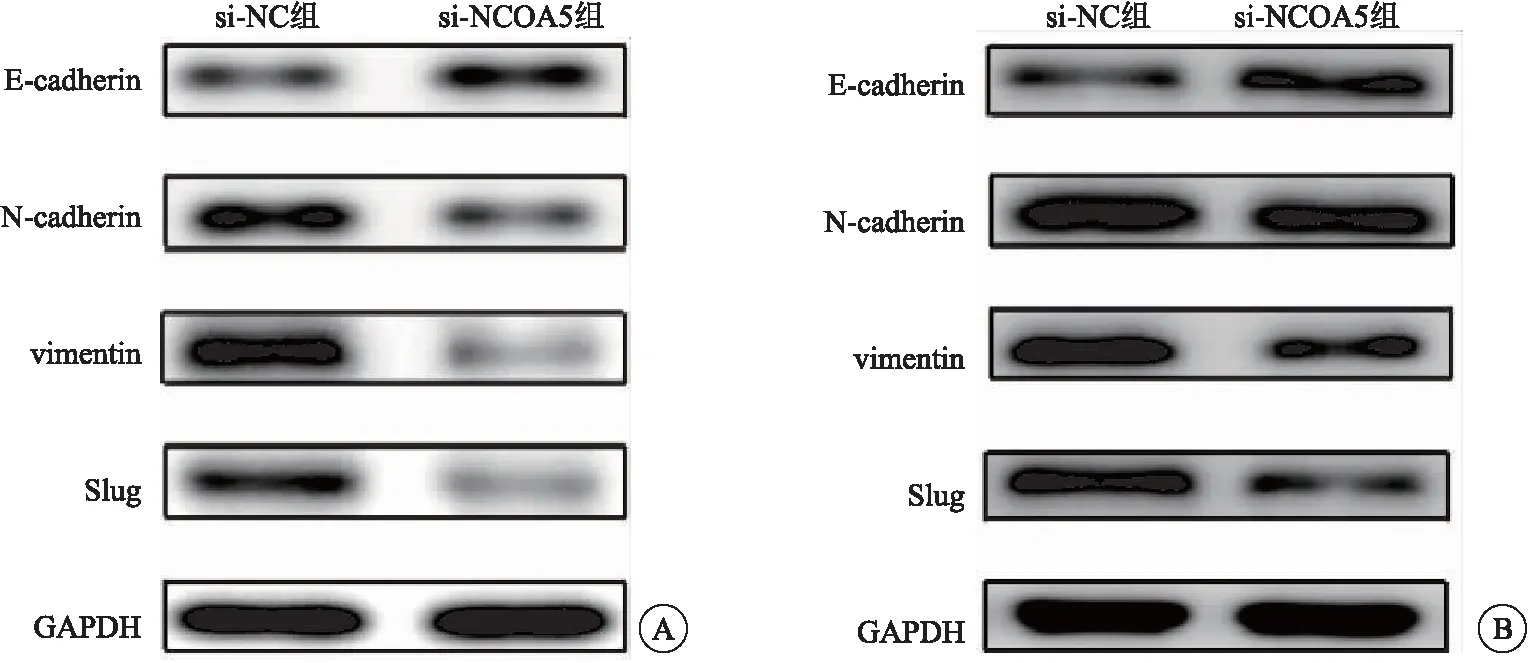
圖5 western-blot檢測顯示與si-NC組相比,si-NCOA5組SKOV3細胞中EMT相關蛋白E-cadherin表達增加,N-cadherin、vimentin和Slug蛋白表達減少
3 討論
卵巢癌嚴重威脅女性患者生命健康,其發病機制也尚未完全明確。研究顯示基因表達改變在卵巢癌的發生發展中發揮重要作用[7],因此研究在卵巢癌惡性進展中發揮關鍵作用的分子對尋求抗卵巢癌治療的分子靶向藥物以改善患者預后至關重要。NCOA5是一種核受體核心調節劑,與α和β雌激素受體相互作用,可以調節雌激素受體α介導的轉錄活性[8]。此外,NCOA5與腫瘤抑制劑TAT相互作用蛋白相互作用,以調節癌基因C-MYC的轉錄,以促使腫瘤的發生[9]。已有研究顯示NCOA5 在乳腺癌、宮頸癌、結直腸癌和甲狀腺乳頭狀癌等常見腫瘤中表達異常,其中NCOA5在結直腸癌和肝細胞肝癌中高表達,與腫瘤患者預后較差相關,并促進腫瘤細胞增殖和侵襲轉移能力,以發揮癌基因的作用[10-11]。在宮頸癌和甲狀腺乳頭狀癌中NCOA5 表達降低,低表達NCOA5的宮頸癌和甲狀腺乳頭狀癌患者預后較差,抑制宮頸癌細胞增殖、侵襲和轉移作用,以發揮抑癌作用[6,12]。表明NCOA5 在腫瘤的惡性進展中充當“雙面”角色,但是NCOA5在卵巢癌中的研究鮮有報道。
本研究在卵巢癌細胞系中檢測發現NCOA5中表達升高,提示NCOA5在卵巢癌中發揮促癌作用,與NCOA5在乳腺癌和結直腸癌組織水平的表達具有一致性。但是本研究未在卵巢癌組織水平檢測NCOA5的表達情況,將在后續進行卵巢癌組織樣本的收集并進行研究。在乳腺癌、結直腸癌和肝細胞肝癌等腫瘤中,相關研究顯示NCOA5與腫瘤細胞增殖和侵襲、轉移能力相關[5,10,13]。本研究在卵巢癌細胞系SKOV-3和A2780中干擾NCOA5的表達,生物學功能顯示抑制NCOA5的表達后,卵巢癌細胞的侵襲和轉移能力降低。表明NCOA5促進卵巢癌的惡性進展,可能是宮頸癌惡性進展的關鍵基因,但是NCOA5發揮的作用機制仍需探討。
過往研究顯示,NCOA5可以通過調控Notch3、PI3K/AKT、p21(WAF1/CIP1)等信號通路參與腫瘤的進展[6,9,14]。其中在乳腺癌和肝細胞肝癌中干擾NCOA5的表達,通過抑制上皮間質轉化(Epithelial-mesenchymal transition,EMT)抑制腫瘤細胞的侵襲和轉移[5,13]。而EMT被認為是腫瘤從發生到轉移的主要驅動力,并且在誘導腫瘤惡性進展和耐藥性方面發揮關鍵作用[15-16]。EMT包含粘附連接和底物極性的喪失以及獲得間充質特征,如紡錘形細胞形態和肌動蛋白應激纖維的重組、增強細胞運動和侵襲能力等過程[17]。在分子水平上,EMT的主要標志是E-cadherin表達降低,這導致細胞連接減弱,隨后細胞之間脫離,以至單細胞遷移增加[18]。E-cadherin的缺失經常與N-cadherin表達增加相結合,這被認為有助于基質導向的細胞粘附譜,從而導致運動、侵入性和轉移性細胞表型[19]。同時在EMT過程中,上皮細胞失去了極性轉化為間充質細胞,并伴隨著vimentin[20]和Slug蛋白表達增加[21],本研究檢測發現干擾NCOA5的表達后,E-cadherin蛋白的表達增加,N-cadherin、vimentin和Slug蛋白的表達減少。表明干擾NCOA5的表達是通過減弱EMT抑制卵巢癌的侵襲和轉移能力。
4 結論
NCOA5在卵巢癌細胞系中高表達,并有促進卵巢癌細胞侵襲和轉移能力,其作用機制可能是通過調控EMT發揮作用,NCOA5具有成為卵巢癌治療分子靶點的潛力。

