雪蓮SikCDPK1 基因的表達特征和蛋白激酶活性分析
劉玉玲,朱新霞,呂新華,孫輝
(1. 石河子大學生命科學學院,綠洲城鎮與山盆系統生態兵團重點實驗室,新疆 石河子 832003;2. 烏魯木齊職業大學,新疆 烏魯木齊 830000)
鈣依賴蛋白激酶(calcium-dependent protein kinase, CDPKS)是Ca2+信號轉導途徑中的主要感受器和效應器,目 前 陸 續 在 擬 南 芥(Arabidopsis thaliana)[1]、水 稻(Oryza sativa)[2]、毛 果 楊(Populus trichocarpa)[3]、黃 瓜(Cucumis sativus)[4]、番茄(Lycopersicon esculentum)[5]、甜瓜(Cucumis melo)[6]、辣椒(Capsicum annuum)[7]、山核桃(Carya cathayensis)[8]等多種植物中發現,是植物中研究較多的一類多基因家族蛋白激酶,在植物生長發育和逆境響應中發揮著重要作用。CDPKs在植物多個器官廣泛表達。如擬南芥AtCPK12在根、莖、葉、花和成熟果莢中表達,在干種子中不表達[9],而BdCDPK9、BdCDPK18、BdCDPK3、BdCDPK22和BdCDPK10只在種子中表達,BdCDPK8和BdCDPK19在 根 和 種 子 中 表達,BdCDPK2和BdCDPK25在 莖 和 花 中 表達,BdCDPK7和BdCDPK17在根和莖中表達[10]。
脫落酸(abscisic acid,ABA)、赤霉素(gibberellin,GA3)、水楊酸(salicylic acid,SA)、H2O2是逆境防御系統中重要的信號分子,許多植物CDPKS可通過參與信號分子介導的信號轉導,在植物防御和發育過程中發揮重要作用。如擬南芥AtCPK4和AtCPK11可通過參與Ca2+介導的ABA 信號通路,調控種子萌發、幼苗生長、氣孔保衛細胞調節和植物對鹽脅迫的耐受性[11]。AtCPK10通過參與ABA 誘導的氣孔關閉響應干旱脅迫[12],AtCPK8及其互作蛋白CATALASE3 參與ABA 和H2O2介導的信號轉導,通過維持H2O2穩態在響應干旱脅迫中起重要作用[13]。水稻OsCPK9通過參與SA 介導的信號轉導,在抗病防御中起作用[14]。水稻OsCDPK13基因主要在葉鞘和愈傷組織中表達,GA3處理后,該基因表達量和蛋白質大量積累[15]。轉AtCPK30基因擬南芥被低濃度GA3誘導后,能促進植株根系生長[16]。
蛋白激酶活性是CDPK 發揮作用的前提,CDPK 激酶區具有典型的Ser/Thr 蛋白激酶序列,位于此區中的Lys 殘基極為保守,是ATP 的結合位點。自抑制區富含堿性氨基酸殘基,能以底物的形式與激酶域結合,抑制激酶的活性。調控區含有與Ca2+結合的EF 手型結構域,這是CDPK 僅依賴于Ca2+而不依賴鈣調素的原因[16]。當胞內Ca2+濃度較低時CDPK 激酶區就和自抑制區相結合,形成自抑制,CDPK 激酶活性很低或沒有;當發育和環境信號引發胞內Ca2+濃度升高時,CDPK 調控區EF 手型蛋白就與Ca2+結合,使調控區蛋白結構域構象發生變化,自抑制區與激酶活性結構域分開,自抑制作用解除,恢復蛋白激酶活性,將Ca2+信號向下游傳導和級聯放大,參與調控植物生長發育、信號傳遞、逆境響應和免疫應答等[17]。
天山雪蓮(Saussurea involucrata)能在極端環境生長和開花,蘊含著豐富的抗逆基因資源。本實驗室前期從天山雪蓮中克隆獲得SikCDPK1基因,發現它可以增強轉基因煙草(Nicotiana tabacum)的耐低溫、干旱脅迫能力[18],而有關SikCDPK1基因的組織表達、是否參與對逆境信號分子的響應及蛋白激酶活性等未見相關報道。本研究擬通過對天山雪蓮SikCDPK1基因在不同組織器官的表達、對信號分子CaCl2、ABA、GA3、SA、H2O2的誘導響應模式、SIKCDPK1 激酶活性分析和 SIKCDPK1 亞細胞定位等研究,揭示SikCDPK1基因的表達特征和蛋白激酶活性,為深入研究SikCDPK1基因的表達機制和功能奠定基礎。
1 材料與方法
1.1 試驗材料
1.1.1 植物材料 本試驗于2018-2020 年在石河子大學生命科學學院綠洲城鎮與山盆系統生態兵團重點實驗室開展。天山雪蓮種子用1% KMnO4溶液浸泡12 h,蒸餾水沖洗3~4 次。用75%的酒精對種子表面消毒1 min,0.1% HgCl2(w/v) 溶液消毒7 min。無菌水沖洗3~4 次,用無菌濾紙吸去種子表面多余的水分后,將種子均勻散播在1/2 MS 固體培養基(825 mg·L-1NH4NO3、950 mg·L-1KNO3、0.83 mg·L-1KI、27.8 mg·L-1FeSO4·7H2O 和0.5 mg·L-1煙酸等)表面,置于16 ℃光照強度為60 μmol·m-2·s-1,16 h 光照/8 h 黑暗的條件下培養45 d,將長出幼莖與幼葉的幼苗,煉苗馴化后,移栽至營養土中,置于光照培養箱中培養3 個月。分別取生長45 d 天山雪蓮組培苗的幼莖、幼葉與生長3 個月大的栽培苗的根、莖、葉于液氮中速凍后,置于-80 ℃冰箱保存。
1.1.2 主要試劑 普通瓊脂糖凝膠DNA 回收試劑盒、RNA 提取試劑盒、Revert-Aid First Strand cDNA Synthesis Kit、qPCR 試劑盒、質粒小提試劑盒購自北京天根生物科技有限公司,T4DNA ligase、限制性內切酶KpnⅠ和SalⅠ購自北京全式金生物技術有限公司,植物表達載體pBI121-GFP質粒由本實驗室保存。
1.2 試驗方法
1.2.1 天山雪蓮不同組織器官SikCDPK1基因的表達 分別取-80 ℃冰箱保存的生長45 d 天山雪蓮的幼莖、幼葉與生長3 個月后雪蓮植株的根、莖、葉,使用TaKaRa 公司RNA 提取試劑盒,按照產品說明書的步驟提取天山雪蓮總RNA。按照20 μL 反應體系: RNA(3.5 μL)、Oligo-dT18(1 μL)、dNTP(1 μL)、RNase inhibitor (1 μL)、5×Reverse Transcriptase M-MLV Buffer(4 μL)、RNase-free dd H2O(9.5 μL),42 ℃水浴90 min,迅速轉移至70 ℃水浴15 min,完成cDNA 第一鏈的合成,-20 ℃保存。以表1 中的雪蓮內參基因引物GAPGH-F、GAPGH-R與目的基因引物SikCDPK1-qF、SikCDPK1-qR,進行RT-qPCR 反應。反應體系:cDNA(1 μL)、GAPGH-F/SikCDPK1-qF(0.25 μL)、GAPDH-R/SikCDPK1-qR(0.25 μL)、SYBR Green PCR Master Mix(5 μL)、ddH2O(3.5 μL),反應程序:95 ℃預變性10 min;95 ℃ 10 s,62 ℃ 30 s,40 個循環。每個樣品設置3 個重復。
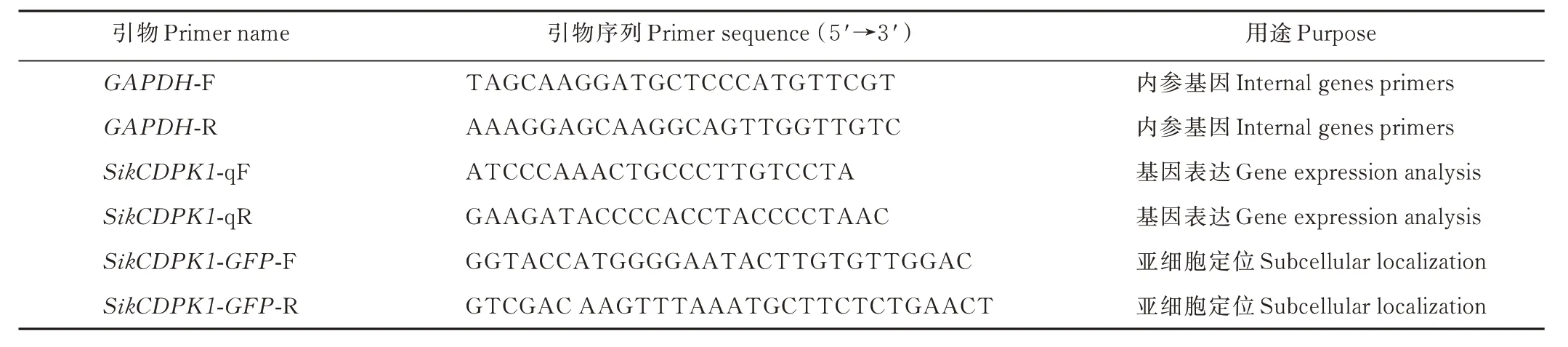
表1 引物Table 1 The primers
1.2.2 CaCl2、ABA、GA3、SA、H2O2誘導后基因表達分析 選取生長3 個月,長勢一致且生長健康的整株天山雪蓮苗,沖洗表面的營養土后,分別置于MS 液體培養基(1650 mg·L-1NH4NO3、1900 mg·L-1KNO3、0.83 mg·L-1KI、27.8 mg·L-1FeSO4·7H2O、0.5 mg·L-1煙酸等)中,生長48 h,使其根系損傷恢復。將苗取出后,分別置于含5 mmol·L-1CaCl2、100 μmol·L-1ABA、100 μmol·L-1GA3、1 mmol·L-1SA、100 μmol·L-1H2O2的MS 培養液中,分別處理: 0、1、3、6、12、24 h 后,提取樣品總RNA,反轉錄后,使用表1 中的SikCDPK1-qF、SikCDPK1-qR 引物進行RT-qPCR 檢測SikCDPK1基因表達量,每個樣品重復3 次。
1.2.3 SIKCDPK1 蛋白誘導表達與純化 將含有重組原核表達載體PET28a-SikCDPK1 的菌液以1∶100(v/v)接種到100 mL 新鮮LB 液體培養基(10 g·L-1胰蛋白胨、5 g·L-1酵母提取物、10 g·L-1氯化鈉)中活化,培養至OD600達到0.4,加入1 mmol·L-1異丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG),37 ℃分別誘導表達4、5、6、7、8、9、10 h 后,4 ℃ 6000 r·min-1離心10 min 富集菌體,向沉淀中加入1 mL 0.01 mmol·L-1預冷的PBS 懸浮后加入1 mL 5×SDS 電泳緩沖液,沸水浴10 min,放至室溫12000 r·min-1離心5 min,取上清液進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。根據優化后的菌株表達條件擴大培養菌液,6000 r·min-1離心10 min,收集菌體,向其中加入5 mL 含有20 mmol·L-1磷酸鈉、500 mmol·L-1NaCl、30 mmol·L-1pH 7.4 咪唑的結合緩沖液,在室溫下攪拌30 min,超聲破碎10 min。將組氨酸標記蛋白純化柱(Histrap FF Column)與層析裝置連接好后,將蒸餾水注入恒流泵的管道,用注射器逐滴地往層析柱中注水,直到蒸餾水從管道的另一個出口流出來。將處理好的樣品上柱后,用結合緩沖液沖洗,此時恒流泵的流速為1 mL·min-1。再向柱內加入含有20 mmol·L-1磷酸鈉、500 mmol·L-1NaCl 與不同濃度的咪唑洗脫液緩沖洗脫純化后,取10 μL 純化蛋白進行電泳檢測。
1.2.4 體外激酶活性測定 參照Promega 公司Kinase GLOTMLuminescent Kinase Assay 試劑盒說明書,在離心管中加入含有30 mmol·L-1Tris-HCl(pH 7.5)、0.5 mmol·L-1DTT、100 mmol·L-1NaCl、10 μmol·L-1ATP、100 mmol·L-1CaCl2的酶促反應緩沖液和底物HisⅢ(50 μg·mL-1),再加入10 μL 純化后的重組蛋白,使反應總體積達到200 μL,置于30 ℃水浴鍋開始反應。分別取20 μL 反應0、5、10、15、20、25、30、40、50 min 的反應混合物,沸水浴1 min 終止反應。將反應物冷卻至室溫后,轉移到96 孔酶標板中,并向板中加入20 μL 試劑盒中的Kinase-Glo Reagent,使用酶標儀(LDSY96A,山東)在Luminescent 狀態下檢測發光強度,每個數值重復讀取3 次。將上述酶促反應液中的Ca2+換成2 mmol·L-1EGTA(ethylene glycol tetraacetic acid),相同方法檢測發光強度。
使用在線網站http://maxchelator.stanford.edu/CaEGTA-NIST.htm 計算反應液中的Ca2+濃度,在Ca2+濃度為0、8.4、14.0、34.0、51.0、79.0、135.0 nmol·L-1時,分別檢測發光強度。在底物HisⅢ濃度為0、10、20、50、100、250、500 μg·L-1時,分別檢測發光強度。用不同濃度下樣品的發光值與對照的差值來表示酶活性的改變量,使用GraphPad Prism 9.1 軟件分析底物為HisⅢ時SIKCDPK1 激酶的米氏常數(michaelis constant,Km)。
1.2.5 亞細胞定位 在NCBI 獲得SikCDPK1基因序列,Primer 5.0 設計帶有KpnⅠ和SalⅠ為酶切位點的引物(表1)SikCDPK1-GFP-F 與SikCDPK1-GFP-R,擴增出目的基因片段后,連接至pMD19T 載體,將測序成功的質粒命名為pMD19T-SikCDPK1。用KpnI 和SalI 限制性內切酶酶切重組質粒pMD19T-SikCDPK1和PBI121-GFP載體。酶切產物凝膠電泳檢測后回收純化,連接后從含卡那霉素(kanamycin, kan)50 μg·mL-1抗性的培養基中挑單克隆,進行菌液PCR 檢測。將檢測結果為陽性的pBI121-SikCDPK1-GFP質粒,采用電轉法轉入農桿菌GV3101 感受態細胞,在含有利福平(rifampicin, Rif)50 μg·mL-1、kan 50 μg·mL-1、慶大霉素(gentamicin,Gen)50 μg·mL-1的LB 固體培養基上篩選后,將PCR 檢測為陽性的pBI121-SikCDPK1-GFP的農桿菌菌液,采用Li 等[19]的方法侵染新鮮洋蔥(Allium cepa)鱗莖表皮細胞,暗培養2 d 后,制作臨時裝片,先在光學顯微鏡(MSD701,廣州)下觀察,后轉移至激光共聚焦顯微鏡(LSM510,德國)下觀察。
1.3 數據處理
使用2-??Ct法[20]計算出天山雪蓮SikCDPK1基因在不同組織器官的表達量,使用SPSS 18.0 軟件對試驗數據進行LSD 多重方差分析,顯著性測驗設定為P<0.05(顯著水平)和P<0.01(極顯著水平),使用Excel 和GraphPad Prism 9.1 制作圖表。檢測蛋白激酶活性過程中,對照與樣品在酶標儀檢測到光信號強度的差值與激酶活性成正比,差值越大酶活性越大。利用GraphPadprism 中的enzyme kinetics Michaelis-Menten 計算SIKCDPK1 的Km值。
2 結果與分析
2.1 SikCDPK1 基因組織特異性分析
通過RT-qPCR 探究SikCDPK1基因在天山雪蓮根、莖、葉、幼葉、幼莖及種子中的表達情況。SikCDPK1 基因在種子中表達量最高,其他依次是葉、莖、根、幼葉,幼莖中表達量最低(圖1)。種子、葉、莖、根中的基因表達量和幼莖相比差異極顯著,幼葉中的基因表達量和幼莖中的基因表達量相比,達到顯著差異。說明SikCDPK1基因在雪蓮種子、葉、莖、根中都存在,但在不同器官表達有差異。
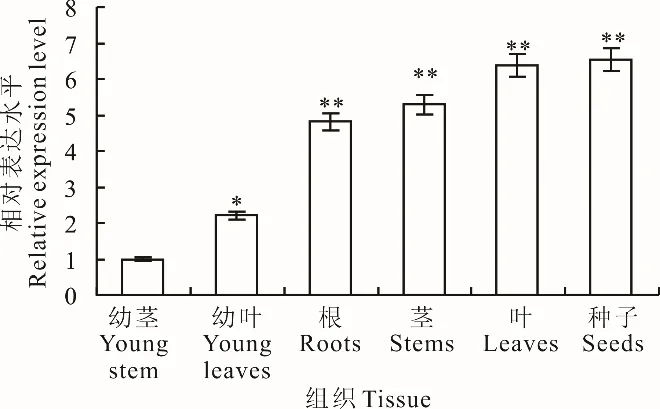
圖1 SikCDPK1 基因組織特異性表達Fig.1 Tissue specific expression of SikCDPK1 gene
2.2 CaCl2、ABA、GA3、SA 及H2O2 誘導的基因表達分析
CaCl2處 理 后,SikCDPK1基 因 表達 呈 現“上升-快速下降-上升”的趨勢(圖2),在6 h 達到峰頂,表達量為CK 的17.549 倍,與CK 相比達極顯著差異水平。在12 h 達到峰底,峰底的表達量為CK的1.284 倍,24 h 又升高,表達量 為CK 的1.509 倍,達顯著差異水平。
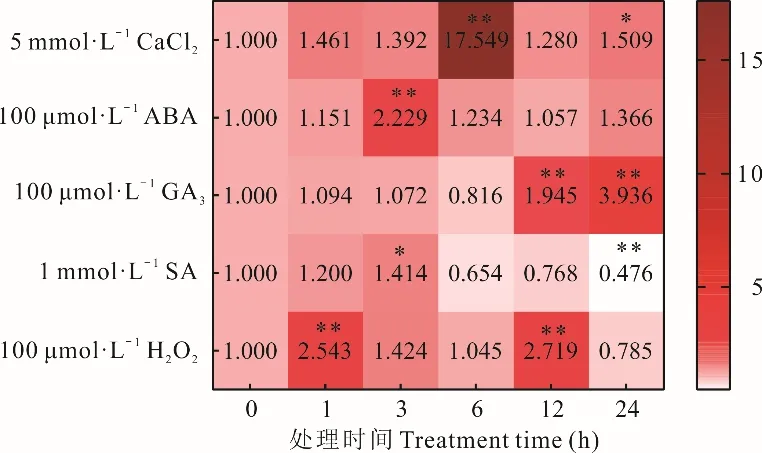
圖2 SikCDPK1 基因的表達特性Fig.2 Expression characteristics of SikCDPK1
ABA 處 理 后,SikCDPK1基 因 表達 呈 現“上升-下降-慢上升”的趨勢(圖2),在3 h 達到峰頂,表達量為CK 的2.229 倍,與CK 相比達極顯著差異水平,在12 h 達到峰底,峰底的表達量為CK 的1.057 倍,24 h 又升高,表達量為CK 的1.366 倍。
GA3處理后,SikCDPK1基因表達呈現“略微上升-下降-上升”趨勢(圖2),在6 h 達到峰底,峰底的表達量為CK 的0.816 倍,后面持續上升,12 h 表達量為CK 的1.945 倍,與CK 相比達極顯著差異水平。在24 h 達到峰頂,表達量為CK 的3.936 倍,達極顯著差異水平。
SA 處理后,基因表達模式整體呈現“上升-下降”的趨勢(圖2),在3 h 達到峰頂,表達量為CK 的1.414 倍,與CK 相比達顯著差異水平。后面持續下降,24 h 表達量最低,為CK 的0.476 倍,達顯著差異水平。
H2O2處理后,其基因表達量呈現出“上升-下降-上升-下降”趨勢(圖2),分別在1 和12 h 達到峰頂,表達量分別為CK 的2.543 和2.719 倍,與CK相比達到極顯著差異水平。在6 h 達到第一個峰底,峰底的表達量為CK 的1.045 倍。在24 h 達到第二個峰底,峰底的表達量為CK 的0.785 倍。
以上說明SikCDPK1基因表達除受Ca2+影響外,還受ABA、GA3、SA、H2O2的影響。
2.3 SIKCDPK1 蛋白的表達與純化
將37 ℃誘導8 h 的高表達蛋白,使用Histrap FF Column 層析柱,進行Ni2+親和層析純化,分別用200、500、600 mmol·L-1濃 度 的 咪 唑 液 洗 脫,經SDS-PAGE 檢 測 后,發 現500 mmol·L-1咪 唑 洗 脫純化后的蛋白產物濃度與純度比較高,獲得大小為63.5 KD 的純化蛋白(圖3)。

圖3 SIKCDPK1 重組蛋白純化Fig.3 Purification of SIKCDPK1 recombinant protein
2.4 體外激酶活性分析
ATP 與熒光素酶結合,使反應液由不發光狀態轉變為發光狀態,發光值越大表明ATP 含量越高,隨著酶促反應時間的延長,ATP 被消耗,發光值越來越小,因此酶活力與發光值成反比,本研究通過檢測不同時間段溶液中的發光值,利用發光值的改變量(對照與樣品之間相對光單位RLU 的差值),評估反應液中的ATP 含量,判斷激酶的活性。有Ca2+時,隨著反應時間的延長,ATP 逐漸被消耗,發光值越來越低(圖4)。而換成Ca2+螯合劑EGTA 時,發光值隨時間的延長沒有發生明顯的變化。說明有Ca2+時,SIKCDPK1 具有激酶催化活性,Ca2+被螯合劑EGTA 阻斷后,SIKCDPK1 幾乎沒有激酶活性。

圖4 SIKCDPK1 激酶活性Fig.4 Kinase activity of SIKCDPK1
SIKCDPK1 激酶活性隨著Ca2+濃度的升高而呈“S”型的變化趨勢(圖5),當Ca2+濃度為14.0~79.0 nmol·L-1時,SIKCDPK1 激 酶 活 性 快 速 升 高,濃 度 為79.0~135.0 nmol·L-1時,SIKCDPK1 激 酶 活 性 升 高 速 率 減 慢,SIKCDPK1 激酶活性達到最大的1/2 所需要的Ca2+濃度(K0.5)為48.7 nmol·L-1。
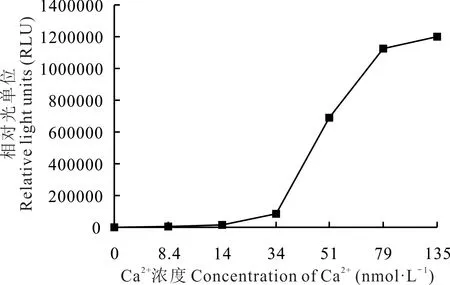
圖5 Ca2+對SiKCDPK1 活性的激發Fig.5 Trigger action of SIKCDPK1 activity by Ca2+
檢測不同濃度HisⅢ發生酶促反應時的發光值,發現當底物HisⅢ濃度為0~100 μg·mL-1時,其酶促反應速率急劇增加(圖6),濃度為100~250 μg·mL-1時,反應速率平穩,濃度為250~500 μg·mL-1時,反應速率增加較慢,500 μg·mL-1時達到最大反應速率。用不同濃度HisⅢ發生酶促反應時的發光值與不加HisⅢ時的發光值的差值代表酶活性的改變量,經GraphPad Prism 9.1 軟 件 中 的 enzyme kinetics Michaelis-Menten 計 算 得 到SIKCDPK1 的Km值 為43.8 μg·mL-1。
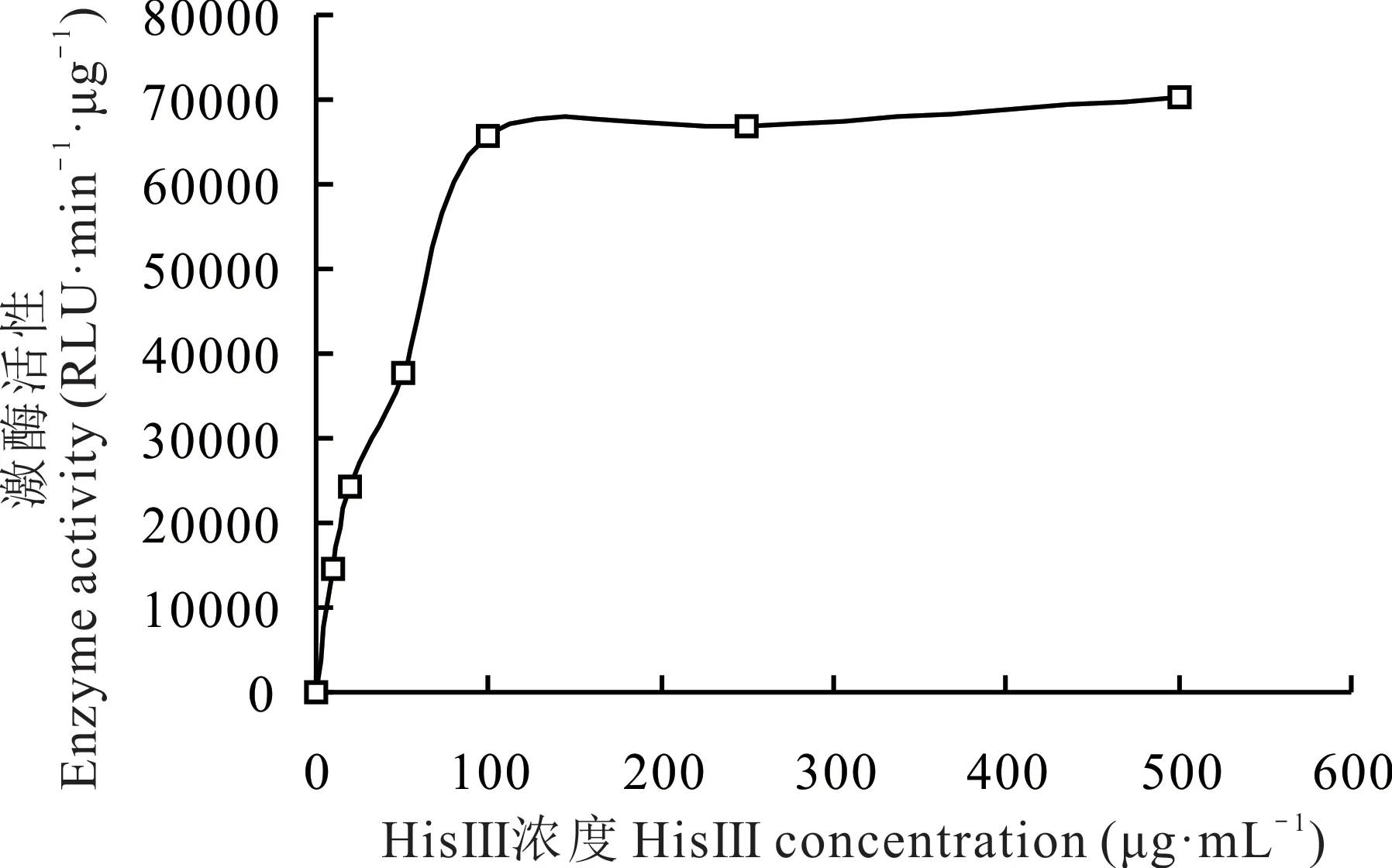
圖6 底物HisⅢ的Km值Fig.6 The Km value of substrate HisⅢ
2.5 SIKCDPK1 蛋白亞細胞定位
為探究SIKCDPK1 的亞細胞定位,將SikCDPK1 基因與綠色熒光蛋白基因GFP融合后,構建了植物融合表達載體pBI121-SikCDPK1-GFP,通過農桿菌介導法侵染洋蔥鱗莖表皮細胞后,在激光共聚焦顯微鏡下觀察熒光。如圖7 所示,侵染后的洋蔥表皮細胞能夠檢測到較強的熒光信號,并且綠色熒光都集中在細胞核上,其余部位并未檢測到綠色熒光信號。對照35S-GFP在細胞膜與細胞核內均有綠色熒光分布,而未做侵染的洋蔥表皮細胞內檢測不到熒光信號,因此判定SIkCDPK1 蛋白主要定位在細胞核。

圖7 SikCDPK1-GFP 融合蛋白亞細胞定位Fig.7 Subcellular localization of SikCDPK1-GFP fusion protein
3 討論
實時熒光定量PCR 結果表明,SikCDPK1基因表達量由高到低依次是種子、葉片、莖、根、幼葉、幼莖,說明天山雪蓮種子、葉片、莖、根中都存在SikCDPK1基因,但該基因在各器官表達水平不一樣,成熟組織中的基因表達量高于幼嫩組織,葉片中的基因表達量高于莖中的,說明SikCDPK1基因表達沒有明顯的組織特異性。
本研究發現SikCDPK1基因表達除受Ca2+影響外,還受ABA、GA3、SA、H2O2影響。ABA、GA3、SA、H2O2是逆境防御系統中重要的信號分子,在擬南芥中發現AtCPK3、AtCPK6、AtCPK21、AtCPK23基因參與ABA 誘導的氣孔關閉[21],AtCPK10也參與ABA 和Ca2+介導的氣孔運動[22],AtCPK8在ABA 和H2O2介導的信號轉導中起抗旱作用[13],玉米(Zea mays)ZmCPK1響應 H2O2誘導,參與H2O2信號傳導途徑[23]。水稻OsCPK21參與ABA 介導的下游逆境基因的表達[24],這些研究表明CDPKS可參與多種信號轉導通路并在逆境響應中發揮作用。SikCDPK1基因具體如何參與這些信號分子的信號途徑來發揮抗逆作用,需進一步深入研究。
體外激酶活性分析發現Ca2+存在時,SIKCDPK1 具有激酶催化活性,加入Ca2+螯合劑EGTA 后,SIKCDPK1幾乎沒有激酶活性,這與番茄LeCPK2 蛋白激酶是Ca2+依賴性的研究結果相似[25],證實SIKCDPK1 發揮激酶活性也是需要Ca2+的。冰葉日中花(Mesembryanthemum crystallinum)McCPK1 激酶活性能被K0.5為0.15 μmol·L-1的Ca2+激活[26],煙草NtCPK5 激酶活性能被K0.5為0.04 μmol·L-1的Ca2+激活[27],NtCPK4 激酶活性能被K0.5為0.25 μmol·L-1的Ca2+激活[28]。擬南芥AtCPK11被0.55 μmol·L-1的Ca2+激活[29]。本研究發現SIKCDPK1 激酶活性隨Ca2+濃度增加而增加,Ca2+濃度(K0.5)為48.7 nmol·L-1時,SIKCDPK1 激酶活性可達到最大活性的1/2,說明該激酶活性可受nmol·L-1級別Ca2+濃度的激發。以HisⅢ為底物時,SIKCDPK1 的Km值可達43.8 μg·mL-1,說明SIKCDPK1 激酶活性不僅受到Ca2+濃度的影響,還受到底物HisⅢ濃度的影響,推測Ca2+和底物等影響因素可能會在細胞內形成一種復合的環境共同調控SIKCDPK1 的激酶活性,并將Ca2+信號向下游傳遞,使植物參與逆境響應。
亞細胞定位分析發現SIKCDPK1 蛋白定位于細胞核,采用Prosite 數據庫分析發現SikCDPK1在N-端(220~225)(547~552)處有 2 個豆蔻酰化位點。在煙草NtCDPK2亞細胞定位中發現,少量的豆蔻酰化位點不能使蛋白穩定結合在膜結構上,多個豆蔻酰化位點才能使CDPKS穩定結合于膜上[30]。豆蔻酰化位點修飾后,蛋白與膜結合較松散,大多定位于細胞質和細胞核[31]。玉米ZmCK1含有一個豆蔻酰化位點,定位于細胞質與細胞核[32]。棕櫚酰化位點修飾可以增強蛋白質疏水性,促進蛋白質與膜結合,使蛋白質在膜間的亞細胞運輸過程中發揮重要作用[33]。SikCDPK1豆蔻酰化位點少,又無棕櫚酰化位點,這可能是SIKCDPK1 蛋白定位于細胞核而不能定位細胞膜的原因。SIKCDPK1 蛋白定位于細胞核,推測其主要在細胞核里發揮作用。
4 結論
SikCDPK1基因在天山雪蓮種子、葉片、莖、根中都表達,無明顯組織表達特異性,該基因響應信號分子Ca2+、ABA、GA3、SA、H2O2誘導表達且響應模式有差異。SIKCDPK1 發揮激酶活性需要Ca2+,受nmol·L-1級別Ca2+濃度的激發,SIKCDPK1 主要在細胞核發揮作用。本研究豐富了對雪蓮SikCDPK1基因的認知,為進一步深入研究SikCDPK1基因的表達機制奠定了基礎。

