黃連素對高鹽高糖誘發秀麗隱桿線蟲形態及壽命改變的干預作用
徐婋,盧濤,李珂,徐佳寧,劉小愉,杜鵬云,張成崗
北京中醫藥大學生命科學學院,北京102488
食鹽和糖在提供能量、維持生命基本活動和健康維護中起重要作用。WHO推薦,成年人每天攝入食鹽不超過5 g、糖不超過25 g。調查顯示,中國北方地區居民平均每日食鹽攝入量為11.2 g,南方地區居民為10.2 g[1];我國9省(廣西壯族自治區、貴州、湖南、湖北、江蘇、河南、山東、遼寧和黑龍江)平均每日糖攝入量為31.3 g[2],明顯超過WHO推薦量。糖攝入過量會引發胰島素抵抗、慢性血管病、腎功能損害以及心血管疾病[3-4];食鹽攝入過量則是高血壓、心臟病等心血管疾病、脂肪肝、癡呆、慢性腎臟病和中風的危險因素[5-6]。長期高鹽高糖飲食與肥胖的發生密切相關,在攝入糖和鹽的過程中,大腦分泌大量阿片類物質以及多巴胺,阿片類物質與成癮性有關,多巴胺使人產生愉悅感;并且糖和鹽會降低乙酰膽堿的釋放,從而降低飽腹感,容易誘發暴食。肥胖對人體的呼吸系統、心血管系統、內分泌系統以及免疫系統都會產生不良影響,從而縮短人的壽命;對兒童及青少年來說,肥胖還會影響生長發育和心理狀態。因此,減少人們對鹽和糖的攝取從而控制肥胖的發生率勢在必行。黃連素又稱小檗堿,是我國傳統中藥黃連的主要有效成分,是一種天然的季銨類異喹啉生物堿,目前在臨床上已被廣泛用于與鹽、糖代謝相關疾病的治療中,在應用磺脲類及二甲雙胍等治療2型糖尿病藥物時添加黃連素可進一步提高治療效果[7-8]。線蟲daf-2基因是人胰島素受體蛋白相關基因的同源基因,daf-16基因為其下游基因。2022年8月—2023年4月,我們以秀麗線蟲建立高鹽高糖飲食模型,探討黃連素對高鹽高糖誘導的秀麗線蟲形態及壽命改變的干預作用,檢測其對線蟲daf-2、daf-16基因表達的影響,旨在為臨床使用黃連素緩解和糾正人體因高鹽高糖飲食導致的肥胖和壽命縮短提供參考依據。
1 材料與方法
1.1 材料 野生型N2秀麗隱桿線蟲、大腸桿菌OP50由中國人民解放軍軍事科學院軍事醫學研究院輻射醫學研究所提供。黃連素為麥克林公司產品。瓊脂粉(北京奧博星生物技術有限責任公司),蛋白胨(美國賽默飛公司),氯化鈉(天津市大茂化學試劑廠),葡萄糖—水合物(天津市光復科技發展有限公司),氫氧化鈉溶液(國家化學試劑質檢中心),M9鹽溶液(10×,pH7.4),恒溫生化培養箱(上海一恒科學儀器有限公司),體視顯微鏡(廣州市明美光電技術有限公司)。
1.2 線蟲的基本培養 將線蟲放置于涂布有大腸桿菌OP50的培養基上,置于20 ℃恒溫生化培養箱培養。每3~4 d切膠轉板1次,以保證線蟲有足夠的食物和生活空間,同時注意保持培養基潔凈。實驗開始前將線蟲進行同步化處理,培養至L1期(相當于人類3歲)用于后續實驗。
1.3 高鹽和高糖培養基的配制 高鹽培養基:正常線蟲NGM培養基中氯化鈉濃度為0.3%,根據我國居民食鹽攝入超標倍數,設置氯化鈉濃度為0.7%。向50 mL線蟲NGM培養基中添入0.35 g氯化鈉,配制成氯化鈉濃度為0.7%的培養基。高糖培養基:向50 mL線蟲NGM培養基中加入0.5 g葡萄糖水合物,配制成葡萄糖濃度為1%的培養基[9]。高鹽高糖培養基:向50 mL線蟲NGM培養基中添加0.5 g葡萄糖水合物和0.35 g氯化鈉,配制成葡萄糖含量為1%、氯化鈉含量為0.7%的培養基。
1.4 實驗組黃連素干預濃度的確定 以M9鹽溶液為溶劑配制0、1、10、20、50 mg/L黃連素溶液。每個濃度設置3個60 mm直徑線蟲NGM培養皿,加入0.2 mL對應濃度的黃連素溶液,培養10 d,計算總存活率。結果顯示,與0 mg/L黃連素比較,1、10、20 mg/L黃連素干預下的線蟲總存活率無統計學差異,50 mg/L黃連素干預下的線蟲總存活率降低,故后續實驗選擇黃連素濃度10 mg/L和20 mg/L。
1.5 線蟲分組與干預方法 將線蟲分為正常對照組、高鹽組、高糖組、高鹽高糖組。正常對照組加入線蟲NGM培養基;高鹽組、高糖組、高鹽高糖組下設模型對照組、10 mg/L黃連素干預組、20 mg/L黃連素干預組,先分別加入高鹽培養基、高糖培養基、高鹽高糖培養基,然后向黃連素干預組中加入相應濃度的黃連素溶液。使用直徑60 mm的培養皿,置于20 ℃恒溫培養箱中培養。
1.6 線蟲生長指標觀察 于培養第1、3、6天,每組隨機選取30條線蟲,在體視顯微鏡下進行觀察。使用MShot Image Analysis System顯微測量軟件截取線蟲圖片,使用Image J圖像處理軟件測定線蟲體長和體寬(蟲體中部最寬部分),以像素(pixels)作為單位,1 mm=(436.47 ± 0.15)pixels。
1.7 線蟲壽命統計 每組隨機選取30條線蟲,于20 ℃恒溫培養箱中培養,每2 d將線蟲挑至新的培養基,直至線蟲全部死亡。記錄30條線蟲的壽命,取平均數。
1.8 線蟲daf-2、daf-16 mRNA檢測 采用RT-qPCR法。培養第6天,每組隨機選取30只線蟲,加液氮后研磨。采用TRIzol法提取總RNA,測定RNA濃度及純度后,在37 ℃環境下,逆轉錄酶催化下合成cDNA。在85 ℃環境下滅活逆轉錄酶,然后進行PCR擴增。引物序列:daf-2 mRNA上游引物5'-GTTGATAATGCTGCCGAG-3',下游引物5'-ATCCCGGTCCGATTTCTT-3';daf-16 mRNA上游引物5'-ATCGTGTGCTCAGAATCC-3',下游引物:5'-ATGAATAGCTGCCCTCC-3'。擴增結束后計算擴增效率,采用2-ΔΔCT法計算目的基因的相對表達量。每組重復3次。
1.9 統計學方法 采用SPSS17.0統計軟件。計量資料以表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組線蟲不同時間點體長比較 培養1、3、6 d時,高鹽組、高糖組以及高鹽高糖組體長與對照組相比差異均無統計學意義(P均>0.05);添加10、20 mg/L黃連素后,高鹽組、高糖組以及高鹽高糖組體長與對應的未加藥線蟲相比差異均無統計學意義(P均>0.05)。見表1。
表1 各組線蟲培養不同時間點體長比較(n=30,pixels,)

表1 各組線蟲培養不同時間點體長比較(n=30,pixels,)
組別體長培養1 d 培養3 d 培養6 d高鹽組10 mg/L黃連素20 mg/L黃連素模型對照高糖組10 mg/L黃連素20 mg/L黃連素模型對照高鹽高糖組10 mg/L黃連素20 mg/L黃連素模型對照正常對照組101.09 ± 2.25 101.95 ± 0.94 101.25 ± 0.99 371.90 ± 1.92 371.34 ± 0.36 371.90 ± 1.92 464.08 ± 1.87 469.07 ± 0.11 516.88 ± 1.94 100.86 ± 1.38 101.19 ± 0.73 102.50 ± 2.17 370.90 ± 0.49 371.01 ± 0.21 390.23 ± 0.81 465.55 ± 1.93 467.18 ± 0.19 519.92 ± 1.21 101.95 ± 2.43 102.34 ± 1.33 102.57 ± 2.97 101.55 ± 0.34 371.74 ± 0.69 371.56 ± 0.36 404.82 ± 1.95 349.91 ± 3.30 468.64 ± 0.71 468.31 ± 0.56 519.73 ± 0.59 435.03 ± 1.85
2.2 各組線蟲不同時間點體寬比較 培養3、6 d時高鹽組、高糖組以及高鹽高糖組體寬均較對照組增加(P均<0.05);添加10、20 mg/L黃連素后,高鹽組、高糖組以及高鹽高糖組體寬均較對應的未加藥線蟲減少(P均<0.05)。見表2。
表2 各組線蟲培養不同時間點體寬比較(n=30,pixels,)
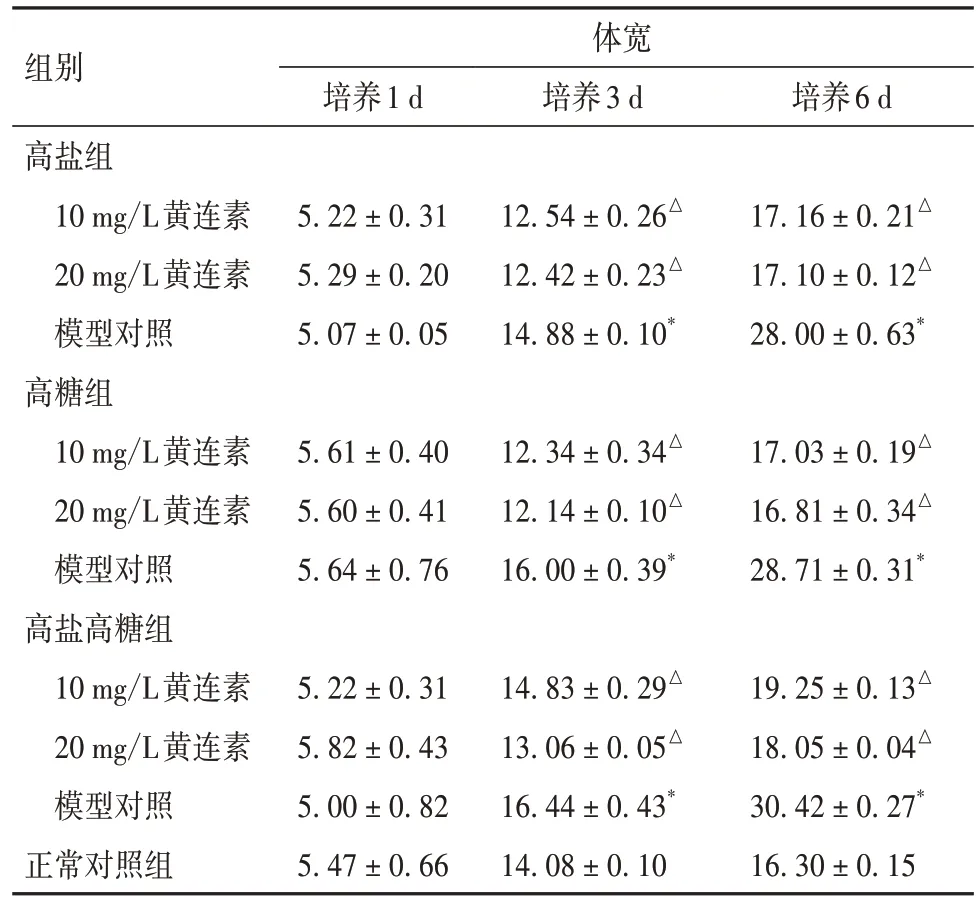
表2 各組線蟲培養不同時間點體寬比較(n=30,pixels,)
注:與正常對照組比較,*P均<0.05;與同組模型對照比較,△P均<0.05。
組別體寬培養1 d 培養3 d 培養6 d 5.22 ± 0.31 5.29 ± 0.20 5.07 ± 0.05 12.54 ± 0.26△12.42 ± 0.23△14.88 ± 0.10*高鹽組10 mg/L黃連素20 mg/L黃連素模型對照高糖組10 mg/L黃連素20 mg/L黃連素模型對照高鹽高糖組10 mg/L黃連素20 mg/L黃連素模型對照正常對照組17.16 ± 0.21△17.10 ± 0.12△28.00 ± 0.63*5.61 ± 0.40 5.60 ± 0.41 5.64 ± 0.76 12.34 ± 0.34△12.14 ± 0.10△16.00 ± 0.39*17.03 ± 0.19△16.81 ± 0.34△28.71 ± 0.31*19.25 ± 0.13△18.05 ± 0.04△30.42 ± 0.27*16.30 ± 0.15 5.22 ± 0.31 5.82 ± 0.43 5.00 ± 0.82 5.47 ± 0.66 14.83 ± 0.29△13.06 ± 0.05△16.44 ± 0.43*14.08 ± 0.10
2.3 各組線蟲壽命比較 高鹽、高糖、高鹽高糖組壽命均較對照組縮短(P均<0.01);添加10、20 mg/L黃連素后,高鹽組、高糖組以及高鹽高糖組壽命均較對應的未加藥線蟲延長(P均<0.01)。見表3。
表3 各組線蟲壽命比較(n=30,d,)
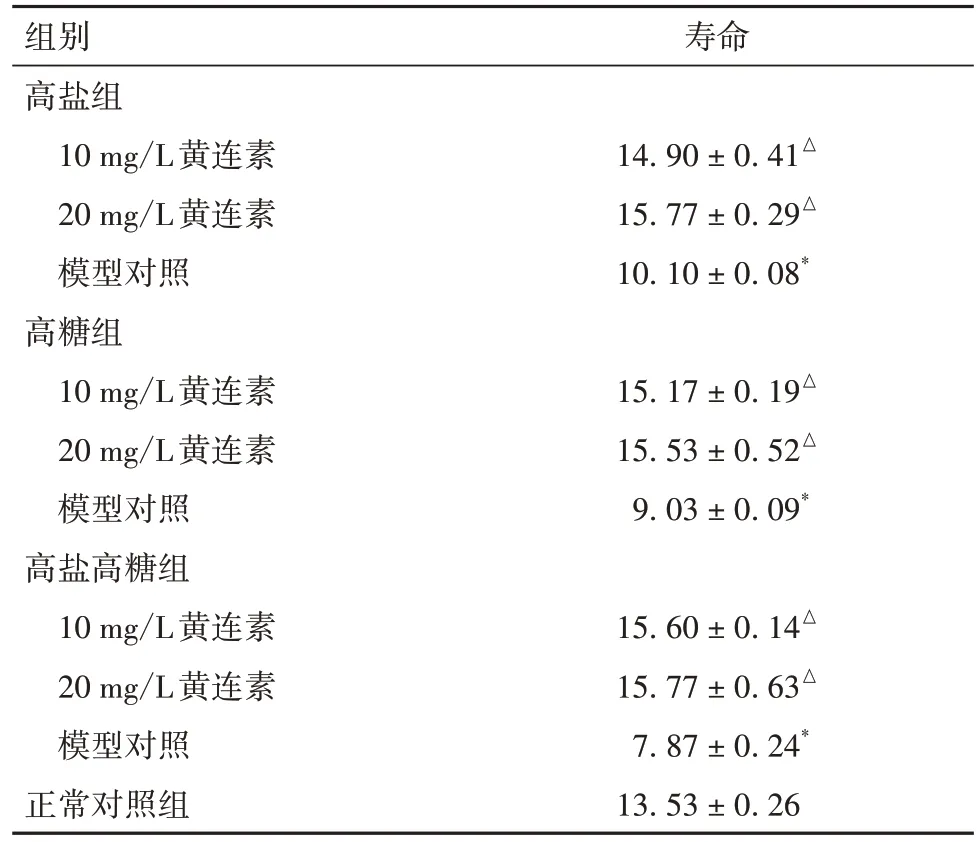
表3 各組線蟲壽命比較(n=30,d,)
注:與正常對照組比較,*P均<0.01;與同組模型對照比較,△P均<0.01。
壽命14.90 ± 0.41△15.77 ± 0.29△10.10 ± 0.08*15.17 ± 0.19△15.53 ± 0.52△9.03 ± 0.09*15.60 ± 0.14△15.77 ± 0.63△7.87 ± 0.24*13.53 ± 0.26組別高鹽組10 mg/L黃連素20 mg/L黃連素模型對照高糖組10 mg/L黃連素20 mg/L黃連素模型對照高鹽高糖組10 mg/L黃連素20 mg/L黃連素模型對照正常對照組
2.4 各組線蟲daf-2、daf-16 mRNA表達水平比較根據上述實驗結果,添加20 mg/L黃連素后,線蟲體寬減小、壽命延長現象較10 mg/L黃連素更為明顯,故在daf-2、daf-16 mRNA表達水平比較的實驗中選擇黃連素濃度為20 mg/L。與正常對照組比較,高鹽組、高糖組以及高鹽高糖組daf-2 mRNA表達水平降低、daf-16 mRNA表達水平升高;添加黃連素后,與對應的未加藥線蟲相比,daf-2 mRNA表達水平降低、daf-16 mRNA表達水平升高(P均<0.05)。見表4。
表4 各組線蟲daf-2、daf-16 mRNA表達水平比較(n=30,)

表4 各組線蟲daf-2、daf-16 mRNA表達水平比較(n=30,)
注:與正常對照組比較,*P均<0.05;與同組模型對照比較,△P均<0.05。
daf-2 mRNA daf-16 mRNA 組別高鹽組20 mg/L黃連素模型對照高糖組20 mg/L黃連素模型對照高鹽高糖組20 mg/L黃連素模型對照正常對照組3.10 ± 0.31△-0.02 ± 0.27*-6.94 ± 0.57△1.72 ± 0.53*2.53 ± 0.22△-2.53 ± 0.25*-6.54 ± 0.47△2.81 ± 0.63*-7.48 ± 0.98△1.37 ± 0.08*0.19 ± 0.82 2.28 ± 0.86△-2.87 ± 0.24*0.73 ± 1.28
3 討論
兒童以及青少年處在生長發育的關鍵階段,此階段也極易發生糖鹽攝入量過高的情況。高鹽高糖飲食直接或通過增加體內脂肪含量間接縮短人類壽命。研究顯示,腰圍每增加10 cm,全因死亡風險增加11%[10]。高鹽、高糖飲食可通過上調分布在腎臟皮質近端小管上皮細胞管腔側的鈉—葡萄糖協同轉運蛋白(SGLTs)、降低小腸胰高血糖素樣肽1表達以及抑制Min6細胞胰島素分泌功能等多重機制促進葡萄糖和鈉的重吸收,誘發血糖、血鈉異常,從而導致以代謝性疾病和心血管疾病為主的諸多疾病,對人類的身體健康構成嚴重威脅[11-13]。除心血管疾病和代謝疾病外,高鹽、高糖飲食還可以通過滲透作用誘發呼吸道疾病、抑制口腔黏膜上皮細胞增殖使其喪失抗病能力、影響人體對鋅的吸收、促使慢性炎癥性疾病惡化以及影響學習和記憶能力[14-15]。
中醫認為,五味與五行相對應,五味中同樣存在著相生相克的關系。對于咸和甘,中醫認為“苦生甘”“苦克咸”,即苦味可以幫助人體更好地利用糖類物質,同時可以對抗所食過咸帶來的不良影響。《素問·至真要大論》中指出“辛甘發散為陽,酸苦涌泄為陰”,意為酸味、苦味屬陰,甘味屬陽。以此理論為依據,我國中醫內科學家仝小林院士提出“苦酸制甜法”用以調節血糖,治療和緩解2型糖尿病。黃連最早記載于《神農本草經》,性寒味苦,具有清熱燥濕、瀉火解毒的功效,其主要有效成分為黃連素。黃連素目前在臨床上已被廣泛應用于與鹽、糖代謝相關疾病的治療。張振等[16]以不同劑量黃連素與阿托伐他汀治療高血壓合并動脈粥樣硬化,結果顯示,患者血管內皮功能和血脂水平均有明顯改善。黃連素在降脂方面具有廣闊的治療前景,王楊等[17]對肥胖小鼠給予黃連素治療,發現小鼠脂肪組織纖維化明顯減輕,毛螺科菌和嗜乳酸桿菌等益生菌增加,表明黃連素在降脂方面具有一定療效,可能改善人群中因高鹽高糖飲食誘發的肥胖和壽命縮短。
秀麗隱桿線蟲是一種經典的模式生物,以大腸桿菌OP50為食,從受精卵發育為成蟲需3.5 d,生命周期為20 d,具有遺傳背景清楚、個體結構簡單、生活史短的特點。秀麗線蟲體內有12條信號通路與人類相同,大部分與營養代謝相關,這為以秀麗線蟲為模型探討相關藥物的作用機制奠定了基礎。本研究以秀麗線蟲為模型,通過向L1期(孵化后14 h,以人類壽命為100年等比例計算,相當于人類3歲)線蟲提供高鹽高糖環境,連續觀察6 d(相當于人類30歲),探討高鹽高糖對秀麗線蟲生長發育的影響以及黃連素的干預作用。體長既可以代表秀麗線蟲的生長發育狀況,也可以反映物質的毒性,當秀麗線蟲暴露于毒性物質中,體長會明顯減少;秀麗線蟲的脂肪主要儲存于腸道及皮下,當秀麗線蟲體內脂肪含量發生變化時其體寬會隨之發生較為顯著的改變[18]。本研究結果顯示,高鹽、高糖以及高鹽高糖組線蟲的體寬均較對照組增加,壽命均較對照組縮短;添加黃連素后,高鹽、高糖以及高鹽高糖組線蟲的體寬有所下降,壽命有所延長;并且與10 mg/L黃連素相比較,20 mg/L黃連素作用下產生的差異更為明顯。這表明黃連素可逆轉高鹽高糖飲食所致的秀麗線蟲形態改變與壽命的縮短。
PI3K/AKT/mTOR通路是響應胰島素信號的經典通路。食物進入小腸后,經過消化產生葡萄糖,經小腸上皮細胞吸收后使血糖增高,從而促進胰島素釋放,胰島素進一步促進細胞對葡萄糖進行吸收和利用。胰島素與細胞表面胰島素受體底物1結合后,激活PI3K/AKT通路,AKT直接促進葡萄糖吸收。同時,通過AKT-TSC1/2-RheB-mTORC1通路激活mTORC1活性,mTORC1進一步促進葡萄糖的利用從而為機體正常活動提供能量。研究表明,在高糖、高脂環境培養的大鼠胰島素瘤細胞中加入黃連素進行干預后,細胞胰島素和胰島素樣生長因子1表達顯著下降[19]。分析其機制為黃連素在高糖、高脂環境抑制胰島素生成,從而減少機體對葡萄糖的攝取以及胰島素抵抗的發生,緩解因葡萄糖堆積轉化為脂肪而導致的肥胖。
線蟲daf-2基因是唯一一個與人胰島素受體蛋白相關基因同源的基因[20]。daf-2可促使daf-16磷酸化,阻止其進入細胞核發揮轉錄調節作用。daf-16是胰島素/IGF-1信號通路中最重要的靶點,其激活可抑制線蟲衰老,延長線蟲壽命[21]。研究顯示,肥胖可通過多種途徑促進衰老,而衰老也可促進肥胖的發生和發展[22]。因此我們在機制探究中著眼于線蟲胰島素同源通路,對線蟲體內daf-2、daf-16 mRNA表達進行檢測,結果顯示,添加黃連素后,高鹽、高糖以及高鹽高糖組秀麗線蟲體內daf-2 mRNA表達水平較未添加黃連素線蟲明顯降低,daf-16 mRNA表達水平較未添加黃連素線蟲明顯提高。據此推測,黃連素干預高鹽高糖飲食誘發的秀麗線蟲形態改變以及壽命縮短的作用機制可能是黃連素抑制了秀麗線蟲daf-2 mRNA表達以及提高daf-16 mRNA表達,從而減少線蟲機體對葡萄糖的攝取以及胰島素抵抗的發生,進而緩解由于過多葡萄糖轉化為脂肪而導致的脂肪堆積引起的線蟲形態改變,表現出抑制線蟲衰老、延長線蟲壽命等作用。
綜上所述,高鹽、高糖以及高鹽高糖環境可誘發秀麗線蟲體寬增加、壽命縮短;黃連素可以逆轉上述變化,其作用機制與線蟲胰島素同源通路有關。后續我們將繼續深入研究,為黃連素干預高鹽、高糖以及高鹽高糖等不良飲食嗜好導致的肥胖以及全因死亡風險增加現象提供更多證據。

