補陽還五湯調控絲裂原活化蛋白激酶信號通路對2型糖尿病大鼠糖脂代謝的影響
林莉嫻 龍邦盛 王寶愛
(1.海南省海口市中醫(yī)醫(yī)院內五科,海南 海口 570000;2.海南省海口市中醫(yī)醫(yī)院重癥醫(yī)學科,海南 海口 570000;3.海南省海口市中醫(yī)醫(yī)院內一科,海南 海口 570000)
糖尿病是一種以高血糖、胰島素分泌障礙或其生物作用受損為主要臨床表現(xiàn)的進展性疾病,2型糖尿病(type 2 diabetes mellitus,T2DM)是其最常見的類型,占所有糖尿病的90%以上[1-3]。抑制肝臟異常糖異生是治療該病的關鍵所在[4]。T2DM屬中醫(yī)學消渴范疇,病機為氣陰兩虛、血行瘀滯等,以益氣活血治療。補陽還五湯有效成分是芍藥苷、黃芪甲苷等,具有益氣養(yǎng)血、活血通絡的作用[5]。該方有改善高血糖、高血脂、調節(jié)免疫等藥理作用[6],但其機制并未確定。有研究認為,絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路在糖脂代謝異常中有重要作用,可作為糖脂代謝異常人工干預及藥物研發(fā)的新方向[7-8]。但補陽還五湯是否可通過調控該通路對T2DM大鼠產(chǎn)生作用,還不明確。因此,本研究通過T2DM大鼠模型,探討補陽還五湯調控MAPK通路改善糖脂代謝的作用機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物與分組 選取60只Wistar雄性大鼠,體質量(180±20) g,飼養(yǎng)于無菌環(huán)境中,溫度27 ℃左右;濕度55%左右,自由進食,適應性喂養(yǎng)1周后進行實驗。按照隨機數(shù)字表法分為6組,即空白組、模型組、陽性對照組和補陽還五湯低、中、高劑量組,每組10只。
1.1.2 藥物制備 補陽還五湯(藥物組成:黃芪120 g,當歸6 g,赤芍5 g,川芎3 g,紅花3 g,桃仁3 g,地龍3 g)所需藥材均購自湖北省中藥材公司,以上藥材均為顆粒劑,各1袋溶于溫水(30~40 ℃)11.3 mL中,配制成質量濃度約為12.8 g/mL(以顆粒劑總質量計)的藥液,再用溫水分別稀釋成1.6、3.2、6.4 g/mL藥液備用。二甲雙胍片(中美上海施貴寶制藥有限公司,國藥準字H20023371),稱取二甲雙胍片2 g并粉碎,用蒸餾水配成濃度為20 mg/mL的二甲雙胍混懸液,4 ℃儲存?zhèn)溆?用時室溫放置60 min,振搖使其混勻,每周配置1次。
1.1.3 儀器與試劑 磷酸鹽緩沖液(PBS,成都中仕石化有限公司),石蠟(瑞沃德生命科技有限公司),乙醇、0.9%氯化鈉注射液(南京化學試劑有限公司),空腹胰島素(FINS)、糖化血紅蛋白(HbA1c)試劑盒(上海酶聯(lián)生物科技有限公司),鏈脲佐菌素(STZ,美國Sigma公司),RNA提取液(Invitrogen TRIzol,Thermo公司),離心機(大龍興創(chuàng)實驗儀器有限公司),凝膠成像儀(上海無陌光學儀器有限公司),AT1303002型酶標儀(上海元析儀器有限公司),實時熒光定量聚合酶鏈式反應(qRT-PCR)儀(美國Thermo Fisher公司),電泳儀(北京六一儀器廠),組織勻漿機(深圳欣博盛生物科技有限公司),MAPK、磷酸化MAPK(p-MAPK)、β-actin抗體(美國Thermo Fisher公司),全自動生化分析儀(上海科華生物工程股份有限公司)。
1.2 方法
1.2.1 模型制備及給藥 空白組予基礎飼料,其余大鼠給予高脂飼料喂養(yǎng)6周,禁食12 h,腹腔注射100 mg/kg的STZ試劑,然后繼續(xù)高脂飼料喂養(yǎng)4周,剪尾采血,以連續(xù)2天空腹血糖(FPG)≥13.9 mmol/L為造模成功。造模成功后予藥物干預,補陽還五湯低、中、高劑量組分別給予1.6、3.2、6.4 g/kg生藥灌胃,陽性對照組予二甲雙胍混懸液0.2 g/kg灌胃,空白組、模型組均予等容積0.9%氯化鈉注射液灌胃,每日1次,持續(xù)給藥12周。
1.2.2 記錄大鼠體質量和生存狀態(tài) 于藥物干預第12周末次給藥后測定各組大鼠體質量,上代謝籠監(jiān)測各組大鼠12 h的飲水量、攝食量和尿量。
1.2.3 測定大鼠血糖水平 于藥物干預第12周末次給藥后先對大鼠禁食12 h,末次給藥后抽取其尾靜脈血2 mL,檢測空腹血糖(FPG),采用酶聯(lián)免疫吸附(ELISA)檢測FINS、HbA1c。
1.2.4 測定大鼠血脂水平 于藥物干預第12周末次給藥后麻醉大鼠,抽取其腹主動脈血,離心后于-20 ℃環(huán)境中保存,全自動生化分析儀測定大鼠血清總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)。
1.2.5 蘇木素-伊紅染色(HE)觀察大鼠肝臟病理學組織 于藥物干預第12周末次給藥后麻醉大鼠,打開腹部暴露臟器,小心摘取肝臟,用0.9%氯化鈉注射液充分沖洗后再用多聚甲醛固定,脫水,待石蠟完全浸入組織塊后包埋,連續(xù)4 μm切片,進行HE染色,放大200倍后觀察各組大鼠肝臟組織病理學變化。
1.2.6 蛋白免疫印跡(western blot,WB)法檢測MAPK通路相關蛋白表達 肝臟組織勻漿后提取總蛋白,加入十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE,上海信裕生物科技有限公司)后進行電泳,分離后進行轉膜用牛血清白蛋白(BSA,上海麥克林生化科技股份有限公司)封閉聚偏二氟乙烯膜(PVDF,碧云天生物有限公司)1 h,然后洗脫5 min,孵育一抗:加入MAPK、p-MAPK一抗,4 ℃冷室孵育過夜。洗膜后加入二抗孵育,再次搖動洗滌,進行化學發(fā)光反應,然后浸入顯影液中顯色,最后凝膠成像,計算蛋白表達。
1.2.7 qRT-PCR檢測MAPK、成纖維細胞生長因子21(FGF21)mRNA表達 提取肝臟組織于勻漿器中,加入TRIzol試劑提取總RNA,按逆轉錄試劑盒(北京百奧萊博科技有限公司)說明書要求,將提取的總RNA反轉錄成cDNA,然后再進行擴增,以β-actin為內參,采用2-△△Ct法計算目的基因的相對表達量。見表1。
2 結果
2.1 各組大鼠體質量、飲水量、攝食量和尿量比較 與空白組比較,模型組大鼠體質量降低(P<0.05),12 h飲水量、攝食量及尿量均升高(P<0.05);陽性對照組及補陽還五湯低、中、高劑量組體質量均高于模型組(P<0.05),12 h飲水量、攝食量、尿量均低于模型組(P<0.05)。與陽性對照組比較,補陽還五湯低劑量組體質量較低(P<0.05),補陽還五湯高劑量組體質量明顯較高(P<0.05);與陽性對照組比較,補陽還五湯低、中劑量組12 h飲水量、尿量較高(P<0.05);與陽性對照組比較,補陽還五湯低劑量組攝食量較高(P<0.05),補陽還五湯高劑量組攝食量較低(P<0.05);與陽性對照組比較,補陽還五湯低、中劑量組尿量較高(P<0.05)。隨著補陽還五湯劑量增加,大鼠體質量呈遞增趨勢,12 h飲水量及攝食量呈遞減趨勢,且各組間兩兩比較差異有統(tǒng)計學意義(P<0.05);隨著補陽還五湯劑量增加,大鼠尿量遞減(P<0.05)。見表2。
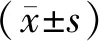
表2 各組大鼠體質量、飲水量、攝食量和尿量比較
2.2 各組大鼠FPG、FINS、HbA1c水平比較 與空白組比較,模型組FPG、FINS、HbA1c水平均升高(P<0.05);陽性對照組及補陽還五湯低、中、高劑量組FPG、FINS、HbA1c水平均低于模型組(P<0.05)。與陽性對照組比較,補陽還五湯低劑量組FPG、FINS、HbA1c水平均升高(P<0.05),補陽還五湯中劑量組FINS、HbA1c水平均升高(P<0.05),補陽還五湯高劑量組FINS水平降低(P<0.05)。隨著補陽還五湯劑量增加,FINS、HbA1c、FPG水平均逐漸降低(P<0.05)。見表3。
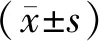
表3 各組大鼠FPG、FINS、HbA1c水平比較
2.3 各組大鼠TC、TG、LDL-C、HDL-C水平比較 與空白組比較,模型組TC、TG、LDL-C水平均升高(P<0.05),HDL-C水平降低(P<0.05);陽性對照組及補陽還五湯低、中、高劑量組TC、TG、LDL-C水平均低于模型組(P<0.05),HDL-C水平高于模型組(P<0.05)。與陽性對照組比較,補陽還五湯低劑量組TC、TG、LDL-C水平均升高(P<0.05),HDL-C水平降低(P<0.05)。與補陽還五湯低劑量組比較,補陽還五湯中劑量組TC水平降低(P<0.05),補陽還五湯高劑量組TC、TG、LDL-C水平均降低(P<0.05),HDL-C水平升高(P<0.05);與補陽還五湯中劑量組比較,補陽還五湯高劑量組TG、LDL-C水平均降低(P<0.05),HDL-C水平升高(P<0.05)。見表4。

表4 各組大鼠TC、TG、LDL-C、HDL-C水平比較
2.4 各組大鼠肝臟組織病理學變化 空白組大鼠肝臟組織結構和細胞狀態(tài)均無異常,排列整齊,脂質染色無空泡;模型組大鼠肝臟組織出現(xiàn)明顯的病理改變:組織結構紊亂,細胞形態(tài)異常,體積發(fā)生變化,出現(xiàn)脂質空泡;陽性對照組和補陽還五湯各劑量組大鼠肝臟組織均在不同程度上有明顯改善,且高劑量組效果最顯著。見圖1。
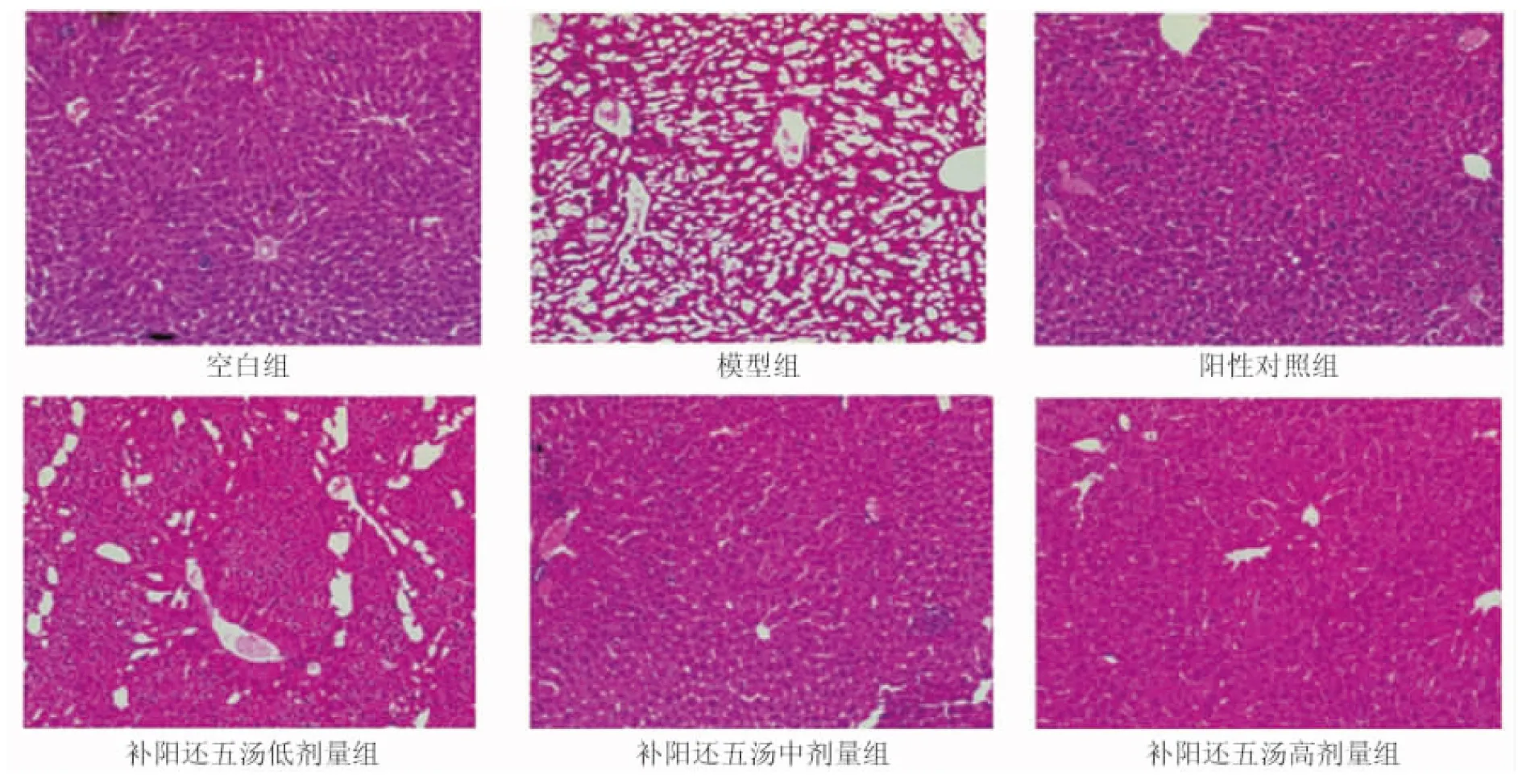
圖1 各組大鼠肝臟組織病理學變化(HE,×200)
2.5 各組大鼠MAPK、p-MAPK蛋白表達比較 與空白組比較,模型組MAPK、p-MAPK蛋白表達降低(P<0.05);陽性對照組及補陽還五湯低、中、高劑量組MAPK、p-MAPK蛋白表達均高于模型組(P<0.05)。與陽性對照組比較,補陽還五湯低、中劑量組MAPK、p-MAPK蛋白表達降低(P<0.05),補陽還五湯高劑量組MAPK、p-MAPK蛋白表達升高(P<0.05)。隨著補陽還五湯劑量增加,MAPK、p-MAPK蛋白表達均逐漸升高,兩兩比較差異均有統(tǒng)計學意義(P<0.05)。見表5,圖2。

圖2 各組大鼠MAPK、p-MAPK蛋白表達比較
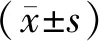
表5 各組大鼠MAPK、p-MAPK蛋白表達比較
2.6 各組大鼠肝臟組織MAPK mRNA、FGF21 mRNA表達比較 與空白組比較,模型組MAPK mRNA、FGF21 mRNA表達降低(P<0.05);陽性對照組及補陽還五湯低、中、高劑量組MAPK mRNA、FGF21 mRNA均高于模型組(P<0.05)。與陽性對照組比較,補陽還五湯低、中劑量組MAPK mRNA、FGF21 mRNA表達均降低(P<0.05)。隨著補陽還五湯劑量增加,MAPK mRNA、FGF21 mRNA表達差異逐漸升高,且補陽還五湯低、中、高劑量組間兩兩比較差異均有統(tǒng)計學意義(P<0.05)。見表6。
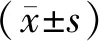
表6 各組大鼠肝臟組織MAPK mRNA、FGF21 mRNA表達比較
3 討論
T2DM可由多種原因引起,其病機十分復雜[9]。臨床上常以口服藥物或注射胰島素的方法控制病情,但效果并不明顯,且具有毒副作用。中醫(yī)學認為,T2DM多為“氣虛”“血瘀”[10]。因此,本研究使用補氣活血、祛瘀通絡的補陽還五湯來干預。
本研究中,模型組大鼠體質量明顯減輕,且出現(xiàn)多飲、多食、多尿的癥狀,此為T2DM的臨床特征,表明造模成功。補陽還五湯各劑量組大鼠較模型組體質量升高,12 h飲水量、攝食量、尿量有所降低,這說明補陽還五湯可有效改善臨床癥狀。T2DM患者會伴隨不同程度的糖脂代謝紊亂,臨床上血糖、血脂水平是監(jiān)測糖脂代謝的重要指標。本研究中,模型組FPG、FINS、HbA1c和TC、TG、LDL-C水平較高,HDL-C水平較低;補陽還五湯治療后各指標均改善。說明補陽還五湯對T2DM大鼠的糖脂代謝有調節(jié)作用,臨床效果明顯。有學者研究的補陽還五湯的作用效果與本研究基本一致[11-12]。HE結果也顯示造模后大鼠肝臟組織出現(xiàn)了非常明顯的病變,但經(jīng)補陽還五湯治療后,出現(xiàn)了明顯的改善,與藥物劑量呈正相關,進一步提示補陽還五湯可以減輕甚至是逆轉T2DM大鼠肝臟病理損傷,為該藥調節(jié)糖脂代謝提供了有力依據(jù)。
MAPK信號通路對T2DM胰島素細胞功能、糖脂代謝及炎性反應、細胞增殖與凋亡、氧化應激、炎癥因子等均有調控作用[13-14]。FGF21是一種新的可以調節(jié)機體新陳代謝的因子,還參與體內糖脂代謝,調節(jié)能量、血脂等[15-16],而肝臟是FGF21最主要的表達器官[17-18],FGF21表達增加可以顯著降低T2DM大鼠體質量和血糖,促進糖的再吸收。FGF21可以通過激活下游的信號通路進一步參與機體生物學功能的過程,而MAPK就是其下游的一個關鍵分子。MAPK可通過靶蛋白的磷酸化調節(jié)通路,調節(jié)糖的吸收與利用、控制肝糖的輸出、降低脂肪以及TG的合成,從而調節(jié)能量代謝[19-20]。因此,本研究進一步對MAPK通路的相關蛋白及mRNA及FGF21的mRNA表達進行檢測。研究顯示,與空白組比較,模型組MAPK、p-MAPK蛋白及MAPK、FGF21 mRNA表達較低,補陽還五湯治療后其表達明顯升高。這說明,補陽還五湯可增加MAPK的表達并促進MAPK磷酸化,從而改善糖脂代謝。
綜上所述,補陽還五湯對T2DM大鼠糖脂代謝有調節(jié)作用,其作用機制可能與激活MAPK信號通路有關,這為該病的臨床治療提供了新思路,不過補陽還五湯調控T2DM大鼠糖脂代謝的作用是否涉及其他通路還需進一步研究。

