房角鏡輔助下內路360°小梁切開術治療玻璃體切除術后繼發(fā)性高眼壓
曾召君,盧嵩杰,何 宇,曾流芝,荊 林,范罕英
0 引言
玻璃體切除術后高眼壓為玻璃體切除術后常見臨床并發(fā)癥,發(fā)生率為20%~60%[1],其中大多為一過性,經過對癥治療和或聯(lián)合降眼壓藥物治療后即可緩解,但仍有部分患者表現(xiàn)為持續(xù)性高眼壓,15%~20%有發(fā)生開角型青光眼的風險[2],這些患者多需進一步手術治療。目前治療玻璃體切除術后高眼壓常用的手術方式為復合小梁切除術、眼內引流物植入術、經鞏膜睫狀體光凝術、選擇性激光小梁成形術等[3],由于玻璃體切除術后部分患者結膜傷口瘢痕化,常規(guī)濾過性手術控制眼壓效果欠佳[4];另外對于玻璃體切除術后硅油取出后填充了水的患者,在常規(guī)濾過性手術后易出現(xiàn)低眼壓及相關并發(fā)癥。房角鏡輔助下內路360°小梁切開術(gonioscopy-assisted transluminal trabeculotomy,GATT)是2014年Grover等[5]報道的一種保留結膜的內路小梁切開術,旨在開放房水生理循環(huán)通道,主要用于開角型青光眼患者。目前國內還沒有關于GATT手術應用于玻璃體切除術后高眼壓治療的臨床報告,本研究回顧性分析玻璃體切除術后繼發(fā)性高眼壓行GATT治療的患者資料,現(xiàn)報告如下。
1 對象和方法
1.1對象回顧性研究。納入2019-01/2022-05在成都市第一人民醫(yī)院眼科行GATT治療的玻璃體切除術后繼發(fā)性高眼壓患者10例15眼。納入標準:(1)玻璃體切除術后硅油取出術后1mo以上;(2)使用2種或2種以上抗青光眼藥物眼壓仍>21mmHg;(3)GATT術后隨訪時間≥6mo。排除標準:(1)原發(fā)性高眼壓或青光眼;(2)硅油異位引起瞳孔阻滯或房角阻塞等繼發(fā)性青光眼;(3)房角有廣泛黏連關閉的繼發(fā)性閉角型青光眼;(4)術后早期炎癥反應。本研究遵循《赫爾辛基宣言》,經成都市第一人民醫(yī)院倫理委員會批準,患者及其家屬簽署手術知情同意書。
1.2方法所有患者術前均常規(guī)行裂隙燈、眼底鏡、房角鏡、超聲生物顯微鏡(UBM)、眼底照相、視野及視神經OCTA+OCT檢查;利用非接觸眼壓計測量眼壓,如非接觸眼壓計無法測量的患者采用回彈式眼壓計測量眼壓,記錄三個連續(xù)的眼壓測量值,并計算平均值用于分析。所有患者手術均由同一主任醫(yī)師完成。行丙美卡因表面麻醉,顳上做1.8mm透明角膜切口,稀釋卡巴膽堿注射液前房內注射,縮瞳,林格氏液沖洗前房內殘留的硅油滴(圖1),注入黏彈劑支撐前房,距離主切口約90°做兩個透明角膜輔助穿刺口,將微導管(頭端經輔助切口插入前房,在房角鏡直視下,利用Zeng小梁切開刀切開鼻下小梁網約2mm(圖2),黏彈劑推壓切開口,防止出血。用眼內顳夾取微導管頭端插人Schlemm管切開口,逆時針緩慢推送(圖3),每行進一個鐘點位助手旋轉推注桿一次向Schlemm推注黏彈劑。觀察導管頭端閃爍光,示蹤微導管行進方位,待頭端自切開口另一端穿出后,緩緩牽拉頭尾兩端,360°全周切開小梁網;若遇管內阻塞不能全周穿行,范圍<180°,反向穿行,行全周切開,或兩個方向次全切至范圍接近360°。沖洗前房內黏彈劑及回血后水密角膜切口,妥布霉素地塞米松眼膏涂眼,術畢。術后均常規(guī)給予妥布霉素地塞米松眼液,或醋酸潑尼松眼液加抗生素眼液、雙氯芬酸鈉滴眼液、玻璃酸鈉滴眼液至術后2wk,前房無活動性出血后使用硝酸毛果蕓香堿眼液滴眼縮瞳。

圖1 前房角鏡下見房角大量殘留硅油滴。

圖2 利用Zeng小梁切開刀行鼻下小梁網開窗。

圖3 利用眼內顳將微導管向Schlemm管內推送。
觀察指標:記錄術前,術后1d,1wk,1、3、6mo時的最佳矯正視力(BCVA)、眼壓、使用的降眼壓藥物數(shù)量及術中、術后并發(fā)癥。前房積血按照出血量分為:少量(<1/3前房)、中等(1/3~1/2前房)和大量(>1/2前房)。
手術療效評價標準:完全成功:眼壓<21mmHg,未使用抗青光眼藥物。條件成功:應用2種及以下抗青光眼藥物,眼壓控制在21mmHg以下。手術失敗:需2種以上抗青光眼藥物治療,眼壓仍>21mmHg;需再次行抗青光眼手術。眼壓下降率=(術前眼壓平均值-術后眼壓平均值)/術前眼壓平均值×100%。手術總成功率=(完全成功眼數(shù)+條件成功眼數(shù))/總眼數(shù)×100%;完全成功率=完全成功眼數(shù)/總眼數(shù)×100%;條件成功率=條件成功眼數(shù)/總眼數(shù)×100%。
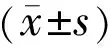
2 結果
2.1納入患者一般資料本研究共納入行GATT治療的玻璃體切除術后繼發(fā)性高眼壓患者10例15眼,其中男6例9眼,女4例6眼;平均年齡42.11±13.59歲。15眼房角鏡檢查中12眼房角開放、2眼可見小于90°的周邊房角虹膜前黏連、1眼房角狹窄。既往行小梁切除術5眼(33%),CO2激光輔助深層鞏膜切除術2眼(13%),人工晶狀體植入術7眼(46%)。
2.2手術前后BCVA比較納入15眼中術前BCVA無光感1眼、光感1眼、手動3眼、指數(shù)2眼、0.02~0.1和>0.1各4眼。術后6mo BCVA無光感1眼、光感2眼、指數(shù)4眼、0.02~0.1和>0.1各4眼。12眼(80%)BCVA不變,2眼(13%)BCVA由術前手動/眼前提高至術后數(shù)指,1眼(7%)BCVA由術前的手動/眼前降為術后的光感。術前和術后6mo時BCVA比較,差異無統(tǒng)計學意義(Z=0,P=1)。
2.3手術前后眼壓及降眼壓藥物使用情況比較納入患者手術前后眼壓比較差異具有統(tǒng)計學意義(F=10.473,P<0.05),進一步兩兩比較結果顯示患者在術后不同隨訪時間點的眼壓均較術前顯著下降,差異均有統(tǒng)計學意義(P<0.05),見表1;所有患者術后末次隨訪使用降眼壓藥物數(shù)量平均用藥1(0,2)種,明顯低于術前用藥數(shù)量2(2,4)種,差異具有統(tǒng)計學意義(Z=-3.236,P<0.001)。
2.4手術成功率比較術后6mo,4眼(27%)手術完全成功,10眼(67%)手術條件成功,手術總成功率為93%,見表1;術后1mo與術后6mo手術總成功率比較差異無統(tǒng)計學意義(χ2=0.333,P=0.564)。
2.5術中和術后并發(fā)癥比較術后1wk中10眼出現(xiàn)前房積血(67%),其中8眼出現(xiàn)少量前房積血,2眼出現(xiàn)中等前房積血,均在1wk內自行消退;術后1mo內5眼(33%)出現(xiàn)一過性高眼壓,其中1眼于術后第10d出現(xiàn),最高達55mmHg,予以前房穿刺放液,口服乙酰唑胺片、降眼壓眼液治療2~3d后,眼壓恢復到正常范圍,術后6mo隨訪在未使用抗青光眼藥物情況下眼壓<21mmHg;1眼既往有脈絡膜脫離病史的患者,術后1wk發(fā)生低眼壓、眼底再次發(fā)生局部的脈絡膜脫離,予以擴瞳、局部及全身激素治療后,脈絡膜脫離完全恢復,末次隨訪時,應用1種抗青光眼藥物情況下眼壓<21mmHg;其余患者在隨訪6mo期間均無長期并發(fā)癥存在。所有患者皆未出現(xiàn)玻璃體腔積血、脈絡膜上腔出血、眼內炎、后彈力層脫離等嚴重并發(fā)癥,未再次接受其他抗青光眼手術。
3 討論
玻璃體切除術成功后長期慢性持續(xù)性的高眼壓是導致“不明原因”視力喪失的主要原因之一,持續(xù)性眼壓的升高造成視功能損害進行性加重。據報道,單純玻璃體切除術后繼發(fā)青光眼發(fā)生率為19%~39%[5-6],常見原因包括:硅油填充過多或硅油導致瞳孔阻滯、玻璃體切除手術本身的機械刺激導致眼部微血管的通透性增加,滲出的炎性細胞沉積于小梁網并破壞血-房水屏障;氧化因子刺激損傷小梁網細胞[7]造成小梁網的炎癥、纖維瘢痕,眼底缺血導致房角新生血管形成;乳化的硅油或硅油滴或被巨噬細胞所吞噬的硅油滴阻塞小梁網和Schlemm管及其下游通道,以及長期使用激素類藥物等均可使眼壓升高,進而發(fā)展為青光眼[8-10];Chang[8]推測青光眼發(fā)生的主要原因是玻璃體切除術后氧氣從玻璃體腔擴散到前房,穿過小梁網時引起氧化應激,導致房水外流阻力增加,從而導致眼壓升高[11-12]。
對于玻璃體切除術后繼發(fā)性高眼壓,通常經過前房穿刺等對癥治療和/或聯(lián)合降眼壓藥物治療后即可得到一定控制,也可以用選擇性激光小梁成形術治療。若藥物治療和激光治療都無法充分控制眼壓,則需要針對病因進行手術治療,如小梁切除術、睫狀光凝術、引流裝置植入術等[13],然而玻璃體切除術后繼發(fā)青光眼的病因復雜,且多次手術對球結膜破壞較大,屬于難治性青光眼范疇。傳統(tǒng)的小梁切除術常難以取得較好的手術效果,且容易出現(xiàn)早期淺前房、低眼壓等手術并發(fā)癥;術后結膜瘢痕化形成是濾過性手術失敗的主要危險因素[14]。睫狀體光凝術屬于破壞性手術,易引發(fā)視力減弱、眼球萎縮等并發(fā)癥。Errico等[15]報道青光引流閥植入術較傳統(tǒng)小梁切除術相比,對于硅油填充術后繼發(fā)性青光眼的治療效果要好,但引流管容易引起硅油游離入結膜下,引發(fā)炎癥反應;另一方面,殘留的非乳化或乳化硅油可以經引流管進入引流盤周圍,刺激引流盤周圍纖維增殖,致濾過泡纖維包裹[4],從而導致手術失敗。
近10a來,以GATT為代表的微創(chuàng)青光眼手術逐漸成為當下抗青光眼手術的研究熱點。GATT是一種改良的小梁切開術在房角鏡輔助下將微導管或縫線環(huán)穿Schlemm管后,利用其張力切開小梁網及Schlemm管內壁,實現(xiàn)房水從前房直接進入集液管,避免小梁網阻力,從而降低眼壓。GATT可有效降低原發(fā)性開角型青光眼、青少年開角型青光眼、繼發(fā)性開角型青光眼、以及其他手術失敗后的開角型青光眼的藥物負擔和眼壓,逐漸成為開角型青光眼的首選手術[16]。玻璃體切除術后的患者結膜傷口瘢痕化,GATT優(yōu)勢在于不破壞結膜的情況下直接進入前房行360°全周小梁切開,術后不依賴濾過泡,不存在結膜瘢痕。Quan等[6]在GATT治療玻璃體切除術后繼發(fā)性開角型青光眼的臨床報告中回顧性評估了8例患者的結果,術后隨訪過程中所有患者的眼壓至少降低了50%;術前降低眼壓藥物的平均數(shù)量為4.8±0.9種,術后為1.6±1.4種(P<0.001)。除了術后1mo短暫的眼壓升高和前房積血外,無其他長期并發(fā)癥,且所有出血均在手術后1mo消退。
表1 納入患者手術前后各項指標比較

指標術前術后1d術后1wk術后1mo術后3mo術后6mo眼壓(x±s,mmHg)28.33±9.4817.47±3.7818.8±3.2919.13±3.6220.31±3.6618.03±3.23眼壓下降率(%)3834322936完全成功率(眼,%)7(47)8(53)5(33)4(27)4(27)條件成功率(眼,%)6(40)6(40)8(53)7(47)10(67)總成功率(眼,%)13(87)14(93)13(87)11(73)14(93)用藥數(shù)量[M(P25,P75),種]2(2,4)1(0,2)0(0,2)1(0,2)1(0,2)1(0,2)
本研究共觀察10例15眼玻璃體切除術后繼發(fā)性高眼壓患者,其中12眼(80%)術后6mo BCVA不變,術后6mo與術前BCVA比較無統(tǒng)計學差異((P>0.05)。術前平均眼壓28.33±9.48mmHg,術后1d,1wk,1,3,6mo平均眼壓下降率分別是38%、34%、32%、29%、36%;手術總成功率分別為87%、93%、87%、73%、93%;術后各時間點眼壓均較術前明顯下降(P<0.05),與Quan等[6]研究結果相近。術后6mo降眼壓藥物使用數(shù)量從術前2(2,4)種降為術后6mo 1(0,2)種,明顯低于術前(Z=-3.236,P<0.001),且隨訪期間均未再次接受其他抗青光眼手術。綜上表明,GATT是玻璃體切除術后繼發(fā)性高眼壓的有效治療方式。Aktas等[17]在關于Schlemm管中硅油滴的存在對于玻璃體切除術后繼發(fā)性青光眼的發(fā)展研究中指出,由于乳化液滴引起的小梁網功能障礙或阻塞Schlemm管,引起繼發(fā)性青光眼,對于此類房角是開放的病例,GATT手術可能是最安全有效的手術方式。在本研究10例患者15眼房角鏡檢查中12眼房角開放、2眼可見小于90°的周邊房角虹膜前黏連、1眼房角狹窄,與Aktas等[17]報道的結論相符。另外,在該研究中GATT術后常見的并發(fā)癥表現(xiàn)為:前房積血、一過性高眼壓、脈絡膜脫離、短暫的低眼壓等,最常見的并發(fā)癥即持續(xù)性或反復的前房積血,且均在1wk內自行消退。末次隨訪時無1眼發(fā)生玻璃體積血、脈絡膜上腔出血、眼內炎等嚴重并發(fā)癥。前房積血和一過性高眼壓是GATT術后最常見的并發(fā)癥[5, 16, 18-20],其發(fā)生率分別為12.5%~80.6%和8.2%~32.3%[16, 21-22]。本研究中術后早期前房積血和一過性高眼壓發(fā)生率分別為67%和33%,與既往研究報道的結果基本一致。
綜上,本研究結果顯示GATT治療玻璃體切除術后繼發(fā)性高眼壓效果較好,與傳統(tǒng)的濾過性手術相比,其安全性更高,術后潛在的并發(fā)癥發(fā)生率更低,在玻璃體切除術后高眼壓的治療中具有較好的前景。本研究的不足之處在于研究設計屬于回顧性病例分析,缺乏對照,樣本量相對較少,隨訪時間短,對于殘留的非乳化或乳化硅油滴導致房角關閉的病例尚未納入,因此研究結果具有一定局限性。尚需要前瞻性大樣本的隨機對照研究以進一步證實。

