針刺對抑郁大鼠海馬FKBPs/GR/BDNF信號通路相關因子表達的影響
李佳豪 王建云 李靜蘭 李北平 王海軍
抑郁癥是一種臨床常見的精神障礙疾病,以持續情緒低落、思維認知障礙、運動減緩為主要臨床特征[1]。不僅嚴重影響著人們的生活,甚至對整個家庭帶來各種程度的傷害。近幾年有關抑郁癥的研究都緊扣著海馬神經元的損傷與修復這一重要環節。海馬是一個十分容易受損的邊緣結構,長時間的慢性應激刺激會極易導致海馬神經元細胞減少,引起情緒和認知的改變,在多數抑郁癥發生的過程中扮演著突出作用[2]。研究發現,海馬組織能否實現對神經功能的調節,取決于大腦海馬內各個神經因子能否啟動神經細胞內的信號傳導[3]。
FKBP51與FKBP52是應激蛋白Hsp90的分子伴侶蛋白,發揮著調節類固醇激素受體活性的作用,它們能夠調控糖皮質激素受體(glucocorticoid receptor,GR)的敏感度,抑制了GR的核轉移[4-5],同時,FKBP51還可以催化GR成熟,調在應激反應的中起調節作用[6]。腦源性神經營養因子(brain derived neurotrophic factor,BDNF)是神經生長存活的重要分子,研究證據表明BDNF參與情緒障礙,在慢性應激活動中,GR/BDNF通路是引發相關抑郁癥發生的關鍵[6]。BDNF的缺失可致使神經元數量減少,多巴胺受體在低水平的BDNF介導下,導致神經元發育異常[7]。此信號通路被視為治療抑郁的下游靶標,通過將BDNF補充到大腦中可以在動物實驗中觀測到其能夠發揮類同與抗抑郁劑樣效應[8]。并且,對于慢性應激模型動物的行為學檢測可以證實海馬BDNF的蛋白表達出現下降趨勢,這也體現出在情緒障礙疾病中BDNF的重要意義[9]。
通過以上論述,我們有理由認為應激伴侶蛋白FKBP51和FKBP52可以調節GR的敏感性,進一步影響著BDNF的表達,腧穴“解郁方”是否可以通過此途徑治療抑郁癥,由此我們可以通過動物實驗深入觀察基于FKBPs-GR-BDNF信號通路,探求腧穴“解郁方”在治療抑郁癥時發揮的效應機制。
1 材料與方法
1.1 實驗動物
由北京斯貝福生物技術有限公司[許可證號:SCXK(京)2019-0010]提供SPF級SD雄性大鼠40只,均重(200±20)g。本實驗方案經過本單位倫理委員會批準(批號:2020E2M07)。在山西中醫藥大學實驗中心清潔級動物實驗室開展實驗飼養觀察,預養1周后進行均衡隨機化分為4組,空白組、模型組、針刺組,藥物組,每組10只。空白組大鼠同籠飼養,其余3組采用單籠孤養的方式進行實驗。
1.2 主要儀器
切片機(湖北,亞光YGQ-Ⅲ);石蠟包埋機(湖北,亞光YB-6LF);數顯恒溫水浴鍋(上海,邦西HH-4);凝膠成像分析儀(美國,Bio-rad U-niversalHood);光學顯微鏡(日本,尼康 Nikon H550L);自制曠場實驗箱(100 cm×100 cm);大鼠籠和大鼠固定板(由山西中醫藥大學實驗室提供);一次性針灸針(0.3 mm×13 mm)由北京中研太和醫療器械有限公司提供。電泳儀(BIO-RAD,mini protean 3 cell);電轉儀(HOEFER,TE77XP);酶標儀(芬蘭雷勃,MK3);成像系統(Tanon,Tanon-5200)。
1.3 主要試劑
鹽酸帕羅西汀(由浙江尖峰藥業有限公司生產,201102)。伊紅/蘇木素染色液(北京雷根生物技術有限公司);AR0030 PBS 緩沖液(博士德);二甲苯/多聚甲醛(天津市北辰方正式試劑廠);裂解液(碧云天);氯化鈉注射液(石家莊四藥有限公司);BCA蛋白定量試劑盒(Thermo,PICPI23223);發光液(Millipore,WBKLS0100);RIPA組織細胞快速裂解液(WKSUBIO,YC0020)。
1.4 造模方法
本實驗使用慢性不可預知性的溫和刺激法進行模型制備,要保證動物無法預料刺激的發生,同時還需要避免連續使用相同的刺激。經預實驗檢驗能夠造模成功,且避免因刺激過于強烈導致動物死亡的情況。實驗選取了7種不同的溫和刺激方式一起配合使用,包括有:4℃冷水游泳5分鐘、24小時禁水、24小時禁食、晝夜顛倒、吹熱風5分鐘、3小時束縛,夾尾5分鐘,對模型組三針刺組和藥物組大鼠每天隨機選擇1種應激刺激方式,并保證1周內平均每一種應激方式均被選擇1次,按照隨機原則將每種應激方式安排在28天當中。參考文獻進行制備[10]。
1.5 干預方法
空白組:不施加任何應激刺激因素,每籠五只,正常喂養。模型組:孤養,每籠一只,給予28天的不可預見應激刺激。針刺組:孤養,每籠一只,施加28天的應激刺激,選取燕平教授團隊前期通過實驗論證治療抑郁癥的經驗腧穴組方:“百會”“神門(雙)”“太沖(雙)”[11]。參照《實驗動物針灸穴位圖譜》取穴。“百會”位于大鼠頭頂骨正中;“神門”位于大鼠前肢內側腕部橫紋尺骨橈側緣凹陷中;“太沖”定位在大鼠足背第一、二跖骨間凹陷處。從造模第1天開始行針刺治療,針刺角度均為平刺,深度為0.2~0.5 cm,留針20分鐘,1次/天。藥物組:孤養,每籠一只,進行28天的應激刺激,從實驗開始當天給予藥物鹽酸帕羅西汀,給藥劑量為3.3 mg/kg,臨用時溶于蒸餾水配成混懸液,以1 mL/100 g灌胃給藥。
1.6 觀察指標和檢測方法
1.6.1 大鼠體質量的測定和一般情況觀察 在每天上午8點安靜狀態下觀察記錄大鼠的基本活動情況,對各組大鼠的排便和精神活動狀態進行觀察記錄;并在造模實驗開展前1天和第28天對各組大鼠進行稱重。
1.6.2 行為學檢測 曠場實驗:自制敞箱,將箱底等分5×5共25格,觀察者避免大聲驚嚇動物,單只單箱開展實驗。分別于造模開始的前1天及實驗第28天記錄各組每只大鼠的水平跨越移動格數與上肢直立的次數。
糖水消耗實驗:在造模開展的前3天適應性給予1%蔗糖水,第一天每籠2瓶,第二天1瓶,第3天禁水1晚;造模的前1天,每籠分別給1瓶1%蔗糖水和純水;24小時后,取出水瓶,稱重計量。實驗第28天后,重復此糖水消耗實驗,對每只大鼠的糖水消耗量稱重記錄。
1.6.3 免疫蛋白印跡法檢測GR、BDNF、FKBP51和FKBP52表達情況 大鼠取血完成后,迅速暴露其腦組織,在冰塊上小心地將大鼠海馬組織完整取出,用生理鹽水沖洗后,將海馬腦段分成左右兩段,將其中一段置入標記好的EP管中,置于液氮中速凍備用;另一段海馬組織用4%多聚甲醛固定液固定6小時以上(4℃),標記。
在冰上將組織剪成小碎片,將0.5 mL裂解液與40 mg組織放入勻漿器中使組織完全裂解。裂解后的樣品4℃ 12000 r/min離心15分鐘,取上清,進行蛋白質定量。先準備酶標板各孔標好,將配制比例為50∶1的BCA工作液,加入到酶標板中震蕩混勻,測定吸光值,并繪制標準曲線。將樣品溶液稀釋,所得溶液共20 mL,與200 mL的BCA工作液混勻,37℃下靜置0.5小時后,以0號管做為參照,測定吸光值。再將樣品的吸光值代入標準曲線計算出相應的蛋白含量(mg),進而得到樣品實際蛋白濃度(實際蛋白濃度=蛋白含量×稀釋倍數/20)。然后依據蛋白分子量的大小確定凝膠濃度,配置聚丙烯酰胺下層分離膠與濃縮膠,完成蛋白電泳后進行轉模。將NC膜放平皿中,加入封閉液,搖床振蕩2小時,用TBST洗膜5分鐘,重復三次,稀釋一抗,放至平皿中,放NC膜置搖床上,在4℃下過夜,第2日取出NC膜,使用TBST洗滌3次,每次10分鐘,加二抗稀釋液稀釋二抗,把NC膜放置二抗中,室溫搖床振蕩反應2小時,將NC膜夾出,TBST洗滌3次,每次5分鐘。配ECL顯色液,取ECL顯色液A和B等量混勻加在膜的正面暗室避光5分鐘,使用G:BOX chemiXR5掃描成像;使用Gel-Pro32軟件對結果進行灰度分析。
1.6.4 HE染色觀察大鼠海馬CA3區錐體細胞的變化 從抗凍緩沖液中選取大鼠腦組織切片,先二甲苯脫蠟,再用酒精梯度濃度浸泡,最后蒸餾水沖洗。然后入蘇木精水溶液中進行染色,根據染色程度調整時間,約為5分鐘。再在乙酸水和氨水中分化顏色,流水沖洗。然后用伊紅染色,時間2分鐘。分別以70%、80%、90%、純酒精進行梯度脫水,用二甲苯透明切片,晾干加膠后壓蓋玻片封固。在光鏡下觀察海馬組織,并用BX53熒光顯微成像系統拍照記錄。
1.7 統計學處理
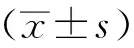
2 結果
2.1 各組大鼠的一般情況
在進行適應性喂養1周以后,各組大鼠的精神體貌和活躍度均表現良好,施加應激前各組大鼠體質量對比無明顯差異。在持續的慢性應激過程中:空白組大鼠因未施加任何干預,其毛色、活動度均表現良好,大便無異常;模型組與之進行比較,精神狀態、活躍度差,出現焦躁、啃咬鼠籠等情況,大便稀溏時有出現,且毛色欠光;針刺組精神狀態相對良好,大鼠反應基本靈敏,毛色尚有光澤,大小便正常;藥物組精神狀態一般,毛色缺乏光澤,出現大便時干時稀的情況。
大鼠實驗前后體質量的變化:實驗后,模型組與空白組大鼠體質量增長明顯降低,存在顯著差異(P<0.05);針刺組與藥物組同模型組相比較,具有統計學差異(P<0.05)。見表1。

表1 實驗前后各組大鼠體質量的變化
2.2 各組大鼠行為學檢測結果比較
2.2.1 各組大鼠曠場實驗結果的比較 實驗開始前,各組大鼠曠場實驗水平運動和直立次數沒有表現出明顯的差別(P>0.05);經過28天的應激干預后,空白組大鼠較之前的行為學表現上沒有發生明顯改變,而模型組大鼠水平與直立運動較第1天所測頻次明顯減少(P<0.05),說明造模成功。施加28天應激刺激并進行治療干預的針刺組與模型組相比較,水平與直立次數存在差異(P<0.05),同時也可以觀察到藥物組與模型組的行為學檢測對比差異具有統計學意義(P<0.05)。見表2。
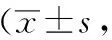
表2 各組大鼠曠場實驗水平運動和站立次數應激前后比較次)
2.2.2 各組大鼠糖水攝入量的結果比較 由表3可見,實驗開始前,各組大鼠糖水攝入量對比無明顯差異(P>0.05),施加應激刺激28天后,各組大鼠的糖水攝入量發生明顯改變,模型組大鼠糖水攝入明顯降低,并且顯著低于空白組(P<0.05),針刺組與藥物組糖水攝入量明顯高于模型組,差異有統計學意義(P<0.05)。但是針刺組與藥物組之間的糖水攝入差異不明顯(P>0.05)。

表3 各組大鼠糖水攝入量實驗前后比較
2.3 各組大鼠海馬的GR、BDNF、FKBP51和FKBP52的蛋白表達結果
如表4、圖1所示,模型組比空白組大鼠的FKBP51蛋白表達有所增加,而GR、BDNF、FKBP52的蛋白表達降低;針刺組與模型組相比,GR、BDNF、FKBP52平均光密度值顯著提升,FKBP51的蛋白表達有所降低(P<0.05);藥物組與模型組比較其上調GR、BDNF、FKBP52與降低FKBP51的蛋白表達能夠取得類同與針刺組的治療效益,但針刺組與藥物組治療所產生的效應趨勢無統計學差異(P>0.05)。

圖1 各組大鼠海馬GR、BDNF、FKBP51和FKBP52的蛋白表達情況

表4 各組大鼠海馬GR、BDNF、FKBP51、FKBP52水平的比較
2.4 各組大鼠海馬CA3區錐體細胞的形態結構、數目的影響
在400倍鏡視野下可觀察到空白組大鼠海馬CA3區大量的錐體細胞排列有序,細胞核藍染均勻,核仁明顯,胞質均勻,細胞形態結構未見異常改變;與之相對比,模型組的錐體細胞數目明顯減少,細胞畸形、間隙增大,且細胞排列不規則。許多的細胞胞漿空泡狀明顯,細胞核呈脊狀、三角形或不規則突起,出現了明顯的形態結構病理改變。與模型組比較,藥物組大部分椎體細胞相對完整、細胞與周圍組織聯系較為緊密、雖然有部分胞核出現固縮呈不規則形,但形態優于模型組,有部分胞核出現固縮呈不規則形,細胞核藍染欠均勻、細胞質較為均勻致密;針刺組錐體細胞整體形態要優于模型組和藥物組,偶有胞漿空泡狀染色質邊集、個別細胞胞核固縮呈三角形,見圖2。

注:A為空白組;B為模型組;C為藥物組;D為針刺組。圖2 鏡下觀察各組大鼠海馬CA3區錐體細胞的形態結構的差異(HE,×400)
3 討論
本實驗選用腧穴“解郁方”由百會、神門、太沖三穴組成,是山西中醫藥大學燕平教授團隊篩選出的對抑郁癥有明確療效的組穴,并且進行了大量的實驗論證[12-14]。百會,位巔上,屬督脈,稱“三陽五會”,手足三陽經之陽氣匯聚之處。宋代《銅人腧穴針灸圖經》中記載:“驚悸健忘針百會二分,得氣即瀉,可灸……又治思慮過多,心下怔仲,或自悲感慨。”《針灸大成》中有“百會心煩悶,驚悸健忘,忘前失后,心神恍惚”。百會從屬督脈,督脈為陽脈之海,與大腦關系密切。針刺百會穴可振奮陽氣、醒腦開竅、安神定志;神門穴為手少陰心經的輸穴、原穴,為心氣出入之門戶,有益氣寧心、通絡安神之功,《靈樞·五邪》篇論:“邪在心,則病心痛喜悲,時眩仆,視有余不足而調之其輸也。”心主血脈,又主神明。刺本穴可開心氣之郁結,可以減少抑郁焦慮癥狀,治療各種情志疾病;太沖穴屬陰主血為足厥陰肝經的輸穴、原穴,厥陰經多血少氣;五臟有疾當取之十二原,針灸該穴可以調整肝臟氣機從而起到保護肝臟,平穩情志,發揮“肝主疏泄,調情志”的作用,使情志和調,氣血和暢;三穴相配能振奮心陽,益氣和血,疏肝解郁從而治療抑郁癥。
本實驗通過免疫蛋白印跡法測定各組海馬GR、BDNF、FKBPs蛋白的表達水平情況,動物應激模型中,大鼠海馬GR、BDNF水平均出現了降低,且比較空白組有明顯差異。說明在慢性應激刺激下,導致GR受體表達下降,不能完全介入HPA軸進行負反饋調節,與此同時GR的表達可能會影響腦神經營養因子BDNF的表達,我們觀察針刺組與藥物組可以幫助應激大鼠海馬GR和BDNF的表達增高,這與觀察到的行為學抑郁狀態的改善是一致的。BDNF作為非常重要的腦神經營養因子,它對大腦神經元的保護是十分明確的,BDNF能夠通過多種分泌方式與其受體結合,是5-HT能神經元的生長因子[15-16]。當機體BDNF的水平迅速下降,會導致神經元樹突狀結構異常促使中樞神經神經元減少,進一步導致神經元損傷、神經的可塑性發生改變[17-18]。本次實驗結果顯示,慢性應激會升高FKBP51的蛋白表達,降低GR、BDNF、FKBP52的蛋白表達,促使海馬神經元的可塑性下降,導致海馬神經的功能受損。針刺“解郁方”可以提高FKBP52、GR和BDNF的表達,提高神經元的可塑性,從而發揮抗抑郁效益。
海馬區是主要調控一些情緒反應與學習記憶的重要腦區,其中海馬CA3區含有豐富的椎體神經細胞,對神經反射調節極其敏感,同時該區的神經元突觸結構也最易發生可塑性改變[19-20]。既往的研究發現CUMS干預會引起大鼠腦內海馬神經元超微結構出現損傷,導致海馬神經元萎縮和凋亡,是抑郁癥的重要原因[21]。通過本實驗微觀形態上觀察可以清楚地看出,慢性應激會使大鼠海馬CA3區大量的錐體細胞形態結構出現不同程度的損傷,細胞數量減少,出現許多錐體細胞腫脹,胞漿呈空泡狀,細胞核呈脊狀、三角形或不規則突起。
本研究觀察到針刺“解郁方”和給予藥物帕羅西汀對應激大鼠海馬CA3椎體細胞形態有著不同程度的改善。在肯定針刺治療療效的同時,我們也應更多的關注海馬神經元及其功能的修復在治療中的重要性,可以基于此方面,進一步挖掘當前有關精神障礙類疾患的發病與治療機制。

