不同核酸提取程序及擴增儀組合檢測呼吸道病毒的差異
鐘福春 陳甜 張抒彧 唐堯 羅薈辰 季文軒 薛飛 張愛芳 薛恒
急性呼吸道感染是引起門診就診和住院治療的主要原因之一,其中80%以上由病毒所致[1]。傳統的病毒分離培養方法操作煩瑣,臨床常規開展受限[2]。病毒抗原進行準確、快速檢測,有助于早期診斷,指導臨床精準選擇用藥,阻止疾病流行,并減少經驗性檢測敏感性較低,易受其他因素干擾的影響[2]。血清抗體檢測具有滯后性,主要用于病毒流行病調查[3]。基于病毒核酸的實時熒光定量RT-PCR方法因其所具備的優勢,是早期篩查和診斷呼吸道病毒感染的主要方法之一[4]。其中,對樣本進行核酸提取和對提取物進行擴增是目前通用的病毒核酸檢測步驟,然而核酸提取體系和擴增系統常常隨機混搭組合,形成多套檢測系統。這些不同的檢測系統在核酸檢測性能方面是否存在差別,須通過對比分析進行驗證。達安基因核酸提取或純化試劑(磁珠法)為常用的病毒核酸提取試劑,根據其說明書有常規核酸提取程序和快速核酸提取程序可供選擇。本研究選用這兩種核酸提取程序與不同的實時熒光定量PCR儀進行混搭組合,通過比較陽性檢出率、Ct值和批內重復性來探索不同檢測系統的性能差異,預期為實驗室選擇最適的檢測方案提供參考。
1 資料與方法
1.1 試劑和儀器
核酸提取或純化試劑(廣州達安基因股份有限公司,粵穗械備20170583,32反應/盒);核酸檢測試劑盒(廣州達安基因股份有限公司,國械注準20203400749,96人份/盒);Smart32核酸提取儀(廣州達安基因股份有限公司);ABI7500熒光定量PCR儀(美國應用生物系統公司);AGS8830-16實時熒光定量PCR儀(廣州達安基因股份有限公司)。
ABI7500和AGS8830-16熒光定量PCR儀分別為普通和快速實時熒光定量PCR儀。將核酸提取試劑的常規核酸提取程和快速核酸提取程序分別和兩種擴增系統進行混搭構建四種檢測系統,A為常規核酸提取程序+ABI7500熒光定量PCR儀,B為快速核酸提取程序+ABI7500熒光定量PCR儀,C為常規核酸提取程序+AGS8830-16實時熒光定量PCR儀,D為快速核酸提取程序+AGS8830-16實時熒光定量PCR儀。
1.2 一般材料
假病毒第三方弱陽性室內質控品為從廣州邦德盛生物科技有限公司購買的病毒核糖核酸液體室內質控品(批號 :2022201)平均濃度為5.1×102copies/mL,濃度參考范圍:2.03×102~1.28×103copies/mL。將弱陽性室內質控品用去離子水按1∶2、1∶5、1∶10、1∶50、1∶100和1∶500進行稀釋。分別采用A、B、C和D檢測系統對每個濃度質控品進行20次重復檢測。
1.3 方法
1.3.1 核酸提取
弱陽性室內質控品充分震蕩混勻后,于核酸提取96深孔板第1、7列孔內加入200 μL樣本或質控品、20200 μL蛋白酶K。將深孔板放入Smart32全自動核酸提取儀底座,磁棒套推入卡槽。按核酸提取試劑說明書設置57 min的常規核酸提取程序和18 min的快速核酸提取程序,分別對不同濃度的弱陽性室內質控品進行核酸提取,具體步驟見核酸提取儀和核酸提取試劑說明書。
1.3.2 核酸擴增
按擴增試劑說明書配置反應的體系、設置熒光定量PCR儀擴增反應的程序和熒光收集的通道。擴增反應結束后按擴增試劑說明書進行結果判定。具體步驟按儀器和擴增試劑說明書進行設置和操作。該擴增試劑可同時檢測3個靶基因,靶基因1和靶基因2為病毒相關基因,靶基因3為人源性內標基因,用于監控采樣質量。由于擴增試劑設置了擴增反應程序不采集前10個循環的熒光信號,因此,Ct值=原始Ct值+10。
1.4 統計學方法
使用SPSS 23.0統計學軟件進行數據分析。計量資料運用(±s)表示,各組間靶基因Ct值選用單因素方差分析來比較,當方差齊性時兩組間比表較選用LSD-t檢驗來比較,不齊時采用Tamhane's檢驗;計數資料采用n(%)表示。P<0.05為差異有統計學意義。
2 結果
2.1 4種檢測系統在不同濃度假病毒弱陽性室內質控品中靶基因的檢出率
在假病毒弱陽性室內質控品原濃度和1∶2稀釋度時,4種組合均100%檢出靶基因1及靶基因2。1∶5稀釋度時,A、B檢測系統均可100%檢出靶基因1及靶基因2;C、D檢測系統均可100%檢出靶基因2,但靶基因1的檢出率分別為90.00%和80.00%。隨弱陽性室內質控品濃度的降低,4種檢測系統靶基因的檢出率均隨之下降,其中靶基因檢出率由高到低為A>B>C>D,見表1。

表1 4種檢測系統在不同濃度假病毒弱陽性室內質控品中的靶基因檢出率(%)
2.2 4種檢測系統在不同濃度假病毒弱陽性室內質控品中的靶基因Ct值
4種檢測系統在質控品原濃度和1:2稀釋度時均可100%檢出靶基因,故比較這兩濃度擴增的Ct值。原濃度時,A、B、C和D系統擴增靶基因1的Ct值分別為(31.35±0.90)、(32.00±0.79)、(32.40±0.97)和(33.12±1.15),差異有統計學意義(F=11.286,P< 0.05);A系統靶基因1的Ct值小于B系統(LSD-t=-2.080,P<0.05)、小于C系統(LSD-t=-3.364,P=0.001)、小于D系統(LSD-t=-5.673,P<0.0001),B系統靶基因1的Ct值低于D系統(LSD-t=-3.593,P<0.001),C系統靶基因1的Ct值低于D系統(LSD-t=-2.309,P<0.05);A、B、C和D系統靶基因2的Ct值分別為(30.99±0.81)、(31.49±0.68)、(32.08±0.78)和(32.41±0.80),差異有統計學意義(F=12.749,P<0.05),A系統靶基因2的Ct值小于B系統(LSD-t=-2.017,P<0.05)、小于C系統(LSD-t=-4.378,P<0.0001)、小于D系統(LSD-t=-5.694,P<0.0001),B系統靶基因2的Ct值小于C系統(LSD-t=-2.361,P<0.05)、小于D系統(LSD-t=-3.677,P<0.001),見圖1a。1∶2稀釋度時,A、B、C和D系統靶基因1的Ct值分別為(32.88±0.47)、(33.07±0.62)、(33.62±0.55)和(34.32±0.70),差異有統計學意義(F=22.748,P<0.05),A系統靶基因1的Ct值小于C系統(LSD-t=-3.847,P<0.001)、小于D系統(LSD-t=-7.501,P<0.0001),B系統靶基因1的Ct值小于C系統(LSD-t=-2.889,P<0.01)、小于D系統(LSD-t=-6.543,P<0.0001),C系統靶基因1的Ct值低于D系統(LSD-t=-3.654,P<0.001);A、B、C和D系統靶基因2的Ct值分別為(32.70±0.52)、(32.97±0.62)、(33.19±0.62)和(34.12±0.81),差異有統計學意義(F=16.961,P<0.0001),A系統靶基因2的Ct值小于C系統(LSD-t=-2.338,P<0.05)、小于D系統(LSD-t=-6.713,P<0.0001),B系統靶基因2的Ct值低于D系統(LSD-t=-5.415,P<0.0001),C系統靶基因2的Ct值低于D系統(LSD-t=-4.375,P<0.0001),見圖1b。
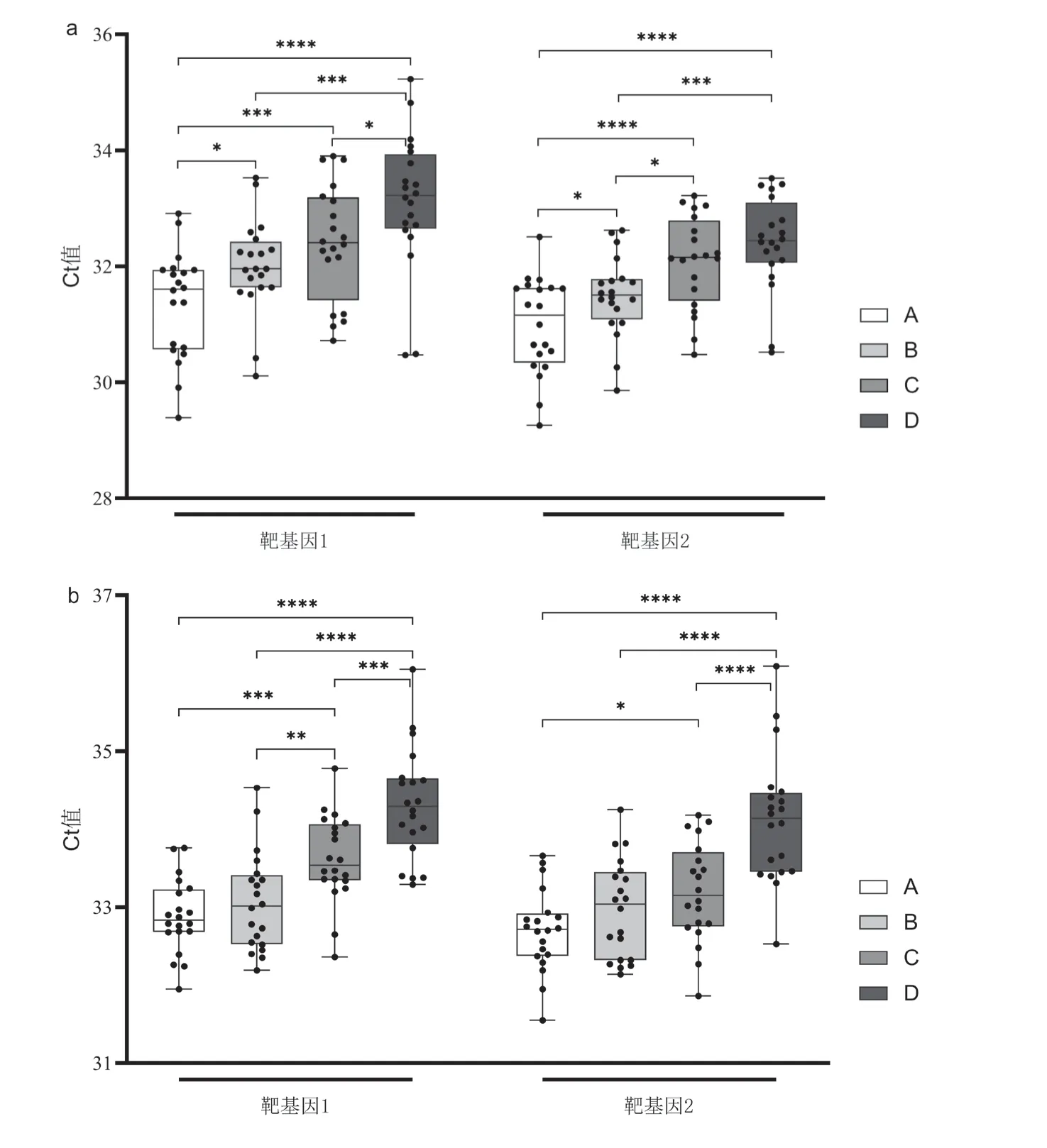
圖1 4種檢測系統在不同濃度假病毒弱陽性室內質控品中的靶基因Ct值
2.3 4種檢測系統的檢測耗時和批內重復性比較
常規核酸提取程序和快速核酸提取程序核酸提取耗時分別為57 min和18 min,ABI 7500熒光定量PCR儀和AGS8830-16實時熒光定量PCR儀擴增耗時分別為63 min和42 min。4種檢測系統檢測耗時由低到高為:D<C<B<A。A、B、C和D檢測系統在弱陽性室內質控品原濃度和1∶2稀釋度時檢測靶基因1和靶基因2Ct值的變異系數(CV)均<5%,均符合核酸提取和擴增試劑說明書批內重復性≤5%的標準,見表2。
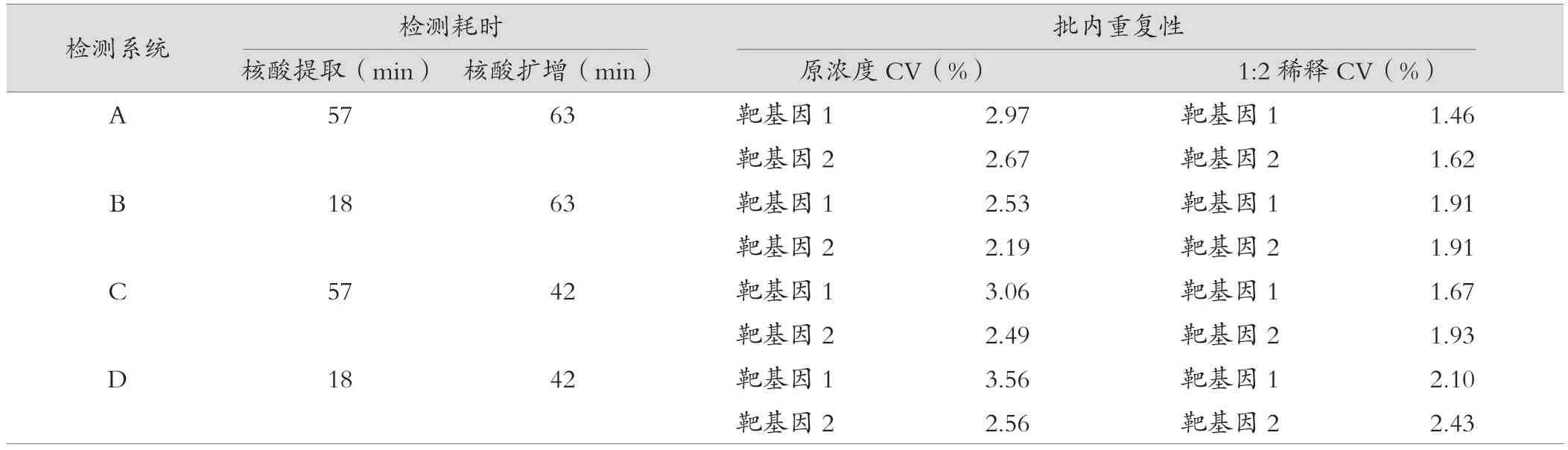
表2 4種檢測系統的檢測耗時和批內重復性比較
3 討論
急性呼吸道病毒感染的常規檢測方法包括基于病毒蛋白的抗原檢測、基于人體免疫反應的抗體檢測和基于病毒核酸的核酸檢測。抗原和抗體檢測無需專用分析儀器,通常30 min內即可判讀[5-6]。但是,需體內病毒載量足夠高時,才可得到準確結果,且存在交叉反應[5]。與其他檢測方法不同,實時熒光RT-PCR的特異性幾乎為100%,同時又具有較高的敏感性,病毒感染早期即能診斷[4]。這些特性使實時熒光RT-PCR成為病毒感染診斷的主要方法之一。在實際臨床檢測過程中,每個基因擴增實驗室通常使用多種核酸提取系統、擴增試劑和擴增系統,不同品牌的試劑和設備多混搭組合建立起多種核酸檢測系統。這些不同的檢測系統在核酸檢測性能方面是否存在差別,必須通過對比分析進行驗證。
實時熒光RT-PCR檢測病毒起始核酸模板質量,尤其當體內病毒載量十分低時能否順利檢出病毒核酸,直接關系到檢測結果是否準確,是否導致漏檢[7]。為了更好地體現4種檢測系統在病毒核酸檢測中性能差異,本研究選擇了第三方弱陽性室內質控品作為研究材料,并對其進行了不同程度的稀釋。對上述樣本進行核酸提取和擴增,就可以更好地摸清不同檢測系統的靶基因檢出能力及假陰性差異。
本研究中在弱陽性室內質控品原濃度和1∶2稀釋度時,A、B、C和D檢測系統均可以100%檢出靶基因;但檢測系統C和D在1∶5稀釋度時靶基因1的檢出率分別為90%和80%,而靶基因2可100%檢出,提示靶基因1和靶基因2的檢測敏感性存在著差異。隨著弱陽性室內質控品濃度的降低,A、B、C和D檢測系統靶基因的檢出率均隨之下降,檢出率由高到低為A>B>C>D,提示不同檢出系統靶基因檢出率存在著差別。進一步對靶基因的Ct值進行比較,結果發現在弱陽性室內質控品原濃度和1∶2稀釋度時,A檢測系統靶基因1和靶基因2的Ct值最低,D檢出系統最高,差異有統計學意義(P<0.05)。因此,可認為A檢測系統靶基因的Ct值越低,靶基因的檢出率越高,在病毒載量十分低時,其檢測優勢就越發明顯。由于4種檢測系統在弱陽性室內質控品原濃度和1∶2稀釋度時均可100%檢出靶基因,因此對這兩濃度質控品提取擴增后的C進行結果接近程度的評估,結果顯示4種檢測系統的批內重復性均在5%的范圍內,檢測結果均穩定,符合要求。在檢測耗時方面,常規核酸提取程序耗時57 min、快速核酸提取程序耗時18 min,普通實時熒光定量PCR儀耗時63 min、快速實時熒光定量PCR儀耗時42 min;因此,D檢測系統總體檢測耗時最低,A檢測系統最高,D檢測系統可明顯縮短全程檢測耗時,在特殊原因需要盡快得到核酸檢測結果的情形下具有明顯優勢。
既往研究發現,不同品牌核酸提取系統、擴增試劑和擴增系統的核酸檢測結果可出現一些差異[8-12]。黃裕游等[8]采用4種品牌的核酸提取試劑對第3方質控品進行了核酸提取,擴增提取物后發現不同提取試劑在陽性率、靶基因Ct值有差異。本研究使用同一種核酸提取系統,選用不同核酸提取程序進行核酸提取,檢測結果發現不同的核酸提取程序不僅在核酸提取耗時,而且在靶基因檢出率和擴增Ct值上也存在不同程度的差異。黃玉蘭等[9]選用3種普通擴增系統分別進行標本檢測,發現不同品牌擴增儀的檢測原理和使用維護狀況不同可引起檢測結果不同。本研究對普通實時熒光定量PCR儀和快速實時熒光定量PCR儀進行比較,也得出相似的結果。李卓敏等[10]采用不同的核酸提取儀與不同的擴增儀組合檢測陰性樣本和弱陽性室內質控品,發現不同系統組合在檢測效能上存在差別。本研究選用同一核酸提取試劑不同核酸提取程序與不同的擴增系統進行組合建立4種檢測系統,也發現這些不同試劑和儀器設備隨機混搭組也可對檢測結果產生影響,甚至出現漏診的風險。
綜上所述,本研究采用不同的核酸提取程序與不同的擴增系統組合建立了4種核酸檢測系統,結果顯示4種檢測系統的檢測性能存在差別。同時也顯示,同一核酸提取系統不同的核酸提取程序也可對病毒核酸檢測結果產生影響。因此,實驗室應根據自身條件和檢測需求選擇最適的核酸檢測體系。本研究的不足在于使用弱陽性室內質控品代替病毒感染患者樣本來比較不同檢測系統的性能,弱陽性室內質控品為假病毒,而且與患者樣本在基質上存在著不同,可能影響檢測的結果。

