芹菜素調節AMPK/mTOR通路對子癇前期胎盤滋養細胞自噬的影響研究
王光祖,王少敏,喬素蘭,李曉敬,姚春霞,布蘭娜


〔摘要〕 目的 探究芹菜素對子癇前期(preeclampsia, PE)胎盤滋養細胞自噬的影響及可能的作用機制。方法 取人絨毛膜滋養層HTR-8/Svneo細胞,采用缺氧復氧1 h(hypoxic-reoxygenation 1 h, H1R1)誘導建立PE細胞模型,并通過MTT法檢測芹菜素對HTR-8/Svneo細胞毒性的影響。取對數生長期的HTR-8/Svneo細胞,分為對照組、H1R1組、腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)激活劑阿卡地新(acadesine, AICAR)組(1 mmol/L)、芹菜素低劑量組(10 μmol/L)、芹菜素高劑量組(20 μmol/L)、芹菜素+AICAR組(芹菜素20 μmol/L+AICAR 1 mmol/L)。采用MTT法檢測細胞活力;透射電子顯微鏡觀察細胞自噬情況;劃痕實驗和Transwell小室實驗檢測細胞遷移、侵襲能力;Western blot法檢測細胞AMPK/哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路和自噬、侵襲相關蛋白的表達。結果 與對照組比較,10、20 μmol/L芹菜素對HTR-8/Svneo細胞增殖有促進作用(P<0.05)。與對照組比較,H1R1組細胞在24、48、72 h時細胞活力、劃痕愈合率和穿膜細胞數、N-鈣黏蛋白(N-cadherin)表達、p-mTOR/mTOR比值顯著降低(P<0.05),微管相關蛋白1輕鏈3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ, LC3Ⅱ)/微管相關蛋白1輕鏈3-Ⅰ(microtubule-associated protein 1 light chain 3-Ⅰ, LC3Ⅰ)比值、Beclin-1和E-鈣黏蛋白(E-cadherin)表達、p-AMPK/AMPK比值顯著升高(P<0.05),自噬小體數量增多(P<0.05);與H1R1組比較,芹菜素低、高劑量組細胞活力、劃痕愈合率和穿膜細胞數、N-cadherin表達、p-mTOR/mTOR比值顯著升高(P<0.05),LC3II/LC3I比值、Beclin-1和E-cadherin表達、p-AMPK/AMPK比值顯著降低(P<0.05),自噬小體數量減少(P<0.05);與芹菜素高劑量組比較,芹菜素+AICAR組細胞在24、48、72 h時細胞活力、劃痕愈合率和穿膜細胞數、N-cadherin表達、p-mTOR/mTOR比值顯著降低(P<0.05),LC3II/LC3I比值、Beclin-1和E-cadherin表達、p-AMPK/AMPK比值顯著升高(P<0.05),自噬小體數量增多(P<0.05)。結論 芹菜素能增強滋養細胞的侵襲能力,改善PE,其作用機制可能與抑制AMPK/mTOR通路介導的胎盤滋養細胞過度自噬有關。
〔關鍵詞〕 芹菜素;子癇前期;胎盤滋養細胞;自噬;遷移;侵襲;腺苷酸活化蛋白激酶;哺乳動物雷帕霉素靶蛋白
〔中圖分類號〕R285.5? ? ? ?〔文獻標志碼〕A? ? ? ? 〔文章編號〕doi:10.3969/j.issn.1674-070X.2023.08.008
Effects of apigenin on autophagy of placental trophoblast cells in preeclampsia by regulating AMPK/mTOR pathway
WANG Guangzu1, WANG Shaomin1, QIAO Sulan1, LI Xiaojing1, YAO Chunxia2, BU Lanna1*
1. Department of Neonatology, Handan Maternal and Child Health Hospital & Handan Children's Hospital, Handan, Hebei 056000, China; 2. School of Medicine, Hebei University of Engineering, Handan, Hebei 056038, China
〔Abstract〕 Objective To explore the effects of apigenin on autophagy of placental trophoblast cells in preeclampsia (PE) and its possible mechanism of action. Methods Human chorionic trophoblast HTR-8/Svneo cells were taken and hypoxia-reoxygenation 1 h (H1R1) was used to induce the establishment of PE cell models. The effects of apigenin on HTR-8/Svneo cytotoxicity was tested by MTT method. In addition, HTR-8/Svneo cells in logarithmic growth phase were taken and divided into control group, H1R1 group, adenosine monophosphate-activated protein kinase (AMPK) activator acadesine (AICAR) group (1 mmol/L), low-dose apigenin group (10 μmol/L), high-dose apigenin group (20 μmol/L), and apigenin+AICAR group (apigenin 20 μmol/L+AICAR 1 mmol/L). Cell viability was determined by MTT method; cell autophagy was observed by transmission electron microscope; cell migration and invasion ability were tested by scratch assay and Transwell chamber assay. Western blot method was used to examine the related protein expressions of cellular AMPK/mammalian target of rapamycin (mTOR) pathway, autophagy, and invasion. Results Compared with the control group, 10 and 20 μmol/L apigenin had a promoting effect on the proliferation of HTR-8/Svneo cells (P<0.05). Compared with the control group, the cell viability at 24, 48, and 72 h, scratch healing rate, number of transmembrane cells, N-cadherin expression, and p-mTOR/mTOR ratio of the H1R1 group were significantly lower (P<0.05), while the microtubule-associated protein 1 light chain 3 Ⅱ (LC3Ⅱ)/microtubule-associated protein 1 light chain 3 Ⅰ(LC3Ⅰ) ratio, Beclin-1 and E-cadherin expressions, p-AMPK/AMPK ratio were significantly higher (P<0.05), and the number of autophagosomes increased (P<0.05); compared with the H1R1 group, the cell viability at 24, 48, and 72 h, scratch healing rate, number of transmembrane cells, N-cadherin expression, and p-mTOR/mTOR ratio in low- and high-dose apigenin groups were significantly elevated (P<0.05), while LC3II/LC3I ratio, Beclin-1 and E-cadherin expressions, and p-AMPK/AMPK ratio were significantly reduced (P<0.05), and the number of autophagosomes became lower (P<0.05); compared with high-dose apigenin group, the cell viability at 24, 48 and 72 h, scratch healing rate, number of transmembrane cells, N-cadherin expression, and p-mTOR/mTOR ratio of apigenin+AICAR group were significantly lower (P<0.05), while LC3II/LC3I ratio, Beclin-1 and E-cadherin expressions, and p-AMPK/AMPK ratio were significantly higher (P<0.05), and the number of autophagosomes increased (P<0.05). Conclusion Apigenin can enhance the invasion ability of trophoblast cells and thus improve PE, and its mechanism of action may be related to the inhibition of the excessive autophagy of placental trophoblast cells mediated by AMPK/mTOR pathway.
〔Keywords〕 apigenin; preeclampsia; placental trophoblast cells; autophagy; migration; invasion; adenosine monophosphate-activated protein kinase; mammalian target of rapamycin
子癇前期(preeclampsia, PE)是妊娠期女性常見的一種母嬰共患疾病,胎盤是PE發病機制的核心,與異常滋養層細胞浸潤有關[1]。自噬在胚胎發生、植入和妊娠維持中起著重要作用,過度自噬被認為是PE發病過程中胎盤的一個重要特征[2],對滋養細胞自噬的調節是治療PE的重點。芹菜素是一種黃酮類化合物,具有抗氧化和抗炎作用,亦可降低胰島素抵抗,改善妊娠糖尿病,而胰島素抵抗為PE的病因之一[3]。此外,芹菜素還可抑制內質網應激,改善妊娠糖尿病大鼠胰腺組織損傷和胰島細胞凋亡[4],并可改善妊娠高血壓[5]。芹菜素的作用可能與其控制自噬的能力有關[6-7]。然而,芹菜素是否能調節PE中滋養細胞自噬尚未可知。
哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是調節細胞自噬的關鍵蛋白,已有研究證實,PE期間p-mTOR胎盤表達降低、mTOR信號通路抑制,通過降低滋養層細胞的侵襲能力誘導PE的發生[8];激活mTOR信號通路可增強PE大鼠胎盤滋養細胞增殖分化[9]。而在PE期間,與mTOR通路相關的基因p-AMPK胎盤表達增加,并且與正常孕婦相比,嚴重PE患者腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)較高[10]。AMPK是細胞能量代謝的關鍵調節因子,對于正常胎盤和胚胎發育至關重要。AMPK的過度激活會損害PE中滋養細胞的侵襲性[11]。mTOR是AMPK的下游靶標之一,AMPK和mTOR的活性在自噬調節方面具有拮抗作用,AMPK激活負向調節mTOR活性、正向調節自噬活性[12]。據報道,重度PE患者胎盤中mTOR活性下降,滋養細胞自噬過度激活,侵襲能力降低;抑制胎盤滋養細胞自噬,可延緩PE進展[13]。這提示,PE患者胎盤中AMPK的激活可下調mTOR活性,誘導滋養細胞過度自噬,可能是PE發病的重要機制。基于以上研究,本研究推測芹菜素可能通過AMPK/mTOR通路調控PE胎盤滋養細胞自噬,并對此展開研究。
1 材料
1.1? 細胞
人絨毛膜滋養層HTR-8/Svneo細胞購自武漢普諾賽生命科技有限公司,批號:20210615;HTR-8/Svneo維持在RPMI1640培養基(含10%胎牛血清、1%青-鏈霉素)中,于37 ℃、5% CO2的環境中培養。
1.2? 藥品與主要試劑
芹菜素(純度>98%,批號:201109,成都瑞芬思生物科技有限公司);阿卡地新(acadesine, AICAR)(AMPK激活劑,批號:20210724)、MTT試劑盒(批號:20210805)、RIPA裂解液(批號:20210622)均購自上海碧云天生物技術有限公司;胎牛血清(批號:210316)、RPMI1640培養基(批號:210409)、胰蛋白酶(批號:210420)均購自美國Gibco公司;兔源一抗微管相關蛋白1輕鏈3(microtubule-associated protein 1 light chain 3, LC3)Ⅱ/Ⅰ(批號:20210812)、E-鈣黏蛋白(E-cadherin)(批號:20210524)、N-鈣黏蛋白(N-cadherin)(批號:20210608)、AMPK(批號:20210519)、p-AMPK(批號:20210420)、mTOR(批號:20210615)、p-mTOR(批號:20210617)、Beclin-1(批號:20210506)抗體均購自英國Abcam公司。
1.3? 主要儀器
超薄切片機(型號:Leica EM UC7,德國Leica公司);多功能酶標儀(型號:iMark680,美國Bio-Rad公司);倒置熒光顯微鏡(型號:IX73,日本Olympus公司);透射電子顯微鏡(型號:JEM-1230,日本Jeol公司)。
2 方法
2.1? PE細胞模型建立及芹菜素的細胞毒性實驗
采用缺氧復氧1 h(hypoxic-reoxygenation 1 h, H1R1)誘導建立PE細胞模型[14]。取HTR-8/Svneo細胞(1×105個/mL),接種于96孔板(200 μL/孔),培養24 h,待細胞達到70%~80%融合時,換用含芹菜素終濃度為0、5、10、20、40、80 μmol/L的培養基處理24 h。然后,將細胞置于低氧環境(1%O2、5%CO2、94%N2)中培養1 h,再進行常氧(21%O2)處理。H1R1后,向每個孔中加入40 μL MTT溶液(5 mg/mL),繼續孵育2 h。使用酶標儀檢測570 nm波長下各孔吸光度(A)值,與未經芹菜素處理的對照細胞相比,計算芹菜素處理組的細胞活力。細胞活力=(芹菜素處理組A值-空白孔A值)/(未經芹菜素處理組A值-空白孔A值)×100%。
2.2? 細胞分組與處理
取HTR-8/Svneo細胞,分為對照組(常氧21%O2培養,不作處理)、H1R1組(1%O2/21%O2培養)、AICAR組(給予AMPK激活劑AICAR 1 mmol/L處理)、芹菜素低劑量組(10 μmol/L)、芹菜素高劑量組(20 μmol/L)、芹菜素+AICAR組(給予芹菜素20 μmol/L和AICAR 1 mmol/L處理)。此外,AICAR組、芹菜素各劑量組和芹菜素+AICAR組細胞分別給予相應劑量的藥物處理24 h后,進行H1R1誘導建立PE細胞模型。
2.3? MTT法檢測細胞活力
HTR-8/Svneo細胞以2×104個/孔的密度接種于96孔板中,每孔200 μL(細胞密度為1×105個/mL),按照“2.2”項分組進行處理后,在24、48、72 h分別向每孔加入40 μL MTT溶液(5 mg/mL),孵育2 h。檢測各組細胞在570 nm處的A值(A570 nm值),評估細胞活力。
2.4? 透射電子顯微鏡觀察細胞自噬
將各組細胞用2.5%戊二醛-1%餓酸固定,PBS洗后,梯度乙醇和丙酮進行脫水,然后包埋在純812包埋劑中,在60 ℃烘箱中聚合48 h;使用超薄切片機將樣品切成60~80 nm的超薄切片。切片用3%醋酸鈾-枸櫞酸鉛雙染色,在透射電子顯微鏡下觀察細胞自噬。
2.5? 劃痕實驗檢測細胞遷移能力
取對數生長期的HTR-8/Svneo細胞,以1×105個/mL的密度接種在60 mm培養皿中,并使其生長24 h。用無菌藍色移液管的尖端刮擦劃一道劃痕。隨后,按照“2.2”項進行分組與處理,并將細胞再培養24 h。在0 h和24 h時在同一位置用倒置顯微鏡拍照,計算劃痕愈合率。劃痕愈合率=(1-24 h劃痕寬度/0 h劃痕寬度)×100%。
2.6? Transwell實驗檢測細胞侵襲能力
取HTR-8/Svneo細胞按照“2.2”項進行分組和處理后,重懸在無血清培養液中(2×104個/mL)。取200 μL細胞懸液加入上室(預先包被Matrigel),600 μL培養基(含10%胎牛血清)加入下室。培養48 h后,將穿膜細胞固定在4%多聚甲醛中30 min,在結晶紫染液中染色20 min后,在倒置顯微鏡下對侵襲細胞進行計數。
2.7? Western blot法檢測細胞AMPK/mTOR通路和自噬、侵襲相關蛋白的表達
RIPA裂解液提取經芹菜素和H1R1處理后的HTR-8/Svneo細胞總蛋白。測量蛋白濃度后,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離等量蛋白樣品(30 μg),并轉至聚偏二氟乙烯膜上。將膜封閉在5%脫脂牛奶中1 h,將膜在4 ℃下與在封閉溶液中稀釋的一抗(AMPK、p-AMPK、mTOR、p-mTOR、Beclin-1、LC3Ⅱ/Ⅰ、E-cadherin、N-cadherin、β-actin,1∶1 000)孵育過夜。將膜在室溫下用二抗(1∶4 000)孵育1 h后,顯影,檢測條帶灰度值,計算目的蛋白表達量。
2.8? 統計學分析
采用SPSS 22.0軟件進行統計分析,計量資料用“x±s”表示,數據分布的正態性和方差齊性分別通過Kolmogorov-Smirnov檢驗和Levene檢驗進行分析,多組間比較符合正態分布且方差齊時采用單因素方差分析,組間兩兩比較采用LSD-t檢驗;方差不齊時,選擇Dunnett-t3檢驗;不服從正態分布者,采用秩和檢驗。P<0.05表示差異有統計學意義。
3 結果
3.1? 不同濃度的芹菜素對H1R1誘導的HTR-8/Svneo細胞毒性的影響
與0 μmol/L的芹菜素濃度比較,5、10、20、40 μmol/L的芹菜素對HTR-8/Svneo細胞無明顯毒性作用。10 μmol/L芹菜素對HTR-8/Svneo細胞增殖有促進作用(P>0.05),20 μmol/L時促進作用更明顯,差異有統計學意義(P<0.05),當劑量達到80 μmol/L時有抑制HTR-8/Svneo細胞增殖的趨勢(P<0.05)。詳見表1。故選擇10、20 μmol/L芹菜素用于后續實驗。3.2? 芹菜素對H1R1誘導的HTR-8/Svneo細胞活力的影響
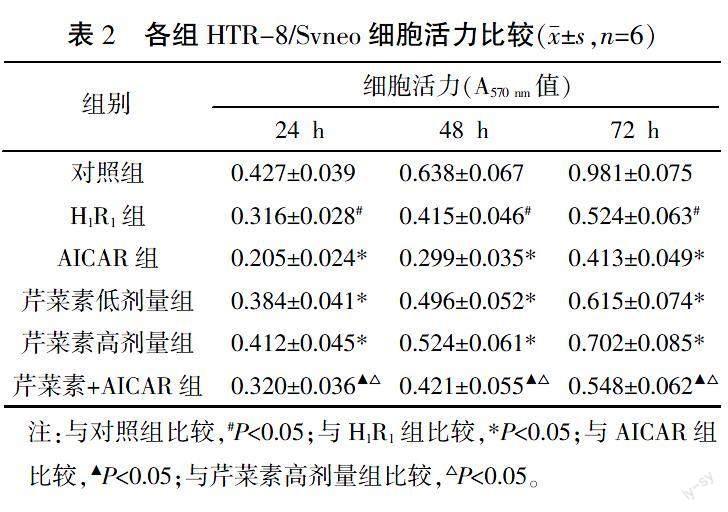
與對照組比較,H1R1組細胞在24、48、72 h時細胞活力顯著降低(P<0.05);與H1R1組比較,AICAR組細胞活力顯著降低(P<0.05),芹菜素低、高劑量組細胞活力顯著升高(P<0.05);與AICAR組比較,芹菜素+AICAR組細胞活力顯著升高(P<0.05);與芹菜素高劑量組比較,芹菜素+AICAR組細胞活力顯著降低(P<0.05)。詳見表2。
3.3? 芹菜素對H1R1誘導的HTR-8/Svneo細胞自噬的影響
與對照組比較,H1R1組細胞中自噬小體數量增多(P<0.05);與H1R1組比較,AICAR組細胞中自噬小體數量增多(P<0.05),芹菜素低、高劑量組細胞中自噬小體數量減少(P<0.05);與AICAR組比較,芹菜素+AICAR組細胞中自噬小體數量減少(P<0.05);與芹菜素高劑量組比較,芹菜素+AICAR組細胞中自噬小體數量增多(P<0.05)。詳見表3、圖1。
3.4? 芹菜素對H1R1誘導的HTR-8/Svneo細胞遷移、侵襲能力的影響
與對照組比較,H1R1組細胞劃痕愈合率和穿膜細胞數顯著降低(P<0.05);與H1R1組比較,AICAR組細胞劃痕愈合率和穿膜細胞數顯著降低(P<0.05),芹菜素低、高劑量組細胞劃痕愈合率和穿膜細胞數顯著升高(P<0.05);與AICAR組比較,芹菜素+AICAR組細胞劃痕愈合率和穿膜細胞數顯著升高(P<0.05);與芹菜素高劑量組比較,芹菜素+AICAR組細胞劃痕愈合率和穿膜細胞數顯著降低(P<0.05)。詳見表4、圖2。
3.5? 芹菜素對H1R1誘導的HTR-8/Svneo細胞中自噬、侵襲相關蛋白表達的影響
與對照組比較,H1R1組細胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表達顯著升高(P<0.05),N-cadherin表達顯著降低(P<0.05);與H1R1組比較,AICAR組細胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表達顯著升高(P<0.05),N-cadherin表達顯著降低(P<0.05),芹菜素低、高劑量組細胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表達顯著降低(P<0.05),N-cadherin表達顯著升高(P<0.05);與AICAR組比較,芹菜素+AICAR組細胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表達顯著降低(P<0.05),N-cadherin表達顯著升高(P<0.05);與芹菜素高劑量組比較,芹菜素+AICAR組細胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表達顯著升高(P<0.05),N-cadherin表達顯著降低(P<0.05)。詳見圖3、表5。
3.6? 芹菜素對H1R1誘導的HTR-8/Svneo細胞中AMPK/mTOR通路的影響
與對照組比較,H1R1組細胞中p-AMPK/AMPK比值升高、p-mTOR/mTOR比值降低(P<0.05);與H1R1組比較,AICAR組細胞中p-AMPK/AMPK比值升高、p-mTOR/mTOR比值降低(P<0.05),芹菜素低、高劑量組p-AMPK/AMPK比值降低、p-mTOR/mTOR比值升高(P<0.05);與AICAR組比較,芹菜素+AICAR組p-AMPK/AMPK比值降低、p-mTOR/mTOR比值升高(P<0.05);與芹菜素高劑量組比較,芹菜素+AICAR組細胞中p-AMPK/AMPK比值升高、p-mTOR/mTOR比值降低(P<0.05)。詳見圖4、表6。
4 討論
在正常妊娠中,胎盤的滋養細胞侵入子宮壁并用低阻力的血管系統取代高阻力的子宮螺旋動脈和小動脈,而這種重塑在PE中是有缺陷的(可能繼發于胎兒-母體間期免疫反應的改變),可能導致胎盤缺血[15]。PE長期以來一直被認為是胎盤的缺血性疾病,缺氧可引起細胞侵襲力減弱,并影響滋養細胞向侵襲性表型分化[16];此外,H1R1可誘導滋養細胞AMPK激活,可有效誘導HTR8/SVneo滋養細胞PE前期研究模型[14],因此,本研究通過H1R1誘導建立PE滋養細胞模型。結果顯示,與常氧處理細胞相比,H1R1可降低滋養細胞的遷移、侵襲能力,并上調p-AMPK/AMPK比值,激活AMPK。
芹菜素是在芹菜、歐芹、洋蔥、茶和葡萄柚等蔬菜和水果中發現的天然黃酮類化合物之一。黃酮類化合物可以作為抗氧化劑,保護生物分子免受氧化損傷。據報道,芹菜素可改善妊娠糖尿病和妊娠高血壓,并降低胰島素抵抗[3,5]。而氧化應激會導致胎盤功能異常,糖尿病是PE的高危因素,胰島素抵抗為其病因之一,這提示芹菜素可能對PE具有保護作用。本研究首次探究了不同濃度的芹菜素對滋養細胞HTR-8/Svneo的影響,結果顯示,5、10、20、40 μmol/L的芹菜素對HTR-8/Svneo細胞無明顯毒性作用,并且10、20 μmol/L芹菜素對HTR-8/Svneo細胞有促增殖作用,而當劑量達到80 μmol/L時有抑制HTR-8/Svneo細胞增殖的趨勢,表明高濃度的芹菜素對HTR-8/Svneo細胞有明顯毒性,因此,選擇低濃度芹菜素(10、20 μmol/L)進一步研究其對HTR-8/Svneo細胞遷移與侵襲的影響,后續將在此試驗劑量范圍內設置多個濃度來進一步評估劑量依賴性。在妊娠期,滋養細胞通過上皮-間充質轉化獲得遷移、侵襲能力,進而侵入子宮內膜以重塑螺旋動脈,胎盤功能障礙與滋養細胞的遷移和侵襲不足密切相關[17]。本研究結果顯示,10、20 μmol/L芹菜素可顯著增加經H1R1處理后的HTR-8/Svneo細胞的遷移與侵襲能力;Western blot結果也證實,芹菜素可降低E-cadherin表達,升高N-cadherin表達。這表明芹菜素可增強H1R1處理后的HTR-8/Svneo細胞的遷移和侵襲能力,在PE中具有重要作用,然而,其調控HTR-8/Svneo細胞遷移和侵襲的機制尚不明確。
自噬在胚胎發生、植入和妊娠維持中起著重要作用,NAKASHIMA等[18-19]研究顯示,自噬機制在PE中受損,自噬抑制與胎盤不良有關,是PE胎盤的一個重要特征。然而,過度自噬也被認為是PE發病過程中胎盤的一個重要特征[2,20]。當mTOR的磷酸化被阻止時,滋養細胞自噬過度激活,妊娠早期滋養細胞侵襲能力降低[21];通過mTOR途徑調節自噬可進一步影響滋養細胞的侵襲和黏附[22]。以上研究表明,mTOR介導的細胞自噬可影響滋養細胞的侵襲。AMPK是mTOR的上游調控因子,也是調節細胞自噬的關鍵蛋白[12]。AMPK協調細胞生長、分化和營養運輸以維持細胞存活,在多種缺血性疾病中發揮重要作用[23]。AMPK的適當調節對于正常胎盤和胚胎發育至關重要,其失調可能導致妊娠相關疾病,如宮內生長受限、胎盤功能不全或PE。據報道,胎盤滋養層細胞中AMPK敲低會導致細胞形態和功能改變[24],AMPK激活可誘導滋養細胞分化,改善受異常胎盤影響的人胎盤中滋養細胞的功能[25]。但是,AMPK的過度激活會降低PE中滋養細胞的侵襲性[11]。TSAI等[8]研究指出,在PE期間,胎盤中p-mTOR表達降低,p-AMPK表達增加;KOROGLU等[10]也發現,嚴重PE患者的AMPK表達水平顯著高于健康孕婦和無嚴重特征的PE患者。本研究結果顯示,H1R1后HTR-8/Svneo細胞中p-AMPK/AMPK比值升高,p-mTOR/mTOR比值降低,并且采用AMPK激活劑AICAR上調p-AMPK/AMPK后,p-mTOR/mTOR比值進一步降低,HTR-8/Svneo細胞的自噬增加,侵襲能力減弱,這與TSAI等[8]的研究結果一致,與NAKASHIMA等[18-19]研究結果不一致,推測其原因可能與自噬的雙重作用有關。由此猜想:在PE患者胎盤中,過度激活的AMPK可能通過抑制mTOR活化,誘導滋養細胞過度自噬。而經芹菜素處理后,HTR-8/Svneo細胞中AMPK的激活被抑制,mTOR活化增加,細胞自噬減少,遷移與侵襲能力增強;并且使用AICAR可明顯減弱芹菜素對AMPK激活和自噬的抑制作用,并削弱芹菜素對HTR-8/Svneo細胞遷移和侵襲的促進作用。上述結果提示芹菜素可能通過抑制AMPK的激活,促進mTOR活化,進而抑制滋養細胞過度自噬,增強其侵襲能力。AICAR為AMPK/mTOR通路的激活劑,可進一步增強自噬,降低滋養細胞的遷移、侵襲能力,芹菜素與AICAR聯合使用后,AICAR對AMPK/mTOR通路的激活作用減弱了芹菜素對胎盤滋養細胞過度自噬的抑制作用,表明芹菜素可能通過抑制AMPK/mTOR通路發揮作用。
芹菜素可增強滋養細胞的侵襲能力,改善PE,其作用機制可能與抑制AMPK/mTOR通路介導的胎盤滋養細胞過度自噬有關。本研究結果尚需體內動物模型進一步證實。
參考文獻
[1] RANA S, LEMOINE E, GRANGER J P, et al. Preeclampsia: Pathophysiology, challenges, and perspectives[J]. Circulation Research, 2019, 124(7): 1094-1112.
[2] GU S Y, ZHOU C C, PEI J D, et al. Esomeprazole inhibits hypoxia/endothelial dysfunction-induced autophagy in preeclampsia[J]. Cell and Tissue Research, 2022, 388(1): 181-194.
[3] 趙? 崗, 楊? 麗, 樊秀梅. 芹菜素通過PI3K/Akt通路對妊娠期糖尿病大鼠胰島素抵抗的作用[J]. 藥物評價研究, 2020, 43(3): 417-422.
[4] 陳雪寧, 黃? 河, 蔡志善, 等. 芹菜素對妊娠期糖尿病大鼠內質網應激CHOP信號通路的影響[J]. 中國比較醫學雜志, 2021, 31(2): 45-50.
[5] BOGACZ A, MIKO?覵AJCZAK P , WOLEK M, et al. Combined effects of methyldopa and flavonoids on the expression of selected factors related to inflammatory processes and vascular diseases in human placenta cells-an in vitro study[J]. Molecules, 2021, 26(5): 1259-1277.
[6] MENG Z Q, GAO M, WANG C Y, et al. Apigenin alleviated high-fat-diet-induced hepatic pyroptosis by mitophagy-ROS-CTSB-NLRP3 pathway in mice and AML12 cells[J]. Journal of Agricultural and Food Chemistry, 2023, 71(18): 7032-7045.
[7] ZHANG Y Z, YANG Y, YU H T, et al. Apigenin protects mouse retina against oxidative damage by regulating the Nrf2 pathway and autophagy[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 9420704.
[8] TSAI K, TULLIS B, JENSEN T, et al. Differential expression of mTOR related molecules in the placenta from gestational diabetes mellitus (GDM), intrauterine growth restriction (IUGR) and preeclampsia patients[J]. Reproductive Biology, 2021, 21(2): 100503-100511.
[9] LAI W S, DING Y L. GNG7 silencing promotes the proliferation and differentiation of placental cytotrophoblasts in preeclampsia rats through activation of the mTOR signaling pathway[J]. International Journal of Molecular Medicine, 2019, 43(5): 1939-1950.
[10] KOROGLU N, TOLA E, TEMEL YUKSEL I, et al. Maternal serum AMP-activated protein kinase levels in mild and severe preeclampsia[J]. The Journal of Maternal-Fetal & Neonatal Medicine, 2019, 32(16): 2735-2740.
[11] YANG X T, XU P, ZHANG F M, et al. AMPK hyper-activation alters fatty acids metabolism and impairs invasiveness of trophoblasts in preeclampsia[J]. Cellular Physiology and Biochemistry, 2018, 49(2): 578-594.
[12] HAN D D, JIANG L L, GU X L, et al. SIRT3 deficiency is resistant to autophagy-dependent ferroptosis by inhibiting the AMPK/mTOR pathway and promoting GPX4 levels[J]. Journal of Cellular Physiology, 2020, 235(11): 8839-8851.
[13] 薛平平, 樊文強, 王慧艷, 等. 滋養細胞自噬在子癇前期胎盤中的形成及調控機制[J]. 中華圍產醫學雜志, 2017, 20(10): 712-717.
[14] 楊曉濤, 韓頂立, PHILIP N B, 等. 體外缺氧誘導子癇前期滋養細胞模型優化及代謝組學鑒定[J]. 重慶醫科大學學報, 2017, 42(8): 1045-1052.
[15] ZHOU W B, WANG H Y, YANG Y Q, et al. Trophoblast cell subtypes and dysfunction in the placenta of individuals with preeclampsia revealed by single-cell RNA sequencing[J]. Mole cules and Cells, 2022, 45(5): 317-328.
[16] 楊? 娟, 謝瑩鶯. miR-182調控HIF-2α通路對低氧誘導子癇前期滋養細胞侵襲的影響[J]. 安徽醫科大學學報, 2020, 55(6): 62-67.
[17] 方? 婕, 何? 潔, 吳俠霏, 等. 基于生物信息學篩選的CEBPA在子癇前期胎盤組織的表達及對滋養細胞上皮間質轉化的影響[J]. 實用婦產科雜志, 2022, 38(5): 358-363.
[18] NAKASHIMA A, CHENG S B, IKAWA M, et al. Evidence for lysosomal biogenesis proteome defect and impaired autophagy in preeclampsia[J]. Autophagy, 2020, 16(10): 1771-1785.
[19] NAKASHIMA A, TSUDA S, KUSABIRAKI T, et al. Current understanding of autophagy in pregnancy[J]. International Journal of Molecular Sciences, 2019, 20(9): 2342-2354.
[20] 殷? 荷, 王艷華, 吳琪瑞, 等. MiR-5088-5p在子癇前期患者胎盤組織中的表達及其對滋養細胞自噬的影響[J]. 實用醫學雜志, 2020, 36(24): 3312-3316.
[21] KNUTH A, LIU L, NIELSEN H, et al. Placenta growth factor induces invasion and activates p70 during rapamycin treatment in trophoblast cells[J]. American Journal of Reproductive Immunology, 2015, 73(4): 330-340.
[22] YANG D Y, DING J L, WANG Y Q, et al. YY1-PVT1 affects trophoblast invasion and adhesion by regulating mTOR pathway-mediated autophagy[J]. Journal of Cellular Physiology, 2020, 235(10): 6637-6646.
[23] 肖穎馥, 王? 能, 盛? 文, 等. 莓茶提取物對2型糖尿病大鼠糖脂代謝及肝臟SIRT1、AMPK、PGC-1α蛋白表達的影響[J]. 湖南中醫藥大學學報, 2023, 43(5): 807-813.
[24] CAREY E A, ALBERS R E, DOLIBOA S R, et al. AMPK knockdown in placental trophoblast cells results in altered morphology and function[J]. Stem Cells and Development, 2014, 23(23): 2921-2930.
[25] DREWLO S, JOHNSON E, KILBURN B A, et al. Irisin induces trophoblast differentiation via AMPK activation in the human placenta[J]. Journal of Cellular Physiology, 2020, 235(10): 7146-7158.
(本文編輯? 周? 旦)

