心臟代謝指數與非酒精性脂肪性肝病嚴重程度的相關性研究*
咸亞靜,王仁媛,李玉鳳,林棟羚,胡寧寧,林素蘭△
(1.新疆醫科大學護理學院,烏魯木齊 830017;2.新疆醫科大學第一臨床醫學院肝病中心,烏魯木齊 830054)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是以肝臟脂肪過度堆積為特征的系列疾病,與代謝綜合征(metabolic syndrome,MetS)和2型糖尿病(type 2 diabetes mellitus,T2DM)互為因果,其包括非酒精性單純性脂肪肝(non-alcoholic simple fatty liver,NAFL)和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH),后者繼而可能發展為進行性纖維化、肝硬化和肝細胞癌(hepatocellular carcinoma,HCC),同時死亡風險也隨之增加[1-3]。隨著社會經濟水平的不斷提高和生活方式的持續轉變,NAFLD的患病率逐年攀升,已成為全球排名第一的慢性肝臟疾病[4]。目前,我國NAFLD的防治形勢不容樂觀,NAFLD患病率已超過全球平均水平,未來還將會大幅度增長,預計在2016-2030年全國NAFLD患病人數將從2.46億例上升至3.15億例[2,5]。NAFLD不僅對人類生命質量和健康安全構成了嚴重威脅,也加重了患者個人及家庭的醫療經濟負擔。近年來,為實現早期識別高危人群、減輕疾病負擔,NAFLD有關血清學標志物受到國內外學者廣泛關注。有研究表明,心臟代謝指數(cardiometabolic index,CMI)是T2DM患者發生NAFLD的影響因素,與高血壓、動脈粥樣硬化及高尿酸血癥等代謝性疾病密切相關[6-7]。然而,關于CMI與NAFLD嚴重程度之間的關系尚不清楚,故本研究探討體檢人群CMI與NAFLD嚴重程度之間的相關性,進一步分析其在不同性別人群中對NAFLD嚴重程度的預測價值及最佳臨界值,以期為NAFLD的防治和個性化診斷提供參考依據。
1 資料與方法
1.1 一般資料
選取2022年1-4月在新疆醫科大學第一臨床醫學院參加健康體檢的人群。納入標準:(1)年齡≥18周歲;(2)男性飲酒折合乙醇量<210 g/周,女性飲酒折合乙醇量<140 g/周;(3)同意接受一般資料問卷調查和體格測量;(4)影像學檢查和實驗室指標檢測資料完整。排除標準:(1)罹患導致脂肪肝的特殊疾病,包括甲狀腺功能減退癥、脂質萎縮性糖尿病、Mauriac綜合征等;(2)罹患酒精性、自身免疫性、病毒性等其他診斷明確的肝臟疾病;(3)近3個月內服用過影響脂質代謝的藥物;(4)合并惡性腫瘤、精神障礙及心血管疾病。根據上述納入排除標準,共有536例體檢者入選本次研究。本研究經新疆醫科大學倫理委員會審核批準(審批號:XJYKDXR20220513002),所有受試者均知情同意。
1.2 方法
1.2.1NAFLD診斷標準及分組
本研究參考《非酒精性脂肪性肝病防治指南(2018年更新版)》[8]和《非酒精性脂肪性肝病診療指南(2006年2月修訂)》[9]中的影像學診斷標準,以肝臟B型超聲作為診斷工具。根據超聲診斷NAFLD標準,將研究對象分為NAFLD組和非NAFLD組;其中NAFLD組272例,男164例、女108例,平均年齡(44.49±11.44)歲;非NAFLD組264例,男100例、女164例,平均年齡(43.42±11.67)歲。兩組性別構成有明顯差異(χ2=26.931,P<0.05),年齡無明顯差異(t=-1.070,P>0.05)。依據超聲診斷NAFLD分級標準,進一步將NAFLD組分為輕度脂肪肝(137例)、中度脂肪肝(94例)和重度脂肪肝(41例)3個亞組。
1.2.2基本資料收集
采用現場一對一問卷調查和體格測量,收集所有研究對象的年齡、既往病史、用藥史、近3個月飲酒史、生活習慣、身高、體重、血壓[收縮壓(SBP)、舒張壓(DBP)]及腰圍(WC)等基本資料。
1.2.3臨床實驗室指標檢測
通過醫院電子數據系統獲取研究對象的臨床實驗室指標檢測結果,包括空腹血糖(FPG),血尿酸(SUA),血脂參數[總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)]及肝功能指標[丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、ALT/AST、谷氨酰轉肽酶(GGT)、直接膽紅素(DBIL)]。
1.2.4計算公式
基于上述相關指標,分別計算體重指數(body mass index,BMI)、腰圍身高比(waist-height ratio,WHtR)和CMI。計算公式:(1)BMI=體重(kg)/身高(m)2;(2)WHtR=WC(m)/身高(m);(3)CMI=TG(mmol/L)/HDL-C(mmol/L)×WHtR。
1.3 統計學處理
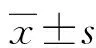
2 結 果
2.1 不同性別人群NAFLD組與非NAFLD組基線特征比較
本研究共納入536例體檢者,以性別進行分層,其中,男性264例(49.25%),女性272例(50.75%)。在男性人群中,NAFLD組與非NAFLD組的年齡、SBP、DBP、FPG比較,差異無統計學意義(P>0.05);NAFLD組的BMI、WC、WHtR、TC、TG、LDL-C、CMI、SUA、ALT、AST、ALT/AST、GGT均明顯高于非NAFLD組(P<0.05),經常運動者占比、HDL-C和DBIL則明顯低于非NAFLD組(P<0.05)。在女性NAFLD組中,除年齡、SBP、DBP、FPG高于非NAFLD組之外,其余指標兩組比較結果與男性人群相一致,見表1。

表1 男、女性NAFLD組與非NAFLD組基線特征比較
2.2 不同嚴重程度NAFLD患者CMI比較
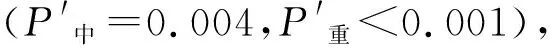
表2 男、女性不同嚴重程度NAFLD患者CMI比較[M(Q1,Q3)]
2.3 CMI與NAFLD嚴重程度的相關性
以NAFLD嚴重程度為因變量(輕度=1,中度=2,重度=3),以CMI為自變量,進行相關性分析。Spearman相關系數顯示,在男性和女性NAFLD患者中,NAFLD嚴重程度(輕、中、重度)與CMI均呈正相關(r=0.222,P=0.004;r=0.445,P<0.001),其中,CMI與女性NAFLD嚴重程度相關性更高,見圖1。

A:男性;B:女性。圖1 CMI水平與NAFLD嚴重程度的相關性
2.4 CMI與NAFLD嚴重程度的多元logistic回歸分析
將單因素分析中差異有統計學意義的自變量均納入多元logistic回歸分析,結果顯示CMI與NAFLD嚴重程度無明顯相關性。隨后將自變量進行逐一篩選,以NAFLD嚴重程度為因變量(無=0,輕度=1,中-重度=2),以經常運動(否=0,是=1)、年齡(僅女性)、BMI、WHtR、TC、HDL-C、ALT、AST、GGT、DBIL、CMI為自變量,進行多元logistic回歸分析。結果顯示,在校正經常運動、BMI的條件下,男、女性輕度NAFLD和中-重度NAFLD與CMI均具有相關性,其中女性輕度NAFLD組和中-重度NAFLD組CMI的OR值均高于男性,分別為5.320(95%CI:1.794~15.777)和24.452(95%CI:7.323~81.641);進一步調整WHtR、TC、HDL-C、ALT、AST、GGT、DBIL、年齡(僅女性)后,CMI與男、女性輕度NAFLD和中-重度NAFLD仍獨立相關,其中女性輕度NAFLD組和中-重度NAFLD組CMI的OR值依然高于男性,分別為3.880(95%CI:1.282~11.740)和15.078(95%CI:4.390~51.785),見表3。

表3 CMI影響NAFLD嚴重程度的logistic回歸分析
2.5 CMI對NAFLD嚴重程度的預測價值
繪制男、女性受試者CMI預測輕度和中-重度NAFLD的ROC曲線,見圖2。CMI預測男、女性輕度NAFLD的AUC分別為0.755(95%CI:0.685~0.817)和0.806(95%CI:0.749~0.856),CMI預測男、女性中-重度NAFLD的ACU分別為0.836(95%CI:0.775~0.886)和0.912(95%CI:0.865~0.947),見表4。
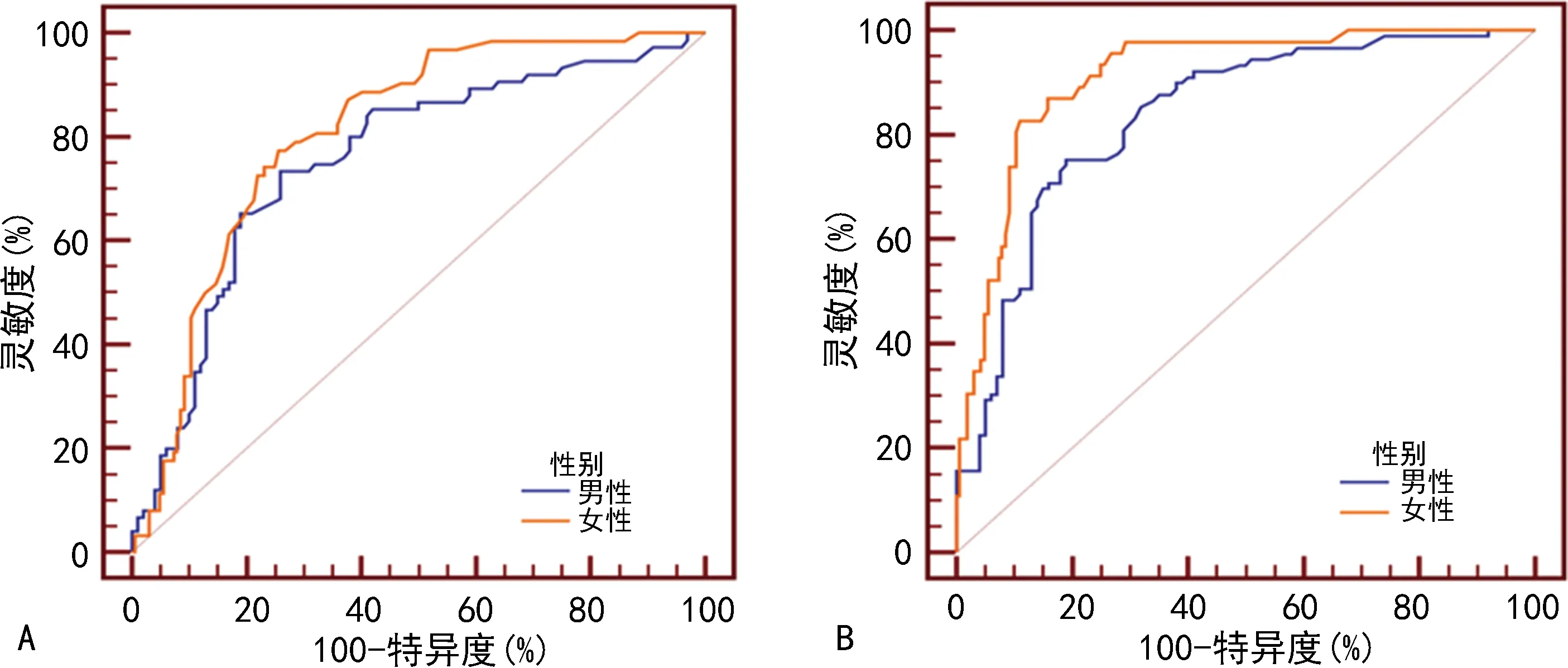
A:輕度NAFLD組;B:中-重度NAFLD組。圖2 CMI水平預測NAFLD嚴重程度的ROC曲線

表4 CMI預測NAFLD嚴重程度的ROC曲線
3 討 論
目前,在我國NAFLD占慢性肝臟疾病病因的50%,位居首位,已成為肝病和代謝領域的新挑戰[2,8]。由于NAFLD起病隱匿,多數NAFLD患者在疾病初期并無明顯癥狀,同時目前尚無標準治療藥物及有效治療手段,早期篩查NAFLD人群、盡早開展一級預防尤為關鍵。現階段,腹部B型超聲檢查仍是臨床上用于早期篩查NAFLD的首選方法,但其僅對中、重度脂肪肝具有較高靈敏度,容易遺漏輕度脂肪肝患者,且對于腹型肥胖者準確性較為有限[10-11];肝穿刺活組織檢查作為診斷NAFLD的“金標準”,是一種有創且費用昂貴的方法,存在一定的感染率和死亡率等局限性,臨床應用普適性較弱[12]。因此,發掘簡單易行且可靠的無創性檢測指標,對于輔助篩查NAFLD人群具有十分重要的意義。
NAFLD作為代謝應激性肝臟損傷,與胰島素抵抗(insulin resistance,IR)和遺傳易感密切相關,通常被認為是MetS(包括肥胖、脂質代謝異常、高血壓等)在肝臟的表現[8,13]。CMI是WAKABAYASHI等[14]于2015年提出的一種新型指數,其綜合了血脂(TG/HDL-C)和人體肥胖相關參數(WHtR)兩類定量指標,以上指標測量方便且計算簡單,在臨床上易于獲得。本研究結果顯示,CMI在男性、女性NAFLD患者中均呈現出較高水平,且人群CMI值隨著NAFLD嚴重程度的加重而增加;進一步校正相關混雜因素后,CMI仍是NAFLD嚴重程度的獨立影響因素,說明CMI與NAFLD嚴重程度密切相關。在NAFLD的預防與健康管理中,血脂代謝和腹部脂肪聚集依然是不可忽視的主要因素,應著重監測TG、HDL-C及WHtR值的變化。諸多研究證實,NAFLD發病的核心環節為IR,TG/HDL-C、腹型肥胖均與IR密切相關,當機體長期處于IR狀態時,肝臟中TG大量分泌,HDL-C呈低水平狀態,與此同時,肝臟內TG水平升高又會加重IR,IR與TG水平升高之間存在雙向聯系,最終形成惡性循環,不斷地推動NAFLD的深入發展;另外,內臟脂肪細胞會促進慢性炎癥的發生,慢性炎癥又可以通過影響周圍細胞的信號轉導途徑導致IR的發生[6,15-16]。
本研究ROC曲線分析結果顯示,CMI對于不同性別人群NAFLD嚴重程度均具有良好的預測價值,可以作為輔助NAFLD早期篩查的有效指標,與既往研究結果基本一致[17-18]。此外,值得注意的是,在本研究中,CMI預測女性輕度和中-重度NAFLD的AUC值[0.806(95%CI:0.749~0.856)和0.912(95%CI:0.865~0.947)]皆高于男性[0.755(95%CI:0.685~0.817)和0.836(95%CI:0.775~0.886)],說明CMI對于女性人群NAFLD具有更高的篩查價值。分析可能與男、女性在人體脂肪分布方面存在差異有關,男性發生超重和肥胖的年齡相對于女性更早,其體脂含量從20歲開始逐漸增加,至50歲到達頂峰后逐漸下降;而女性處于20~30歲時,機體各部位脂肪蓄積速度加快,尤其是軀干部位脂肪,30歲以后腹部脂肪蓄積程度較男性更為明顯,腹部肥胖最高發年齡段在50~59歲,該時期女性由于雌激素水平直線下降,表現出更高的中央脂肪積累[7,19-21]。
本研究以性別分層,在探究NAFLD不同嚴重程度3個亞組間CMI差異的基礎上,進一步分析了二者之間的相關性,同時對CMI預測不同嚴重程度NAFLD的效能進行了綜合評價,以期為NAFLD疾病篩查與防治提供新思路。然而,本研究亦存在一定的局限性:(1)研究對象來源單一且樣本量較小,結果的適用范圍受限,未來仍需擴大樣本量,通過多中心的前瞻性研究,進一步驗證二者之間的關系;(2)本研究未納入遺傳和飲食因素等相關混雜因素,可能會對研究結果有一定影響;(3)本研究以B型超聲診斷NAFLD并非肝臟穿刺活檢,檢測結果與“金標準”存在一定偏倚。
綜上所述,在體檢人群中,CMI與NAFLD嚴重程度之間呈正相關,是影響脂肪肝嚴重程度的獨立因素,可以作為預測脂肪肝嚴重程度的無創性指標,且對于女性人群具有更高的預測價值。本研究結果提示,定期觀察和監測CMI有助于識別及篩查高危人群,有效控制NAFLD的發生,對于女性群體,尤其是絕經后的女性,應注意身體腹部肥胖,加強日常體育運動及減少能量攝入。

