血清Lp-PLA2和ANGPTL8水平對冠心病及冠狀動脈病變程度的診斷價值研究*
宋思育,何廉旗,胡慶薇,賈晶晶,宋占春△
(1.錦州醫科大學撫順市中心醫院研究生培養基地,遼寧撫順 113006;2.遼寧省撫順市中心醫院心內科 113006)
冠狀動脈粥樣硬化性心臟病簡稱冠心病(coronary heart disease,CHD),其發病率、致死率高,是造成我國居民疾病負擔和死亡的首要病因[1]。目前,我國心血管病死亡患者占城鄉居民總死亡患者比例的首位,其中農村為46.66%,城市為43.81%[2]。CHD發生主要是冠狀動脈內膜下形成粥樣硬化斑塊,致使管腔狹窄或阻塞,最終導致心肌損傷或壞死。粥樣硬化斑塊從形成、發展到破裂,均與炎癥反應相關,多種血管特異性的炎癥細胞因子參與其中。近年來,多項研究表明脂蛋白相關磷脂酶A2(lipoprotein phospholipase A2,Lp-PLA2)和血管生成素樣蛋白8(angiopoietin-like protein 8,ANGPTL8)可引起血管內皮細胞功能障礙和一系列氧化應激反應,促進動脈粥樣硬化(atherosclerosis,AS)形成[3-4],最終導致CHD的發生、發展。研究發現,ANGPTL8的表達與糖脂代謝、肥胖、炎癥等均相關[5],與甘油三酯(triglyceride,TG)、總膽固醇(total cholesterol,TC)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)關系密切[6-7]。然而,關于ANGPTL8與脂代謝[8]及糖代謝[9]的關系仍有爭議。Lp-PLA2與血脂水平、AS[10-11]和糖代謝亦密切相關[12-13]。本研究探討血清Lp-PLA2和ANGPTL8水平對CHD、冠狀動脈病變程度的診斷價值,將為CHD的診療提供幫助。
1 資料與方法
1.1 一般資料
選取2021年7月至2022年4月因胸痛就診于撫順市中心醫院并行冠狀動脈造影(coronary angiography,CAG)檢查的患者共113例,平均年齡為(61.42±9.15)歲,男54例,女59例。CHD的診斷標準符合穩定性CHD診斷與治療指南[14]。排除標準:(1)年齡>80歲;(2)既往有心肌梗死、嚴重心臟瓣膜病、心力衰竭、經皮冠狀動脈介入或冠狀動脈搭橋術史;(3)存在嚴重臟器功能衰竭;(4) 存在嚴重感染性疾病、免疫系統疾病、惡性腫瘤;(5)存在甲狀腺功能異常;(6)入院前6個月內服用降脂藥物;(7)存在糖尿病。本研究通過撫順市中心醫院倫理委員會批準(XS2021017),所有受試者均簽署知情同意書。根據CAG結果,將受試者分為CHD組(至少1支冠狀動脈管腔狹窄≥50%)和對照組(每支冠狀動脈管腔狹窄均<50%)。對CHD組行亞組分析,將CHD組分為一支病變組(n=27)、兩支病變組(n=18)和三支病變組(n=32)。
1.2 方法
收集所有受試者資料,如性別、年齡、吸煙史、體重指數(body mass index,BMI)、收縮壓(systolic blood pressure,SBP)、舒張壓(diastolic blood pressure,DBP)、丙氨酸氨基轉移酶(aspertate aminotransferase,AST)、天門冬氨酸氨基轉移酶(alanine aminotransferase,ALT)、肌酐、尿酸、C反應蛋白(C-reactive protein,CRP)、纖維蛋白原(fibrinogen,FIB)、空腹血糖(fasting blood-glucose,FBG)、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)、TC、TG、載脂蛋白B(apolipoprotein B,apoB)、載脂蛋白A1(apolipoprotein A1,apoA1)等。
入院第2天,所有受試者采集空腹靜脈血并送至檢驗科,行常規生化指標的檢測。同時,另取肘靜脈血5 mL于乙二胺四乙酸(EDTA)抗凝管中,以3 000 r/min離心10 min,取上層血清置于EP管中,于-80 ℃保存。分別采用干式免疫熒光定量法和酶聯免疫吸附法檢測血清Lp-PLA2和ANGPTL8水平,具體操作嚴格按照試劑盒說明書進行。Lp-PLA2檢測試劑盒購于中國上海凱璟生物科技公司(貨號CG01C05S-50),ANGPTL8檢測試劑盒購于中國武漢優爾生科技公司(貨號SEW803Hu)。采用2019年Gensini評分方法,由2名經驗豐富的心內科介入醫師,根據Seldinger法建立橈動脈通路,以目測法判定冠狀動脈狹窄部位、程度及側支循環情況,對冠狀動脈病變程度進行評價[15]。
1.3 統計學處理

2 結 果
2.1 CHD組和對照組臨床資料和血清Lp-PLA2、ANGPTL8水平比較
各組患者在性別、肝功能、腎功能等方面比較,差異無統計學意義(P>0.05)。CHD組吸煙率、血清TC、TG、LDL-C、apoB、Lp-PLA2和ANGPTL8水平明顯高于對照組,apoA1水平明顯低于對照組,差異均有統計學意義(P<0.05),見表1。
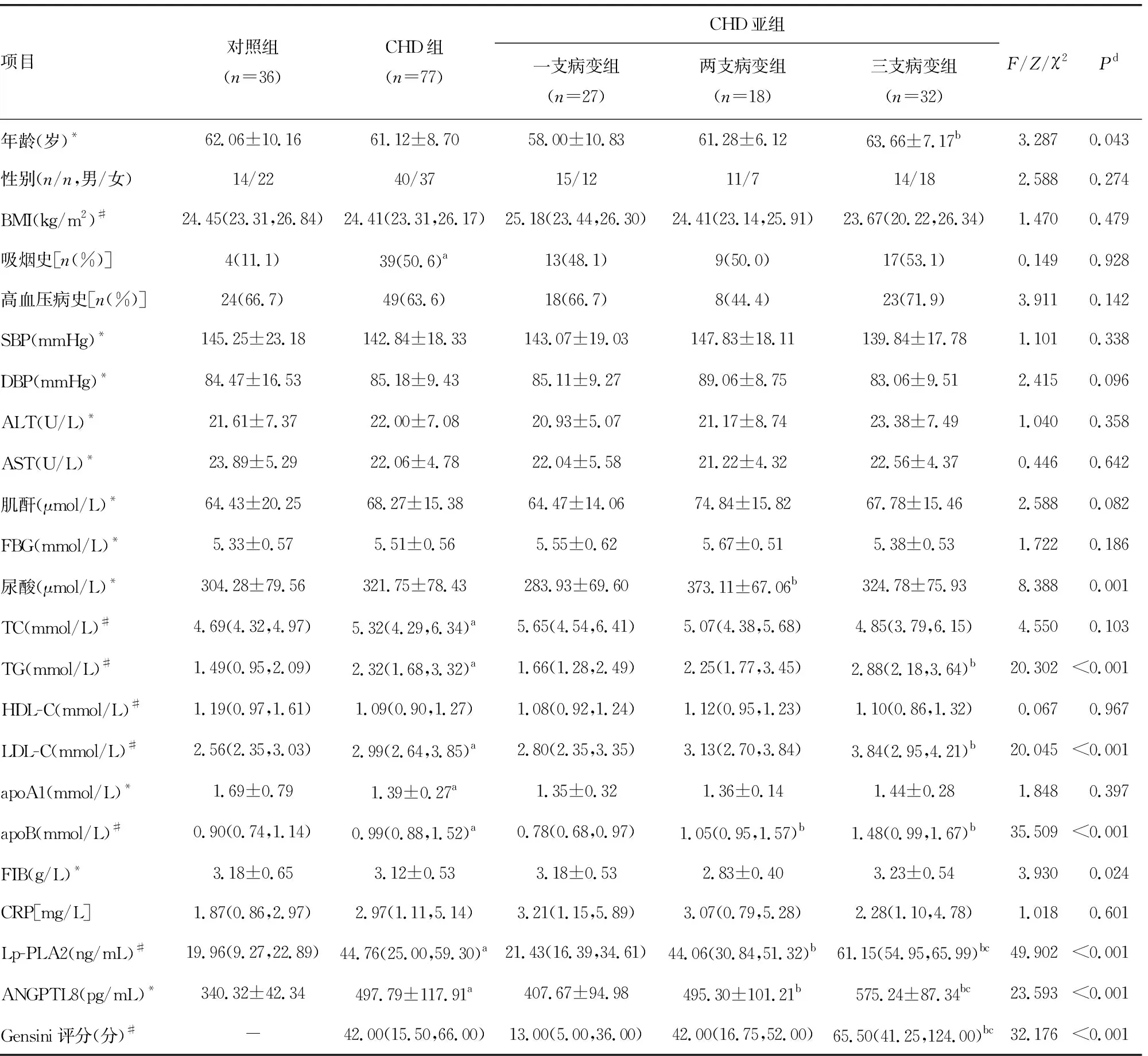
表1 各組患者臨床資料和血清Lp-PLA2、ANGPTL8水平比較
2.2 不同CHD亞組臨床資料和血清Lp-PLA2、ANGPTL8水平比較
3個亞組患者在年齡、尿酸、TG、LDL-C、apoB、Gensini評分、Lp-PLA2和ANGPTL8水平方面比較,差異均有統計學意義(P<0.05)。經過兩兩比較,血清Lp-PLA2和ANGPTL8在各組間差異均有統計學意義(P<0.05),即三支和兩支病變組血清Lp-PLA2和ANGPTL8水平均明顯高于一支病變組,且三支病變組的這兩項指標明顯高于兩支病變組,見表1。
2.3 多因素logistic回歸分析影響CHD的因素
以是否有CHD為因變量,以年齡、BMI、吸煙史、高血壓病史、ALT、AST、肌酐、尿酸、FIB、CRP、FBG、LDL-C、TG、HDL-C、TC、apoB、apoA1為自變量,應用向后條件法,進行多因素logistic回歸模型分析。結果顯示,血清Lp-PLA2、ANGPTL8、LDL-C和TG是CHD發生的影響因素(P<0.05),見表2。

表2 多因素logistic回歸分析影響CHD的因素
2.4 CHD患者以Gensini評分為因變量的多元線性回歸結果
以Gensini評分為因變量,以病變支數亞組中差異有統計學意義的指標為自變量,行逐步多元線性回歸分析。結果顯示,TG、Lp-PLA2和ANGPTL8是冠狀動脈病變嚴重程度的相關因子(P<0.05),見表3。

表3 CHD患者以Gensini評分為因變量的多元線性回歸結果
2.5 血清Lp-PLA2、ANGPTL8和LDL-C單獨和聯合對CHD的預測價值
血清ANGPTL8和Lp-PLA2單獨預測CHD的價值優于LDL-C,其AUC分別為0.871(95%CI:0.795~0.927)、0.869(95%CI:0.793~0.925)、0.742(95%CI:0.651~0.819)。ANGPTL8和Lp-PLA2兩者聯合預測CHD的AUC為0.904(95%CI:0.834~0.951)。三者聯合的AUC為0.939(95%CI:0.878~0.975),優于單獨預測價值,見圖1。

圖1 血清Lp-PLA2、ANGPTL8和LDL-C單獨和聯合預測CHD的ROC曲線
3 討 論
CHD在我國的發病率高、致死率高、治療費用高,嚴重危害人們的生命健康。在多種炎癥細胞和炎癥因子的參與下,血管壁內膜產生粥樣硬化斑塊,最終導致心肌缺血或壞死[16-17]。由于炎癥反應參與CHD發生、發展的每個階段,所以早期完善相關炎癥細胞因子檢測,可評估CHD的發生風險和預測冠狀動脈病變的嚴重程度,從而可能為CHD的診療提供幫助[18]。
Lp-PLA2是血小板活性因子乙酰水解酶,屬于磷脂酶超家族中的一個亞型。無論是穩定性斑塊還是不穩定性斑塊,其中的巨噬細胞和淋巴細胞均可產生Lp-PLA2。Lp-PLA2可進入循環系統,以與脂蛋白結合的形式存在,其中約70%通過apoB100與LDL-C結合,另約30%通過apoA1與HDL-C結合,極少部分與極低密度脂蛋白結合[19]。Lp-PLA2可激活機體氧化反應,加快內皮細胞結構和功能破壞,促進炎癥細胞浸潤和AS形成[4]。
ANGPTL8被稱為“促代謝因子”,是主要表達于肝臟和脂肪組織的一種分泌型蛋白。ANGPTL8與促進能量儲存的過程(如調節餐后脂質運輸、脂肪和糖原合成等)正相關,與促進能量消耗的過程負相關,同時與炎癥、癌癥,以及肥胖、甲狀腺功能減退等代謝綜合征也密切相關[5,20]。研究人員認為,ANGPTL8通過抑制脂蛋白脂肪酶(lipoprotein lipase,LPL)活性調節TG[6,18,21]。一項meta分析發現,LPL編碼區的常見和罕見破壞性突變均與TG水平獨立相關[22]。ANGPTL8蛋白截斷變體(protein-truncating variant,PTV)攜帶者的TC、TG、LDL-C和更高的HDL-C水平總體上均有所改善,其發生2型糖尿病和CHD的風險均低于非攜帶者[7]。研究發現,ANGPTL8通過激活ERK通路,促進大鼠主動脈血管平滑肌細胞表型轉化和增殖遷移,為促進AS提供了新的證據[23]。JIAO等[24]發現,ANGPTL8在人和小鼠AS病變中的表達增加,過度表達會促進AS發展,而敲除ANGPTL8基因可預防AS。也有研究發現,ANGPTL8通過激活PI3K/AKT/mTOR通路參與癌癥進展[20],通過負反饋調節核因子-κB(NF-κB)通路控制炎癥和自身免疫反應[25]。
本研究發現,CHD組患者血清Lp-PLA2和ANGPTL8水平明顯高于對照組,且兩項指標隨著冠狀動脈病變支數和Gensini評分的增加而逐漸增高,提示Lp-PLA2和ANGPTL8可能與CHD及冠狀動脈病變程度相關。一項meta分析發現,較高的Lp-PLA2活性與長期心血管事件的風險增加獨立相關,可將其用于對CHD高危患者進行危險分層[26]。FADAEI等[27]發現,CHD患者血清ANGPTL8水平也明顯增高,其升高與TG和細胞間黏附分子-1獨立相關。有研究報道,血脂參數可以解釋部分心血管發病風險,在降低了LDL-C等血脂參數后,仍存在心血管殘余風險[28],提示血脂參數在預測CHD發生方面可能存在不足。本研究結果顯示,Lp-PLA2和ANGPTL8升高的患者發生CHD的風險較高,兩者聯合可作為CHD診斷的輔助手段。
本研究采用2019年最新Gensini評分方法,此方法考慮了冠狀動脈狹窄程度、狹窄部位及側支循環這3個方面,同時對冠狀動脈左、右優勢型采取不同的積分策略。此外,本研究排除了接受降脂治療和糖尿病患者。降脂藥物不僅降低了血脂水平,也可能干擾了糖脂之間的代謝,從而干擾Lp-PLA2和ANGPTL8的表達。排除這部分患者,可以較好地反映血脂、Lp-PLA2和ANGPTL8的自然表達水平,探究其與CHD和冠狀動脈病變程度的關系。本研究為單中心研究,樣本量較少,且未能明確Lp-PLA2、ANGPTL8與CHD和冠狀動脈病變程度的因果關系,未來可通過多中心、大樣本量研究進一步在分子機制上探討兩者與CHD的關系。同時,可以隨訪CHD患者血清Lp-PLA2、ANGPTL8水平和長期心血管不良事件,探討兩者與CHD預后的相關性。
綜上所述,CHD患者血清Lp-PLA2和ANGPTL8水平較非CHD者明顯增高,聯合檢測可以作為CHD診斷的輔助手段。

