安羅替尼在晚期肺癌后線治療的療效與安全性分析
張金華,楊力寶,黃 琳,張河衍
(三明市第二醫院,福建 三明 366000)
肺癌是世界上最常見的惡性腫瘤,死亡率最高,非小細胞肺癌約占肺癌的85%,患者確診時多為中晚期,治療方案選擇較少,驅動基因陰性者多選擇化學藥物治療延長患者生存期[1]。目前臨床上,大多數患者可從放療聯合化療中受益,但也給患者帶來較多的不適,并發癥發生率較高,患者依從性低[2]。在后線治療上,藥物的選擇更為重要。安羅替尼是一種新型的口服多靶點抗血管生成酪氨酸激酶抑制劑,在中國已被批準用于晚期非小細胞肺癌的三線和小細胞肺癌的三線治療。ALTER-0303的試驗研究發現,安羅替尼比安慰劑在三線/后線治療非小細胞肺癌晚期患者更有效,與安慰劑組相比,安羅替尼組患者的ORR和DCR得到顯著改善。基于此,回顧性分析我院晚期肺癌患者后線治療使用安羅替尼的療效及安全性,獲得結果如下。
1 資料與方法
1.1 一般資料
納入標準[3]:(1)經病理學確診,影像學證實為晚期肺癌;(2)病例完整;(3)經診斷為原發腫瘤;(4)接受過規范一線、二線抗腫瘤治療;(5)年齡>18歲;(6)重要臟器功能基本正常,血常規以及肝腎功能基本正常,無治療禁忌證。排除標準[4]:(1)既往安羅替尼治療;(2)基線影像信息不全;(3)同時有其他類型腫瘤者。
回顧性分析我院2020年02月—2023年01月收治以晚期肺癌(非小細胞肺癌)并以規范一線二線抗腫瘤治療后進展的患者總計111例,采用常規治療的51例設置為非安羅替尼組,男37例,女14例,年齡30~83歲,平均(63.86±3.25)歲,病程2.0~7.0個月,平均(4.77±0.82)個月。另以安羅替尼治療的60例患者為安羅替尼組,男47例,女13例,年齡45~78歲,平均(62.73±3.41)歲,病程1.0~8.0個月,平均(4.86±0.77)個月。一般資料均衡可比(P>0.05)。
1.2 方法
安羅替尼組:鹽酸安羅替尼膠囊(正大天晴藥業集團,國藥準字H20160318, 12mg/粒),早餐前12mg,空腹口服。服藥2周停1周,兩組均治療4周。可耐受不良反應者繼續用藥;不能耐受者根據不良反應程度進行調整,第一次用藥劑量減至10mg/d,仍無法耐受者繼續減少用量為8mg/d,仍無法耐受不良反應者,考慮停止用藥。非安羅替尼組:予多西他賽(100mg/m2,21天為一周期,連續治療4期)治療。
1.3 評價標準
比較兩組患者治療前、后的腫瘤標志物水平,評價治療2周期后療效,統計患者不良反應的發生情況。腫瘤標志物水平以糖類抗原19-9 (CA19-9)、癌胚抗原(CEA)、糖類抗原125(CA125)、神經元特異性烯醇化酶(NSE)。治療2周期后,根據RECIST 1.1進行療效評價,分為完全緩解(complete response,CR)、部分緩解(partial response,PR)、疾病穩定(stable disease,SD)和疾病進展(progressive disease,PD)。客觀緩解率(objectiveresponse rate,ORR)=(CR+PR),疾病控制率(disease control rate,DCR)=(CR+PR+SD)[6-7]。
由表8可見,山羊發酵乳中含有抗氧化活性肽,且具有較強的抗氧化能力;經模擬胃液和腸液消化試驗后,抗氧化活性較消化前有所下降,但下降幅度較小,消化后抗氧化活性依然存在,可見混合發酵菌株產生的活性肽經胃胰蛋白酶水解后,生成的產物仍具有一定的抗氧化活性。
1.4 統計學方法
兩組患者治療前腫瘤標志物水平無統計學差異(P>0.05)。治療后腫瘤標志物水平較治療前下降,安羅替尼組較非安羅替尼組更低,治療前、后兩組組內及治療后組間比較,差異有統計學意義(P<0.05)。詳見表1。
2 結果
2.1 治療前、后的腫瘤標志物水平
該公司炭黑5號生產線尾氣前饋串級控制方案投運前,自2018年8月27日0時開始,12 h內的炭黑溫度數據記錄見表1所例。
表1 兩組患者治療前、后的腫瘤標志物水平比較
2.2 治療2周期后療效
治療2周期后安羅替尼組客觀緩解率、疾病控制率均高于非安羅替尼組(P<0.05)。詳見表2。
礦區位于NE向的區域布格重力異常上(圖2),一六鎢礦、梅子沖銀鉛鋅礦、赤佬頂銻礦等礦床和寶山巖體、高山巖體均分布在該北東向的重力異常帶上,說明上述礦床區域成礦構造相同,推測其深部有隱伏巖體存在。赤佬頂地帶布格重力值(-60×10-5 m/s2以上)較已出露的寶山和高山巖體(-64×10-5 m/s2左右)高約4×10-5 m/s2,是該區沉積巖地層增厚、隱伏巖體埋深變大所致。根據其東北測約4km地段于梅子沖銀鉛鋅礦區所施測的5線綜合物探剖面反映隱伏巖體埋深在-300m標高以下,依據寶山巖體的側伏方向,推測赤佬頂銻礦區隱伏巖體埋深在-600m標高以下。
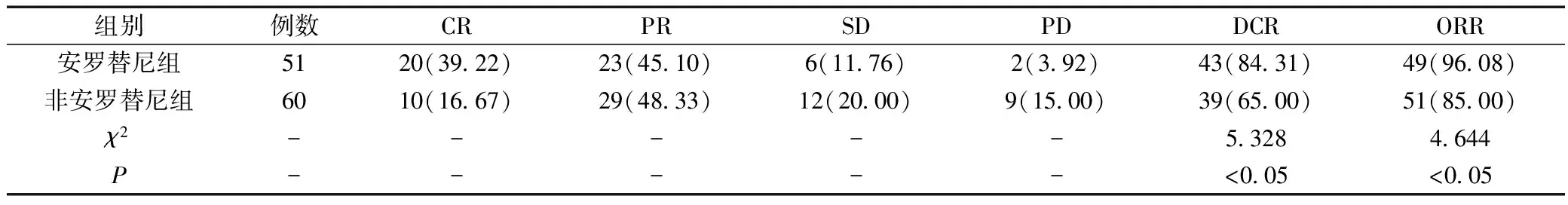
表2 兩組患者在治療2周期后療效對照(n,%)
2.3 不良反應的發生情況
安羅替尼組患者不良反應的發生率低于非安羅替尼組(P<0.05)。詳見表3。

表3 兩組患者不良反應的發生情況比較(n,%)
3 討論
肺癌癥狀不典型,姑息性化療為晚期標準療法,隨著精準化和個體化治療模式的發展,明確其基因變異情況,予以靶向治療為改善預后的最佳治療手段[8]。驅動基因檢測可以發現突變靶點,選擇相應靶向藥物治療,而驅動基因陰性或無敏感基因突變患者無法從靶向治療中獲益。盡管靶向治療可延長患者生存期,但終究會耐藥或病情進展[9-10]。血管生成是原有血管生成新毛細血管的繁雜性多程序性過程。新生血管一方面可以為腫瘤輸送大量氧氣、供應充沛養分、協助運走因代謝產生廢料,另一方面還可以產生多種因子介導腫瘤的生長、浸潤和轉移等過程[11-12]。血管生成需要“促血管生成”、“抗血管生成”雙重管控,動態平衡,一旦這種內穩態被破壞,“血管生成開關”將變得活躍,并啟動血管生成程序[13]。血管內皮生長因子(VEGF)家族促血管生成作用最強,具有多種亞型,可以與其配體VEGFR具有較高親和力,二者緊密結合啟動了血管內皮細胞內增殖活化、分化遷移等特定內皮反應的多條信號通路,最終建立新的血管。而抗血管生成藥物通過誘導已發生退化血管短暫性的恢復“血管正常化”,即血管形態和功能正常。短暫“正常化”的血管能增加腫瘤血管灌注和氧合,增強抗癌藥物的釋放和療效,減弱癌細胞的侵襲性擴散[14]。安羅替尼是國內新款研制的小分子VEGFR-TKI,能有效介導VEGFR、PDGFR、FGFR-a/β、c-kit等多條信號通路,實現遏制腫瘤血管生成的同時,還兼備抑制腫瘤增殖的作用。臨床前研究表明[15],同水平下對 VEGF、PDGF-BB和 FGF-2 誘導微血管形成的抑制率,安羅替尼要高于舒尼替尼、索拉非尼和尼達尼布,這表明無論是體內或是離體,安羅替尼都能夠對該三個靶點介導的血管生成具有顯著的抑制性。從機制上講,這可能與安羅替尼能廣泛阻斷 3 種主要的酪氨酸激酶(VEGFR-2、PDGFR-β和 FGFR-1)的磷酸化及下游的 ERK 信號轉導相關。此外,與 c-Kit 結合的同時,安羅替尼還能抑制 c-Kit 介導的多條下游信號通路,造成腫瘤細胞的多種生物學行為進程受擾,以達成實現遏制腫瘤生長的目標。本研究中,治療前兩組患者腫瘤標志物水平無統計學差異(P>0.05)。治療后腫瘤標志物水平較治療前下降,安羅替尼組較非安羅替尼組相比更低(P<0.05)。在治療2周期后安羅替尼組客觀緩解率、疾病控制率均高于非安羅替尼組(P<0.05)。安羅替尼組患者不良反應發生率低于非安羅替尼組(P<0.05)。考慮安羅替尼的耐受性較好,不良反應可控。在臨床治療中需密切監測藥物不良反應,及時調整藥物劑量也是治療中需要注意的問題。
綜上所述針對于在晚期肺癌規范一線二線抗腫瘤治療后進展患者中,以安羅替尼治療,可控制患者的血清腫瘤標志物水平,對于疾病的客觀緩解率與疾病控制率的提升效果理想,可減少在治療期間的不良反應發生率。

