藻藍蛋白對博來霉素肺纖維化小鼠腸道菌群的影響
臧 帆, 李文軍, 秦 松, 林 劍
藻藍蛋白對博來霉素肺纖維化小鼠腸道菌群的影響
臧 帆1, 2, 李文軍2, 3, 秦 松2, 3, 林 劍1
(1. 煙臺大學生命科學學院, 山東 煙臺 264005; 2. 中國科學院煙臺海岸帶研究所, 山東 煙臺 264003; 3. 中國科學院海洋大科學研究中心, 山東 青島 266071)
博來霉素(bleomycin, BLM)是目前用于治療頭頸癌等多種癌癥的藥物之一, 但會產生一系列副作用, 例如肺纖維化(pulmonary fibrosis, PF), 這大大降低了患者的生活質量。藻藍蛋白(phycocyanin, PC)作為一種色素蛋白對包括PF在內的多種疾病具有調節作用。研究發現, 慢性腸道疾病通常伴有肺部疾病, 患者的腸道菌群會發生紊亂。針對上述線索, 研究了PC對BLM誘導的PF小鼠腸道菌群的影響。通過尾靜脈將BLM注入小鼠體內, 以構建肺纖維化模型。然后通過16S rRNA高通量基因測序技術, 分析了PC對BLM引起的PF小鼠腸道菌群的影響。結果表明, PC降低了BLM誘導的PF程度并調節了小鼠的腸道菌群。通過尾靜脈注射BLM后, 小鼠肺部受到損傷, 腸道菌群發生紊亂。口服藻藍蛋白干預后, 小鼠的肺組織切片顯示其膠原蛋白沉積減少, 肺泡間隔和炎性細胞浸潤減少, 小鼠PF程度減輕。此時, 小鼠腸道菌群中、等有益菌的豐度增加,等有害菌的豐度降低, 腸道菌群趨于正常。推測PC可以通過增加腸道中有益細菌的數量并減少腸道中有害細菌的數量來調節尾靜脈注射BLM引起的腸道菌群失調, 從而降低小鼠的PF程度。
藻藍蛋白; 博來霉素; 肺纖維化小鼠; 腸道菌群
博來霉素(bleomycin, BLM)是從輪狀鏈霉菌中分離出的一類抗生素[1], 可以用于治療頭頸癌、鱗狀細胞癌、睪丸癌和某些淋巴瘤等癌癥[2]。但是, 使用BLM可能誘使患者發生肺炎樣癥狀以及肺纖維化(fulmonary fibrosis, PF), 甚至造成患者死亡[3]。BLM通過靜脈注射后, 迅速與血液中的二價銅離子結合并被轉運至細胞中, 引起DNA損傷[4]。這會產生一系列的毒副作用, 其中主要影響了患者的肺組織和皮膚組織。研究表明, BLM誘導的肺毒性與PF的病理過程非常相似[5], 其特征均為上皮修復異常和細胞外基質沉積紊亂。患者隨著肺功能喪失、呼吸衰竭等病癥的出現, 逐漸走向死亡[6]。目前吡非尼酮和尼達尼布等藥物已在臨床上用于PF的長期治療中, 但這些療法無法有效地阻止其進一步發展, 同時經常會引起不良副作用[7]。為了減輕患病人員的痛苦以及經濟壓力, 亟需尋找可以更好延緩甚至治療PF病程的藥物和方法。
藻藍蛋白(phycocyanin, PC)是藻類生物中的一類色素蛋白, 主要存在于藍藻、紅藻以及部分隱藻, 此外, 在極少數甲藻(如藍裸甲藻)中也發現了PC的存在[8]。學者們已經研究了PC的多種活性, 包括抗氧化性以及抗炎性等[9]。據報道, PC可以通過在早期抑制TLR2-MyD88-NF-κB信號通路來促進免疫細胞的增殖和分化, 從而在減輕肺損傷和纖維化過程中發揮作用[10]。
隨著對PF研究的深入,“腸-肺”軸的概念開始得到認可, 肺組織與腸道微生物之間存在重要串擾, 腸道菌群與肺部的免疫調節系統息息相關[11]。前期的研究表明, 當肺部受到刺激時, 腸道微生物的功能發生紊亂, 促使脂多糖(LPS)的產生[12]。LPS通過與Toll樣受體4結合進一步誘導肺部疾病[13]。PC干預可以影響腸道菌群的組成, 通過增加腸道微生物中雙歧桿菌和乳酸菌等有益細菌的相對豐度, 提高菌群的免疫力[14]。同時證明了PC干預能夠增加與短鏈脂肪酸生產相關細菌的含量, 例如費氏桿菌和拉氏梭菌, 其通過促進短鏈脂肪酸的合成, 增強了對G蛋白偶聯受體的抑制作用, 從而引起肺部的免疫調節[15]。
基于以上研究, 本研究采用尾靜脈注射BLM誘導小鼠PF, 并通過肺部病理切片染色及腸道微生物水平來評估PC對PF的影響。
1 材料與方法
1.1 倫理聲明
該研究所涉及的所有動物實驗方法均按照濱州醫學院《動物實驗保護指南》制定, 實驗方案經過了山東國際生物技術園動物保養委員會的批準。
1.2 實驗材料和動物
30只雄性ICR小鼠, 6~8周齡, 體重18~22 g, 購自濟南朋悅實驗動物繁育中心[許可證號: SCXK(魯) 20140007]。動物房嚴格控制12 h/12 h明/暗循環, 環境溫度在(23±2) ℃, 環境濕度在50%~60%, 小鼠自由飲食, 適應性培養1周。
PC從螺旋藻中提取, 購自新大澤螺旋藻有限公司(中國福清)。小鼠飼料購自濟南朋悅動物繁育中心(中國濟南)。HE和masson染色試劑盒購自solarbio (中國北京)。
1.3 實驗設計
小鼠常規飼養1周后, 根據體重按SPSS隨機分為3組: 對照組(Con組)、多次靜脈注射組(R組)、多次靜脈注射+藻藍蛋白組(RPC組), 每組10只。R組和RPC組小鼠經尾靜脈注射博來霉素10 mg/kg, 每周2次, 共8次; RPC組每天灌胃50 mg/kg藻藍蛋白; Con組小鼠通過尾靜脈注射等量0.9% NaCl 溶液, 每周2次, 共8次。
在實驗期間, 檢測小鼠的活動狀態、飲食、體重和死亡情況。
1.4 樣品采集與處理
在第一次BLM處理后的第14、28 d, 每組隨機選取5只小鼠進行處死, 取出其左肺置于4%多聚甲醛中固定48 h; 在第28 d時, 早6點將每只小鼠置于單獨的無菌籠中, 同時采用無菌凍存管收集約150 mg新鮮的糞便樣品, 并立即保存在?80 ℃中直至使用。
1.5 肺組織的病理學觀察
肺部組織進行石蠟包埋, 制成切片后分別進行HE和masson染色; 使用BX-51M熒光顯微鏡(Olympus, Japan)觀察切片。參照ashcroft評分來確定肺泡炎及肺間質纖維化的程度[16]。
1.6 腸道微生物的高通量測序
1.6.1 糞便中DNA的提取和測序
從小鼠糞便樣本中分離細菌基因組DNA, 采用TransStart Fastpfu DNA聚合酶反應體系在V3-V4可變區內使用特異性引物338F和806R進行PCR擴增(ABI GeneAmp? 9700型PCR儀)(表1)。通過2%的瓊脂糖凝膠電泳檢測PCR產物并進行回收(axygen公司)。使用DNA樣品制備試劑盒(illumina公司)構建MiSeq文庫, 并根據測序流程利用illumina MiSeq測序平臺進行測序。通過美吉生物云平臺(https:// cloud.majorbio.com)進行生物信息學分析。

表1 實驗中使用的引物序列
1.6.2 序列數據分析
對原始序列進行質量過濾, 并使用QIIME平臺的默認參數根據其條形碼將其分配給樣品, 使用usearch軟件平臺提取優化序列的非重復序列, 取出不重復的單個序列。在97%的相似性下, 對非重復序列進行OTU聚類。
通過alpha多樣性分析, 反應腸道菌群的豐富度和多樣性, 包括以下幾種統計學分析指數: sobs、chao、shannon、simpson、coverage。使用R語言PCoA統計分析和作圖軟件進行UniFrac PCoA分析, 基于所選距離矩陣進行作圖, 分析不同組之間的差異, 并通過SPSS分析LPS與腸道菌群的相關性。
進行組件顯著性差異檢驗, 根據得到的群落豐度數據, 對不同組微生物群落之間的物種進行假設檢驗。評估物種豐度差異的顯著性水平, 并獲得各組之間具有顯著性差異的物種。
2 結果與討論
2.1 一般情況及小鼠體質量變化
實驗過程中, 每周對小鼠稱重兩次。如圖1所示, Con組小鼠的平均體重呈上升趨勢, 在第22 d時, 平均體重達到最大39.44 g, 而后平均體重降低至38.76 g, 整個實驗過程中小鼠的平均體重增長了4.83 g。與Con組比較, R組和RPC組體重明顯下降(*<0.05)。R組小鼠的體重呈緩慢降低再升高的趨勢, 在給藥第15 d時, 平均體重降至最低31.37 g, 這可能是由于多次靜脈注射BLM后對小鼠的腸、胃等器官造成了影響, 而后平均體重有所上升, 增長至33 g, 整個實驗過程中, 體重降低了0.87 g。與R組相比, RPC組平均體重的變化趨勢與其相似, 但最終結束時, 小鼠平均體重降低了1.75 g, 略低于R組。
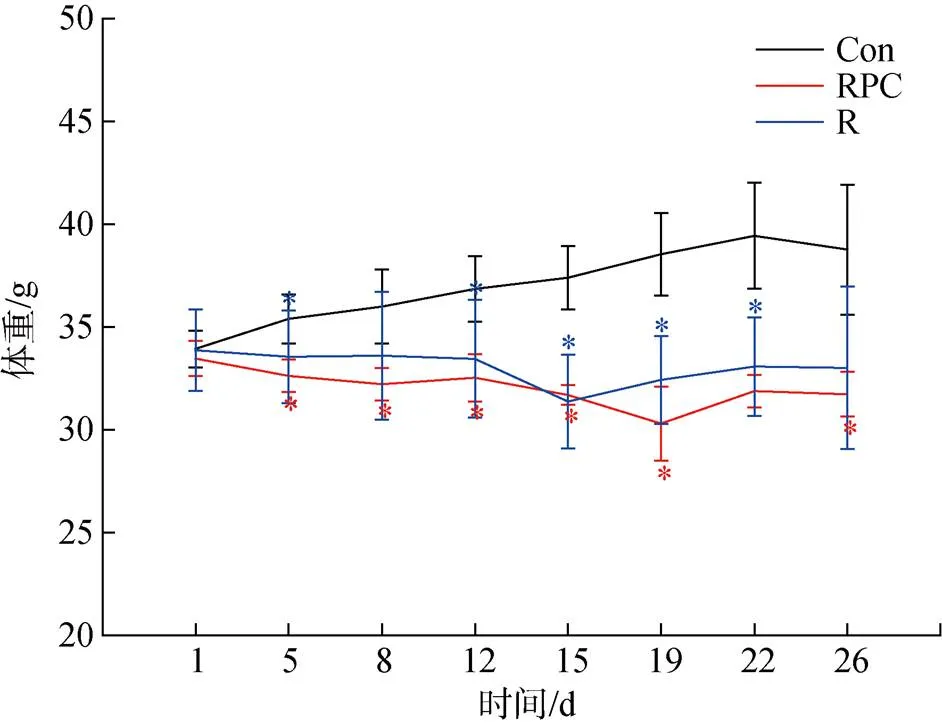
圖1 實驗開始后各組小鼠的平均體重變化
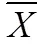
2.2 PC干預可以減輕BLM誘導的PF
為了驗證PC的抗纖維化水平, 本課題組采用尾靜脈注射BLM的方法建立PF模型。而后通過組織學分析, 包括masson染色和HE染色, 評估PC的抗纖維化作用。
HE染色和ashcroft評分[16]用于評估PF程度。如圖2a所示, PF建模第14 d, R組小鼠的肺組織有明顯的淋巴細胞和中性粒細胞浸潤(如圖2a橙色箭頭), 肺泡隔和肺泡出現炎性滲出增加, 肺泡隔增寬, 此時PC給藥組肺泡隔毛細血管擴張且肺泡巨噬細胞稍微增加。ashcroft評分顯示, 與Con組相比, R組的肺纖維化評分顯著升高(<0.05), 纖維化等級處于1和2之間; 口服PC后, RPC組小鼠肺纖維化程度減輕(<0.05)。在建模第28 d, R組小鼠肺組織的肺泡隔和肺泡中的炎性細胞浸潤有所減少, 但肺泡隔進一步增寬, 并出現大量成纖維細胞增生結節(圖2b綠色箭頭), 此時RPC組小鼠的肺泡隔寬度稍微增加。ashcroft評分顯示, 與Con組相比, R組小鼠肺纖維化評分顯著增加(<0.01), 為5±0.5, 小鼠肺部受累面積大于50%, 肺泡系統紊亂, 與R組相比, RPC組的肺纖維化評分顯著降低(<0.05), 小鼠肺部的受累面積在20%~50%(圖2c)。結果表明, 小鼠經過尾靜脈注射BLM后, 肺組織受到了嚴重破壞, 而PC給藥顯著保護了肺泡組織的結構并改善了炎癥細胞的浸潤, 肺纖維化程度降低。
圖2 PC對尾靜脈注射BLM誘導的肺組織損傷和纖維化的影響
注: Con: 對照組; R: 多次靜脈注射BLM組; RPC: 多次靜脈注射BLM加PC干預組。比例尺長度為100 μm。=5, *<0.05, **<0.01
Masson三色染色顯示, BLM靜脈注射第14 d, R組小鼠有少量膠原纖維沉積, 肺泡隔成纖維細胞局限性增生且結節增多, 同時結節內有少量膠原纖維沉積(圖2b黑色箭頭), PC給藥組的肺組織結節增多但無明顯膠原纖維沉積(圖2b)。實驗進行至第28 d, R組小鼠在肺血管外膜的外部區域觀察到藍色染色逐漸增加, 肺泡隔和結節內有大量膠原纖維沉積, 表明膠原蛋白在肺組織和周圍的分泌和沉積逐漸增加, 此時PC給藥組明顯減少了膠原纖維的沉積(圖2b)。結果表明BLM誘導導致大量膠原蛋白沉積在肺組織, 通過PC給藥可以抑制膠原沉積, 進而減輕BLM引起的PF。
2.3 PC對BLM誘導的肺纖維化小鼠腸道菌群的調節
2.3.1 多樣性分析
對15只小鼠的糞便樣品(每組5個)進行16S rRNA測序, 總共得到359 970個序列。其中包括345個操作生物分類單位(OTU), 共分為9個門和85個屬。隨著樣本數量的增加, Pan(圖3a)/Core(圖3b)曲線趨于平緩, 說明實驗的數據量足夠反映出小鼠腸道微生物組成的真實情況。
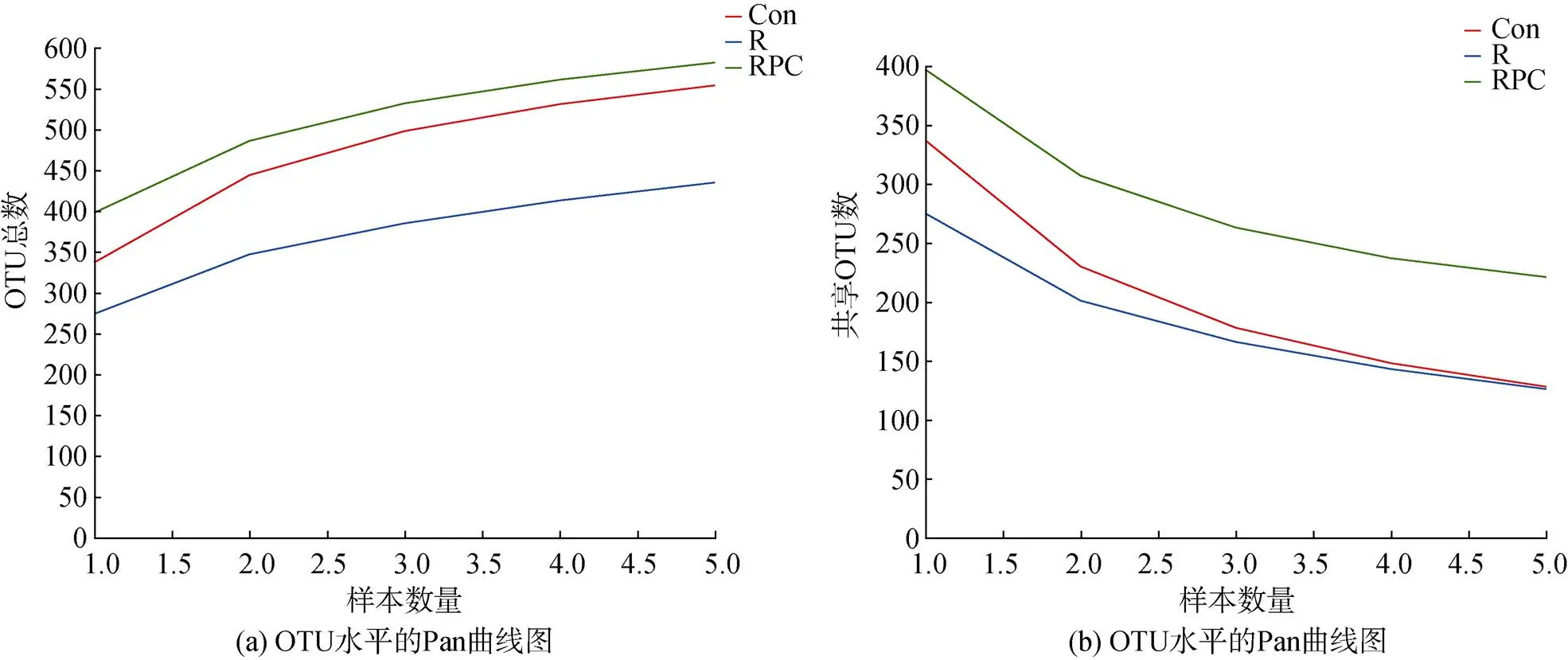
圖3 OTU水平的Pan(a)和Core(b)曲線圖
注: Con: 對照組; R: 多次靜脈注射BLM組; RPC: 多次靜脈注射BLM加PC干預組
2.3.1.1 alpha多樣性
通過alpha多樣性分析反映小鼠腸道微生物群的豐富度和多樣性。sobs指數顯示了菌群豐富度的實際觀測值。與Con組相比, BLM誘導顯著降低了菌群豐富度的實際觀測值。口服PC后, RPC組菌群豐富度的實際觀測值增加(圖4a)。chao和ace指數被用于反應群落豐富度。如圖4b和c所示, 與Con組相比, BLM誘導顯著降低了chao和ace指數, 而口服PC改善了這些指標, chao和ace指數相對于Con組和R組均顯著升高(<0.05), 進一步印證BLM靜脈注射后降低了小鼠糞便群落的豐富度, 而服用PC使糞便中的菌群豐富度增加。在群落多樣性分析中, Shannon和Simpson指數被用作反映群落的多樣性, 它們的變化趨勢成反比。相較于R組, RPC組的Shannon指數顯著增加, Simpson指數顯著降低(圖4d和e), 這表明口服PC對腸道菌群多樣性產生正面影響, 相比于其他兩組均能增加小鼠糞便中的群落多樣性(<0.05)。腸絨毛是位于腸上皮上的手指狀突起, 腸絨毛長度增加有利于營養物質的吸收。因此推測口服PC后, RPC組的腸絨毛的長度增加, 保護了腸黏膜, 從而促進食物的吸收和利用, 同時增加了到達下消化道的可微生物利用的物質的數量, 從而增加了小鼠腸道菌群的豐富度和多樣性[14]。
2.3.1.2 beta多樣性
beta多樣性分析用于比較各組樣品之間的物種多樣性差異[17]。為了評估各組小鼠細菌的差異, 本課題組進行了beta多樣性中的主坐標分析(weighted_ unifrac_full_free距離算法的PCoA分析)[18]。結果顯示Con、R和RPC組沿著主縱坐標軸形成明顯的微生物種類群集, R組小鼠糞便中的菌群類型主要聚集在對照組的右側, 而PC給藥后, 差異向Con組的左側方向發展, 口服PC后RPC組的腸道菌群向Con組左側偏移(圖4f)。由此本課題組推測, 口服PC后, PF小鼠的腸道菌群中的物種分布趨于正常, PC對PF的干預是起積極作用的。
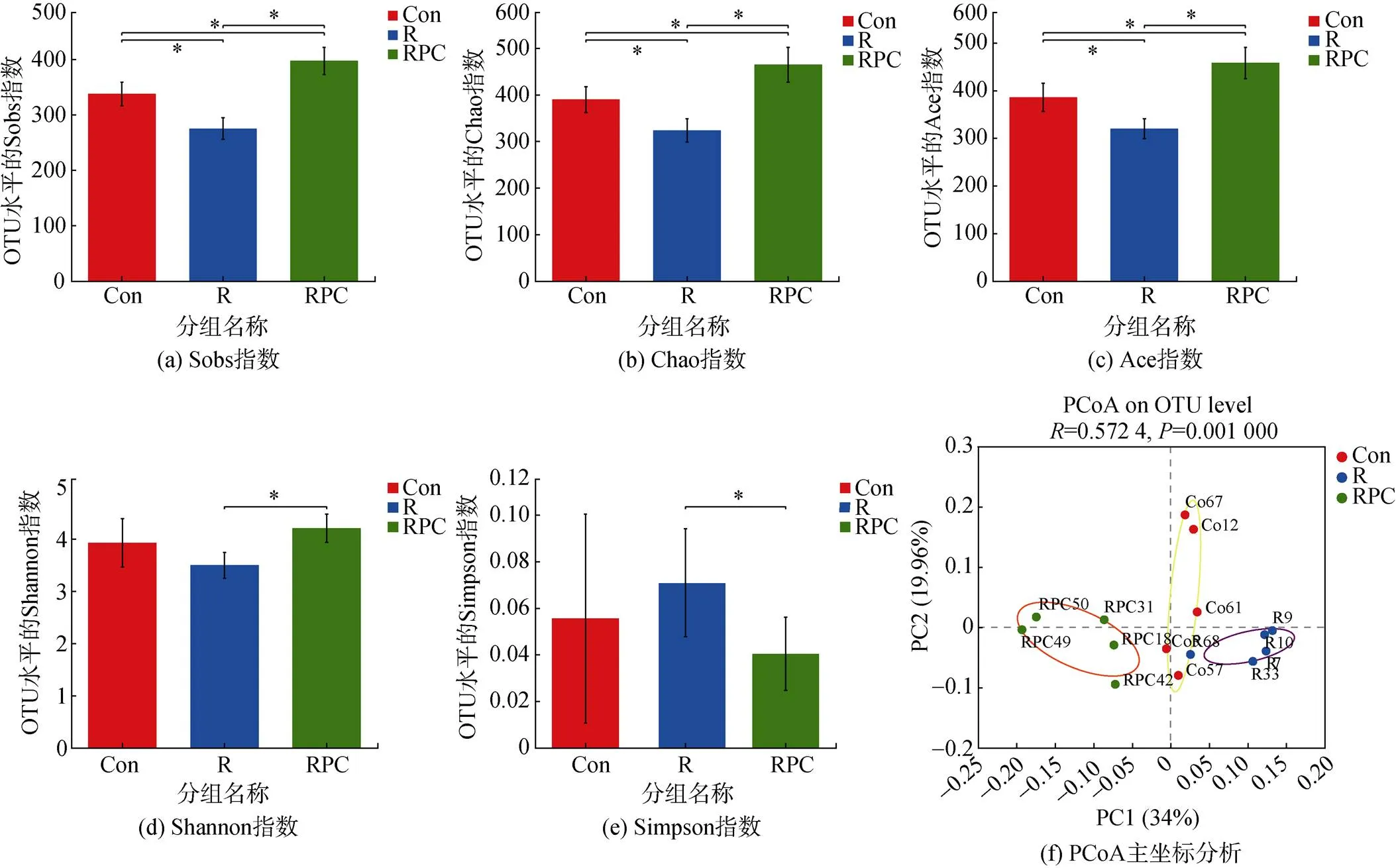
圖4 各組小鼠腸道菌群的alpha和beta多樣性指數
注: Con: 對照組; R: 多次靜脈注射BLM組; RPC: 多次靜脈注射BLM加PC干預組。*<0.05
2.3.2 PC對小鼠腸道菌群結構的影響
通過venn圖統計Con、R和RPC三組樣品中共有和獨有的物種數目, 選用相似水平為97%的OTU作為樣本表進行分類, 如圖5所示, Con組、R組和RPC組共有的OTU數為379個, 其中, Con組獨有的OTU數為35個, R組獨有的OTU數為9個, RPC組獨有的OTU數為68個。結果表明, BLM誘導后, 會降低小鼠腸道菌群的物種數, 而口服PC后小鼠腸道菌群中物種數目增加。
為了進一步研究PC對于PF小鼠的作用, 本課題組在門和屬水平上對Con、R和RPC三個組腸道菌群的組成情況進行了比較。
在門水平上, 小鼠糞便中的主要菌群組成如圖6a所示。Con、R、RPC三組小鼠的優勢菌依次是厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidota)、彎曲桿菌門(Campylobacterota), 但各菌群的相對豐度存在差異。其中Firmicutes和Bacteroidota是小鼠腸道菌群中含量最多的菌門, 占細菌總數的80%以上[19]。兩者比例的變化與宿主健康息息相關, 與正常組相比, 經BLM誘導后, Firmicutes的占比降低, Bacteroidota的占比增加; 而口服PC后, Firmicutes的占比增加, Bacteroidota的占比降低(表2)。研究認為, Bacteroi-dota門的細胞表面含有豐富的脂蛋白BtuG2, 其可以與維生素B12結合, 通過關鍵轉運蛋白-內在因子來吸收維生素B12, 因此Bacteroidota門的菌群爭奪腸道中的關鍵維生素[20]。
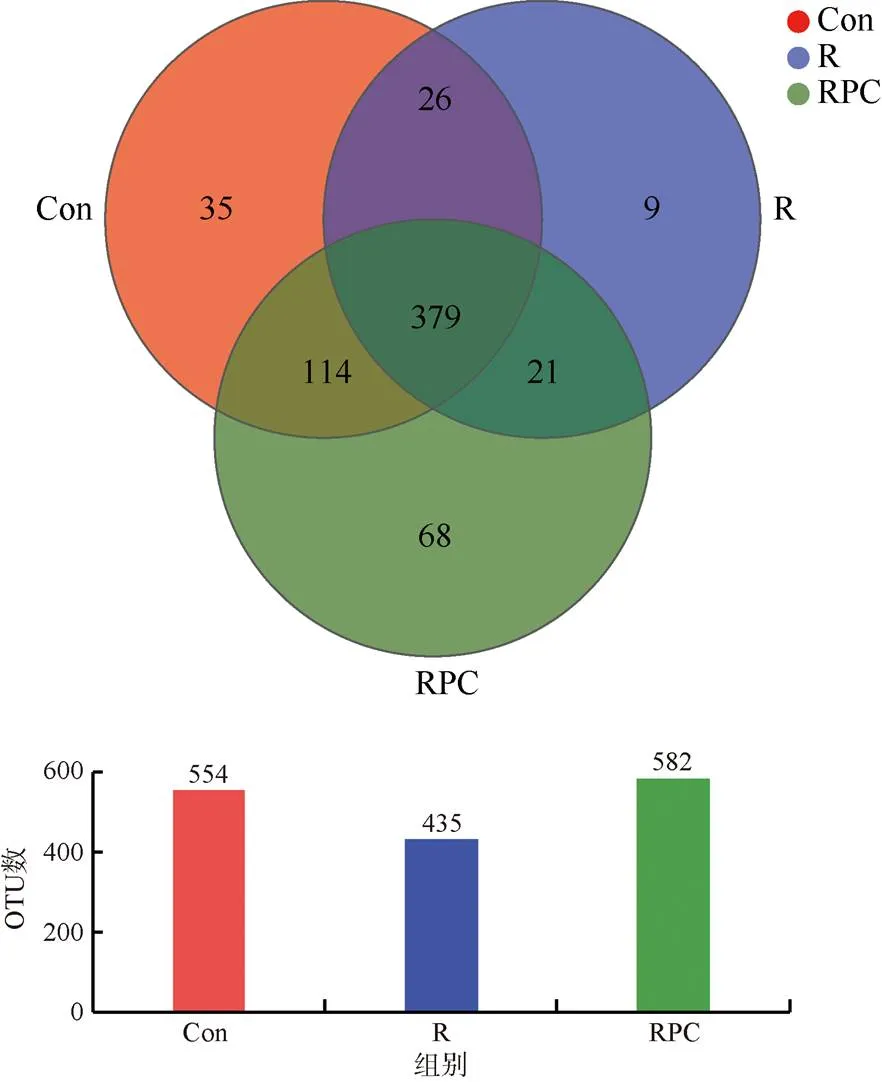
圖5 小鼠糞便腸道菌群的venn圖
注: Con: 對照組; R: 多次靜脈注射BLM組; RPC: 多次靜脈注射BLM加PC干預組
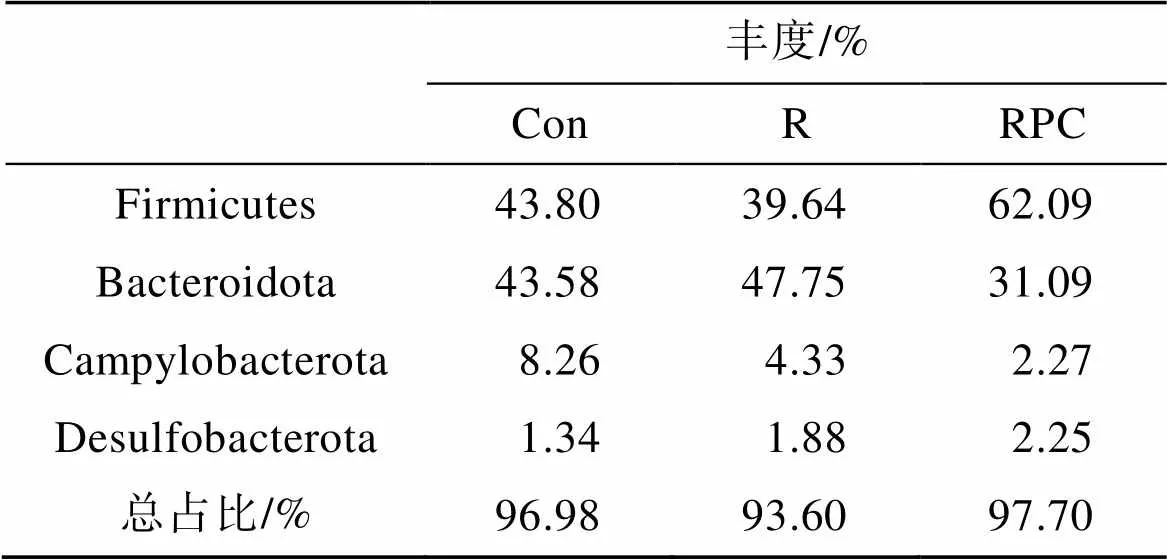
表2 三組小鼠的主要腸道菌群在門水平的相對豐度
注: Con: 正常對照組; R: 多次靜脈注射組; RPC: 多次靜脈注射+口服PC組
在屬水平, 根據豐度排名前十的細菌如表3所示, 占總菌群的70%左右。PC干預后顯著調節了幾種細菌的豐度, 如圖6b所示, 3組按照Con、R、RPC的順序, 菌群的平均占比較大的有明確命名的菌屬依次為、、、等。與對照組相比, BLM誘導組中的等細菌的豐度降低, 而口服PC后增加了這些細菌群落的豐富度。與此同時, 相比于對照組, BLM組中、等菌群的豐富度增加, 口服PC后抑制了它的上升趨勢。
為了進一步評估PC干預后優勢菌群的變化, 對從門到屬水平的物種進行LEfSe多級物種差異判別分析。如圖6c所示, 線性判別分析得分(LDA>4)的結構總共發現了15個具有統計意義的分類單元,其中R組中差異豐富的分類單元的數量是Con組的4倍, 其顯著增加了Bacilli、Lactobacillaceae等有害菌群。而口服PC后, 增加了包括Oscillospiraceae、Lachnospiraceae等有益菌的含量, 該結論與上述門和屬水平上的小鼠腸道菌群的結構相對應。
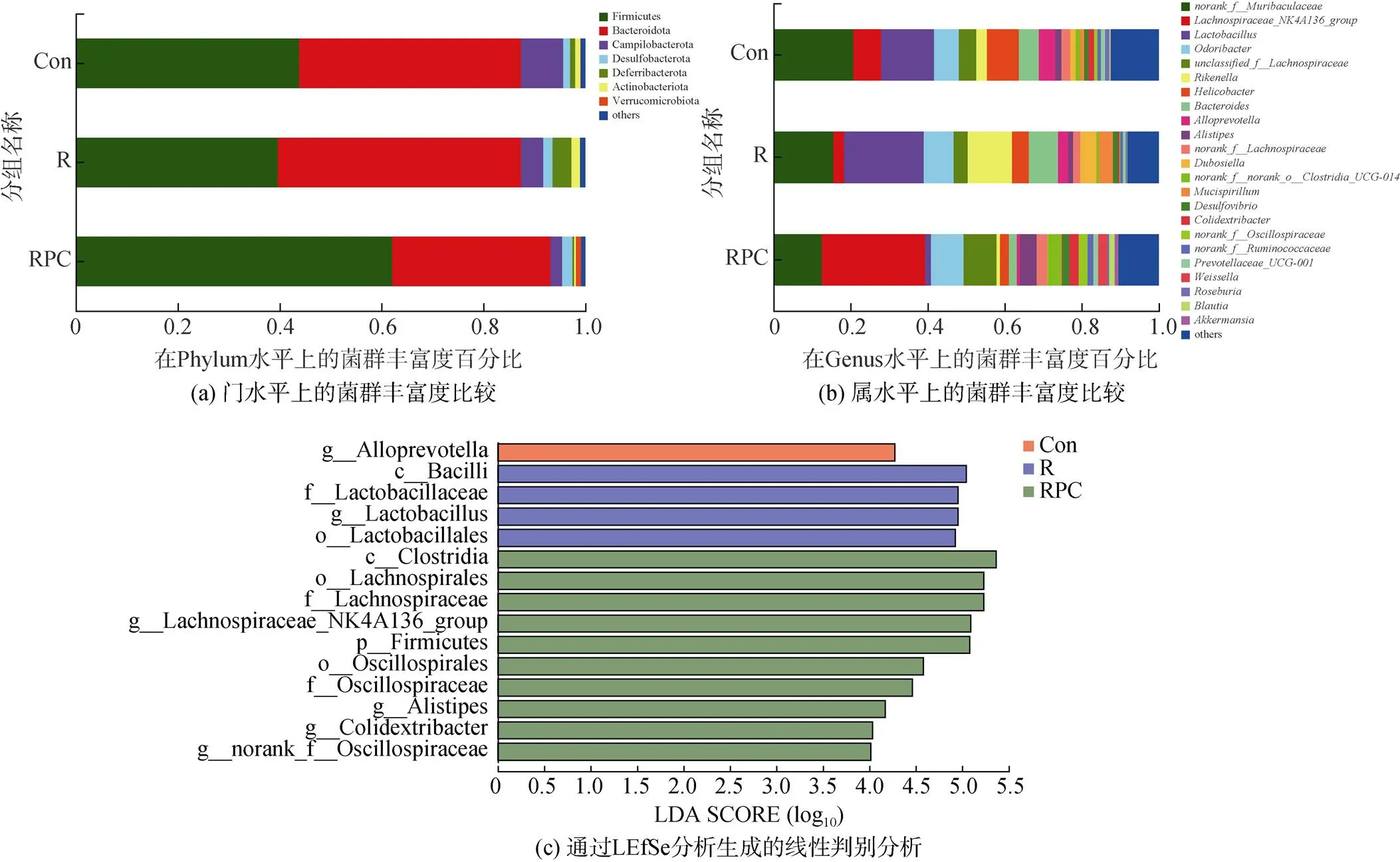
圖6 不同組小鼠腸道菌群的比較
注: Con: 對照組; R: 多次靜脈注射BLM組; RPC: 多次靜脈注射BLM加PC干預組。通過LEfSe分析生成的線性判別分析, LSA閾值>4
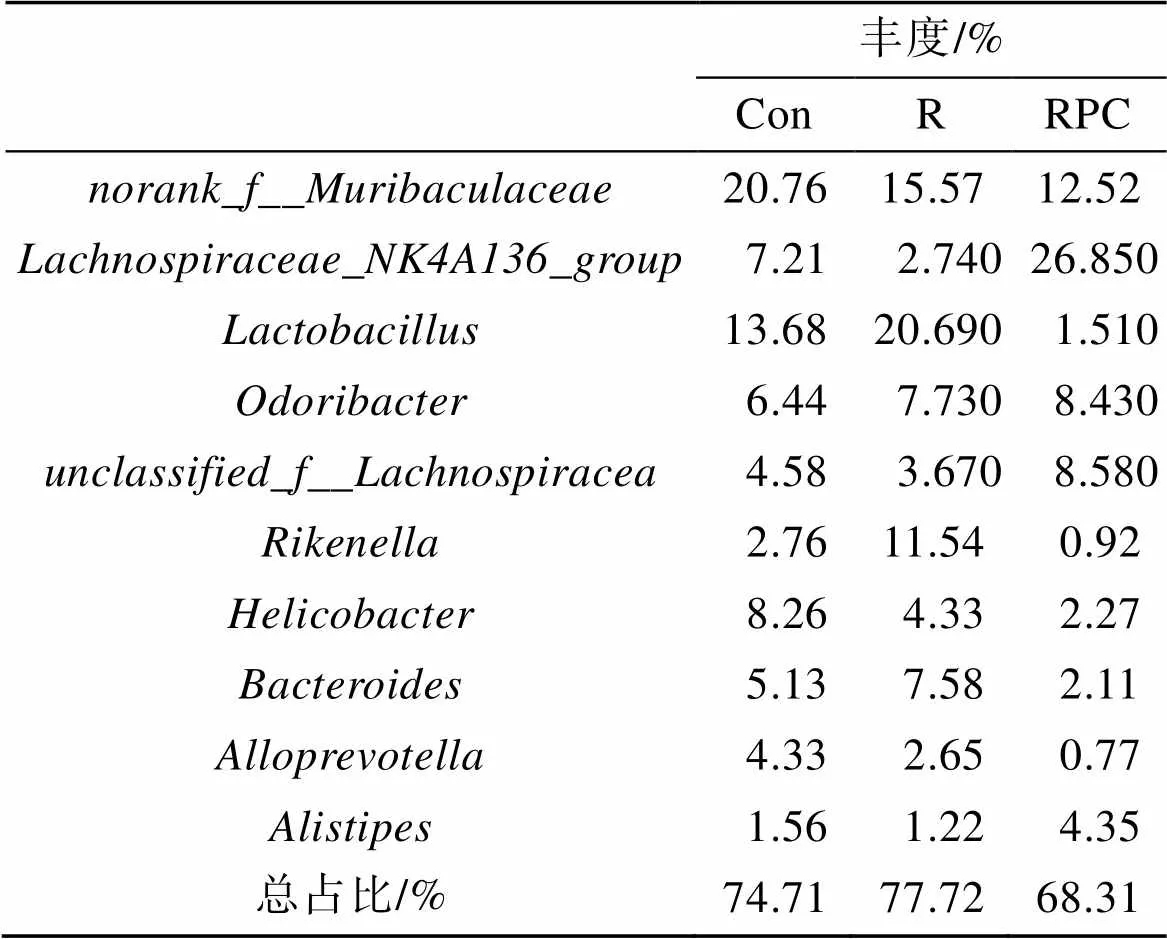
表3 三組小鼠的主要腸道菌群在屬水平的相對豐度
注: Con: 正常對照組; R: 多次靜脈注射組; RPC: 多次靜脈注射+口服PC組
PC可以通過增加有益細菌并減少有害細菌的含量來改善由于尾靜脈注射BLM造成的小鼠腸道菌群失衡。主要的有害細菌包括, 其含量增加通常發生在腸炎類疾病的發展過程中, 這表明BLM靜脈注射過程中不僅對肺部造成了損傷, 還可能影響腸組織的功能, 而口服PC可以減輕BLM引起的腸損傷[21]。同時研究表明, 有益菌可以通過殺死病原細菌, 定植和拮抗有害細菌, 與有害細菌競爭氧氣和營養, 為腸道提供微生物屏障以及維持或恢復宿主與腸道微生物之間的平衡[18]。是一類有益細菌, 它可以通過賴氨酸發酵產生丁酸, 在鼠模型和人類中已分別顯示出與結腸炎和肝病密切相關[22]。它是具有與雙歧桿菌相似功能的益生菌, 可以調節小鼠的能量代謝并幫助其適應周圍環境[23]。和均屬于Lach-nospiraceae科, 研究認為Lachnospiraceae科細菌在腸道中用于丁酸鹽的生產, 其中丁酸酯可以與其他短鏈脂肪酸(SCFA)通過不同的機制抑制腸道炎癥, 維持腸道屏障并調節腸蠕動[24-25]。
PC對肺纖維化小鼠的腸道菌群起到恢復作用, 本課題組猜測可能是由于PC經過消化道被胃、腸內的消化酶降解, 進而產生了氨基酸、小肽、藻膽素等小分子, 這些小分子參與調節腸道菌群的結構, 增加了有益細菌的數量, 并起到增強SCFA合成提高機體免疫力的作用[26]。同時這些益生細菌可能通過抑制病原微生物對腸上皮細胞的黏附和侵襲并在腸道定植后與病原微生物競爭而有效地抑制病原微生物的生長。
2.4 LPS與優勢菌群之間的相關性
通過相關性熱圖分析LPS含量與RPC組糞便中優勢菌群的相關性, 在屬水平上評估分類水平在總豐度前20的物種, 以找到在PF疾病發生過程中起作用的關鍵性微生物群。如圖7所示這些菌屬與至少一項LPS的指標呈正相關或負相關。
大量研究表明, 腸道菌群中的許多細菌與炎癥相關。例如, Muribaculaceae代表的擬桿菌門中的菌群, 一般情況下它的含量與LPS含量成正比, 它可以參與自然殺傷細胞和NF-κB信號傳導, 同時其可以通過IgA與先天性和適應性免疫反應相互作用[27]。、、等有益菌與小鼠肺組織、腸組織以及血清中的LPS含量成反比。可以增強腸壁屏障, 其通過在腸壁屏障中攝取黏蛋白并將其轉變為SCFA, 包括乙酸鹽[28]。因此猜測PC口服后經過胃、腸內的消化酶降解, 產生了氨基酸、小肽、藻膽素等小分子, 這些小分子促進了有益菌生長并進一步生成丁酸、丙酸鹽等SCFA的生物合成。本課題組推測口服PC后可能通過抑制LPS的含量來抑制TLR4途徑的活化, 同時增加腸道菌群中有益細菌的含量, 降低有害細菌的含量。與此同時, 本課題組的數據強調小鼠口服PC后觀察到的LPS的降低可能與毛螺菌科細菌的水平有關, 這與2.3.2節的結論相符。因此猜測腸道菌群可能與小鼠的炎癥有關, 而PC的抗炎作用在一定程度上與特定的腸道菌群有關。PC可以促進腸道細菌的生長, 相反, 腸道細菌也可以利用未消化的蛋白質, 然后通過發酵這些飲食營養以產生代謝產物, 例如SCFA, 它們可以用作結腸上皮細胞的養料并誘導腸道細胞增殖。因此, PC有益于人體健康。
3 結論
本研究采用多次靜脈注射BLM的方式誘導ICR小鼠肺纖維化, 證實了口服PC可以減輕小鼠肺纖維化程度。PF小鼠口服PC后, 增加了腸道菌群的豐富度和多樣性, 這可能是由于PC能夠促進腸道絨毛的生長, 這對腸黏膜起到了保護作用, 進而增強了小鼠本身對食物的消化吸收能力, 從而增加了腸道菌群可利用的營養。同時BLM誘導后, 小鼠腸道菌群中的有益菌群減少, 有害菌群增加, PC處理可以通過增加腸道菌群中,等有益細菌的數量并減少有害細菌的數量來調節腸道菌群, 這為研究疾病和微生態學提供了一些基礎數據。為PC減輕小鼠PF的潛在功能和機制提供了新的線索(圖8)。隨后的研究需要進一步闡明PC的活性是由蛋白質本身還是由其代謝產物決定的, 以及蛋白質的代謝產物如何在體內不同的菌群中發揮不同的作用。
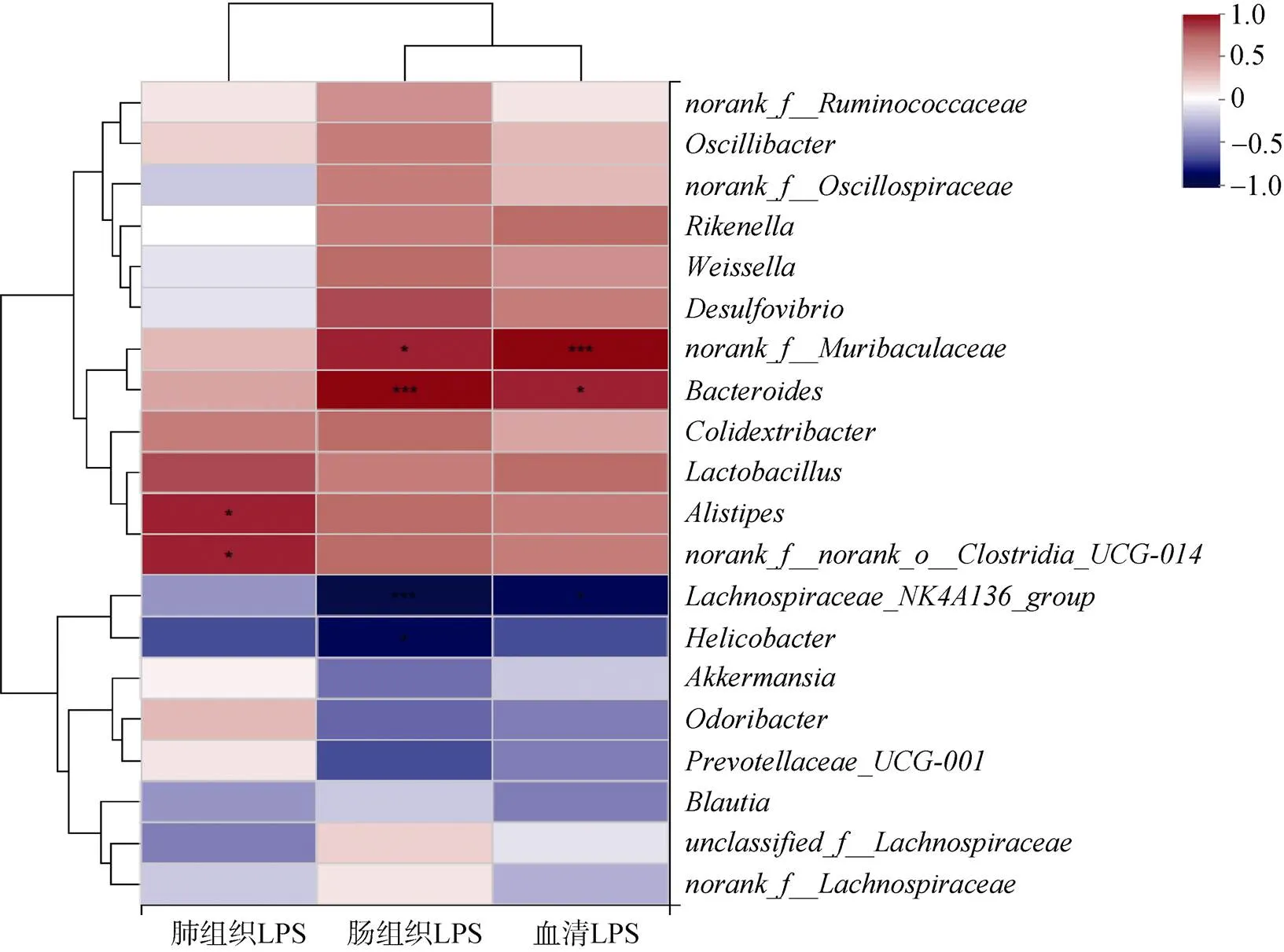
圖7 口服PC后腸道菌群在屬水平的豐度與小鼠肺組織、腸組織和血清中LPS含量的相關性分析
注: 紅色表示正相關, 藍色表示負相關, 屬豐度與環境因子之間的相關程度由顏色的強度表示。數據表示為平均值±SD(=5); *<0.05, **<0.01, ***<0.001
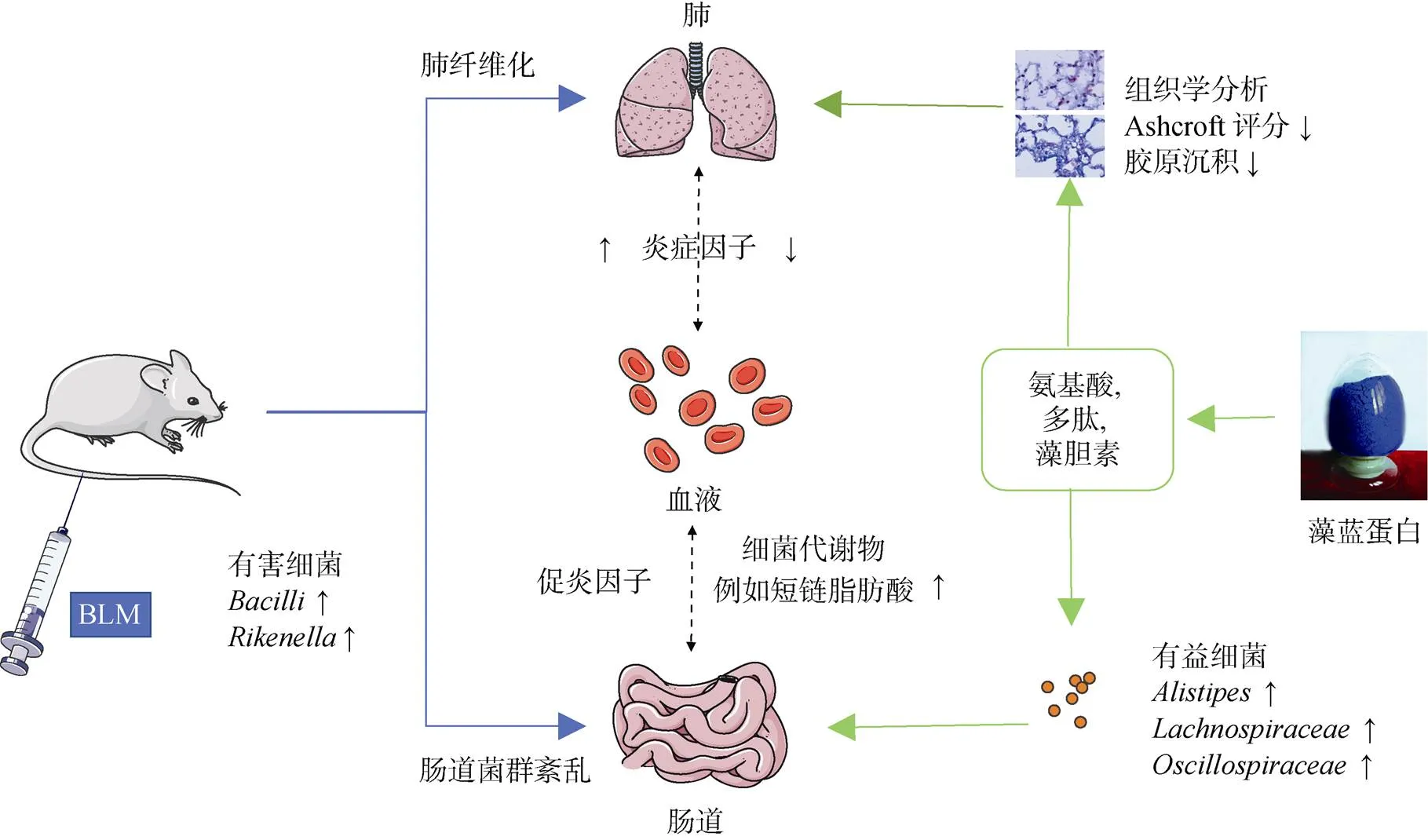
圖8 藻藍蛋白對BLM誘導的肺纖維化的潛在機制
[1] HECHT S M. Bleomycin: New perspectives on the mechanism of action[J]. Journal of Natural Products, 2000, 63(1): 158-168.
[2] YU L, SUN D Y, LIANG F, et al. Ion-pair LC–UV method for the determination of boanmycin in mouse plasma and its application to a pharmacokinetic study[J]. Chroma-tographia, 2010, 72(s3/4): 357-359.
[3] 余林, 茍寶迪. 博來霉素的抗腫瘤活性及誘導肺纖維化毒性的研究進展[J]. 包頭醫學院學報, 2018, 34(11): 126-129. YU Lin, GOU Baodi. Research progress on the antitumor activity of bleomycin and the toxicity of induced pulmonary fibrosis[J]. Journal of Baotou Medical College, 2018, 34(11): 126-129.
[4] POVIRK L F, WERNER W, WOLFGANG K, et al. DNA double-strand breaks and alkali-labile bonds produced by bleomycin[J]. Nucleic Acids Research, 1977, 4(10): 3573-3580.
[5] DELLA LATTA V, CECCHETTINI A, DEL RY S, et al. Bleomycin in the setting of lung fibrosis induction: from biological mechanisms to counteractions[J]. Phar-macological Research, 2015, 97: 122-130.
[6] VOGELMEIER C F, CRINER G J, MARTINEZ F J, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report: gold executive summary[J]. European Respiratory Journal, 2017, 49(6): 575-601.
[7] BARCZI E, STAROBINSKI L, KOLONICS-FARKAS A, et al. Long-term effects and adverse events of nintedanib therapy in idiopathic pulmonary fibrosis patients with functionally advanced disease[J]. Advances in Therapy, 2019, 36(5): 1221-1232.
[8] 王庭健, 林凡, 趙方慶, 等. 藻膽蛋白及其在醫學中的應用[J]. 植物生理學通訊, 2006(2): 303-307. WANG Tingjian, LIN Fan, ZHAO Fangqing, et al. Phycobiliprotein and its application in medicine[J]. Plant Physiology Journal, 2006(2): 303-307.
[9] HAO S, LI S, WANG J, et al. Phycocyanin exerts anti- proliferative effects through down-regulating TIRAP/NF- kappa B activity in human non-small cell lung cancer cells[J]. Cells, 2019, 8(6): 588.
[10] LI C, YU Y, LI W, et al. Phycocyanin attenuates pulmonary fibrosis via the TLR2-MyD88-NF-κB signaling pathway[J]. Scientific Reports, 2017, 7(1): 5843.
[11] 趙喆, 白樺, 費凱倫, 等. 人體肺部與腸道細菌在肺癌診治中的研究進展[J]. 中華結核和呼吸雜志, 2020, 43(7): 585-588. ZHAO Zhe, BAI Hua, FEI Kailun, et al. Research progress of human lung and intestinal bacteria in the diagnosis and treatment of lung cancer[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2020, 43(7): 585-588.
[12] XIE Y Y, LI W J, LU C, et al. The effects of phycocyanin on bleomycin-induced pulmonary fibrosis and the intestinal microbiota in C57BL/6 mice[J]. Applied Microbiology and Biotechnology, 2019, 103(20): 8559-8569.
[13] LU L, LI W, SUN C, et al. Phycocyanin ameliorates radiation‐induced acute intestinal toxicity by regulating the effect of the gut microbiota on the TLR4/Myd88/ NF‐κB pathway[J]. Journal of Parenteral and Enteral Nutrition, 2019, 44(7): 1308-1317.
[14] XIE Y Y, LI W J, ZHU L M, et al. Effects of phycocyanin in modulating the intestinal microbiota of mice[J]. MicrobiologyOpen, 2019, 8(9): 11.
[15] LI WJ, LU LN, LIU B, et al. Effects of phycocyanin on pulmonary and gut microbiota in a radiation-induced pulmonary fibrosis model[J]. Biomedicine & Pharmacotherapy, 2020, 132: 110826.
[16] SZAPIEL S V, ELSON N A, FULMER J D, et al. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse[J]. American Review of Respiratory Disease, 1979, 120(4): 893-899.
[17] MOHD SHAUFI M, SIEO C, CHONG C, et al. Deciphering chicken gut microbial dynamics based on high-throughput 16S rRNA metagenomics analyses[J]. Gut Pathogens, 2015, 7(1): 4.
[18] QI H T, LIU Y, QI X, et al. Dietary recombinant phycoerythrin modulates the gut microbiota of h22 tumor-bearing mice[J]. Marine Drugs, 2019, 17(12): 665.
[19] LI A L, NI W W, LI Y, et al. Effect of 2′-fucosyllactose supplementation on intestinal flora in mice with intestinal inflammatory diseases[J]. International Dairy Journal, 2020, 110: 104797.
[20] XU J, GE J, HE X, et al. Caffeic acid reduces body weight by regulating gut microbiota in diet-induced-obese mice[J]. Journal of Functional Foods, 2020, 74: 104061.
[21] DONG W, HUANG K, YAN Y, et al. Long-term consumption of 2-O-beta-D-Glucopyranosyl-L-ascorbic acid from the fruits of lycium barbarum modulates gut microbiota in C57BL/6 mice[J]. Journal of Agricultural and Food Chemistry, 2020, 68(33): 8863-8874.
[22] VAN DEN ABBEELE P, BELZER C, GOOSSENS M, et al. Butyrate-producing clostridium cluster XIVA species specifically colonize mucins in an in vitro gut model[J]. The ISME Journal, 2013, 7(5): 949-961.
[23] MA T Y, IWAMOTO G K, HOA N T, et al. TNF-alpha- induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2004, 286(3): 367-376.
[24] TAN W, ZHANG Q, DONG Z, et al. Phosphatidylcholine ameliorates lps-induced systemic inflammation and cognitive impairments via mediating the gut-brain axis balance[J]. Journal of Agricultural and Food Chemistry, 2020, 68(50): 14884-14895.
[25] MA L, NI Y, WANG Z, et al. Spermidine improves gut barrier integrity and gut microbiota function in diet- induced obese mice[J]. Gut Microbes, 2020, 12(1): 1-19.
[26] CHEN L, LI H, CHEN Y, et al. Probiotic Lactobacillus rhamnosus GG reduces mortality of septic mice by modulating gut microbiota composition and metabolic profiles[J]. Nutrition, 2020, 78: 110863.
[27] SCHANZ O, CHIJIIWA R, CENGIZ S C, et al. Dietary AhR ligands regulate ahrr expression in intestinal immune cells and intestinal microbiota composition[J]. International Journal of Molecular Sciences, 2020, 21(9): 3189.
[28] ANHE F, PILON G, ROY D, et al. Triggering akkermansia with dietary polyphenols: a new weapon to combat the metabolic syndrome?[J]. Gut Microbes, 2016, 7(2): 146-153.
Effect of phycocyanin on the intestinal flora of mice with bleomycin-induced pulmonary fibrosis
ZANG Fan1, 2, LI Wen-jun2, 3, QIN Song2, 3, LIN Jian1
(1. College of Life Sciences, Yantai University, Yantai 264005, China; 2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China; 3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China)
Bleomycin (BLM) is currently used to treat various cancers, but it induces several side effects, such as pulmonary fibrosis (PF). Thus, the quality of life of patients is considerably reduced. Phycocyanin (PC), a pigment-protein complex, has been proven to be effective for many diseases, including PF. Studies have found that chronic intestinal diseases are usually accompanied by lung diseases, and the intestinal flora of patients is disordered. Based on the above findings, this article studied the effect of PC on intestinal flora in mice with BLM-induced PF. BLM was injected into mice through the tail vein to construct a model of PF. Combined with 16S rRNA high-throughput gene sequencing technology, the influence of PC on the intestinal flora of mice with BLM-induced PF was analyzed. Results showed that PC reduced the degree of PF induced by BLM and regulated the intestinal flora of mice. After mice were injected with BLM through the tail vein, lung injury was observed, and the intestinal flora was disturbed. Following oral PC intervention, lung tissue sections from mice showed the amelioration of PF, decreased collagen deposition, and reduced alveolar septum and inflammatory cell infiltration. At this time, the abundance of beneficial bacteria, such asand, was increased in the feces of mice, the abundance of harmful bacteria, such as, decreased, and the intestinal flora tended to be normal. We speculate that PC can resolve the intestinal flora disorder caused by intravenous BLM injection by increasing the abundance of beneficial bacteria and reducing the abundance of harmful bacteria in the intestines, thereby reducing the degree of PF in mice.
phycocyanin; bleomycin; pulmonary fibrosis mice; intestinal flora
Feb. 6, 2021
Q93
A
1000-3096(2023)6-0042-10
10.11759/hykx20210206001
2021-02-06;
2021-02-27
煙臺市重點研發項目(2019XDHZ101, 2020MSGY084); 國家重點研發專項(2018YFD0901102)
[Yantai Key R&D Project, Nos. 2019XDHZ101, 2020MSGY08; National Key Research and Development Project of China, No. 2018YFD0901102]
臧帆(1995—), 女, 漢族, 山東煙臺人, 碩士研究生, 研究方向為海洋藻類學, E-mail: zf1458355@163.com; 秦松(1968—),通信作者, 男, 漢族, 山東煙臺人, 研究員, 博士生導師, 研究方向為海洋藻類學、海岸帶生物工程, E-mail: sqin@yic.ac.cn; 林劍(1963—), 通信作者, 男, 漢族, 山東煙臺人, 教授, 碩士導師, 研究方向為生物工程、微生物發酵, E-mail: linjian3384@163.com
(本文編輯: 楊 悅)

