單過硫酸氫鉀預氧化-鐵鹽混凝體系降解水中有機物的特性研究
王昶昊,劉雪峰,李澤楷,高瑞
(山東農業大學 水利土木工程學院,山東 泰安 271018)
隨著環境污染的加劇和人口數量的增加,大量的有機污染物在水源中被檢測出[1-2]。混凝、沉淀、過濾等傳統的飲用水處理工藝對水溶性有機物的去除能力有限,氧化預處理技術是提升水源水中可溶性有機物去除率的有效手段之一[3]。
近年來,單過硫酸氫鉀(PMS)等新興的氧化劑已成為高級氧化工藝的研究熱點,PMS又稱過一硫酸氫鉀(KHSO5),由于分子中存在過氧鍵-O-O-,其具有較強的氧化能力[4],能氧化降解大多數有機污染物[5]。
混凝過程在去除TOC、濁度和色度等方面起著主要作用,而且混凝的成本低、高效且無污染。鐵鹽是常用的混凝劑,預氧化劑PMS氧化過程中產生的H+,能促進鐵鹽的水解及聚合過程,因此預氧化-鐵鹽混凝體系具有廣泛的應用前景。但PMS在飲用水的預氧化方面仍處于理論研究階段, PMS預氧化-鐵鹽(硫酸鐵/亞鐵)混凝體系能否將水中的有機物有效降解,同時該過程的適宜工藝參數尚無明確定論,本試驗使用成本較低、在pH值6~8的范圍內對水中有機物的去除效果較好的Fe2(SO4)3、FeSO4[6],檢測其相對應的混凝體系的降解效果。
本論文以實際水樣的TOC為研究對象,研究在使用PMS預氧化-鐵鹽(硫酸鐵/亞鐵)混凝體系降解有機物時, PMS濃度、適合的混凝劑種類及濃度、混凝沉淀時間對水中有機物降解程度的影響,為PMS預氧化-鐵鹽混凝體系的合理控制提供理論依據。
1 材料和方法
1.1 試驗水樣
原水取自山東地區多個地表水源地并在混合后進行初步制備,水質指標如表1所示。
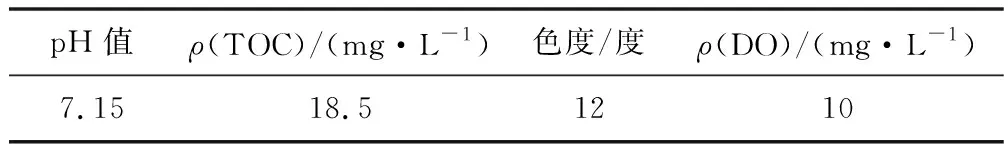
表1 原水水質指標
1.2 試劑與儀器
單過硫酸氫鉀(PMS)、硫酸鐵(Fe2(SO4)3)、硫酸亞鐵(FeSO4)、磷酸(H3PO4)、鹽酸(HCL)均為分析純,用于配制試驗所需試劑。
總有機碳分析儀, VP-1.5C旋片式真空泵,低速臺式大容量離心機,定時恒溫磁力攪拌器。
1.3 試驗方法
對原水水樣檢測其原始TOC值后,在快速攪拌(400 r/min)條件下投加PMS并持續攪拌2 min,隨后進行0.5 h的預氧化,預氧化結束后在慢速攪拌(100 r/min)條件下投加混凝劑并持續攪拌10 min,待混凝沉淀結束后,取上層清液進行離心處理后放入TOC分析儀檢測其剩余TOC質量濃度,反應溫度為25 ℃。所有試驗樣品均做平行樣,誤差棒代表3 組數據的標準偏差,相對標準偏差低于20%。
PMS 投加量試驗:控制Fe2+/ Fe3+投加量為400 μmol/L,預氧化時間0.5 h,混凝沉淀時間2 h,PMS的投加量分別為200,400,600,800 μmol/L,按上述方法進行試驗。
混凝劑投加量試驗:控制PMS投加量為 200 μmol/L ,預氧化時間0.5 h,混凝沉淀時間2 h,Fe2+/Fe3+的投加量分別為200,400,600,800 μmol/L,按上述方法進行試驗。
混凝沉淀時間試驗:控制PMS投加量為200 μmol/L ,Fe2+/Fe3+的投加量為200 μmol/L,預氧化時間0.5 h,混凝沉淀時間分別為1,1.5,2,2.5 h ,按上述方法進行試驗。
1.4 分析方法
預氧化-混凝試驗結束后,取 20 mL反應液進行低速離心處理并用0.22 μm濾膜過濾,然后將液體轉移至25 mL的透明塑料管中,利用總有機碳分析儀進行檢測。
TOC使用濕法氧化-非色散紅外探測方法進行檢測[7]。
2 結果與討論
2.1 作用機理
單過硫酸氫鉀在水中經鏈式反應可產生硫酸自由基(SO4-·)、次氯酸、過氧化氫(H2O2)和羥基自由基(·OH)等活性成分,主要作用機理如以下反應式[8]:
2HSO5-→2SO4-·+H2O2
SO4-·+H2O→SO42-+·OH+H+
2SO4-·+Cl-+H2O→2SO42-+HClO+H+
鐵鹽(Ⅲ)化合物在水溶液中的水解及聚合過程如下:
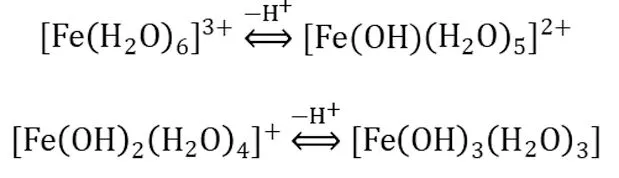
在此過程中亦會發生聚合:

生成雙核二聚體,還可進一步生成更高級的聚合物如Fe3(OH)45+等[9]。
硫酸亞鐵水解產物為單核配合物,不具備Fe3+的優良混凝效果,一般將二價鐵先氧化成三價鐵再使用。
本試驗所應用的PMS預氧化-Fe2+/Fe3+混凝體系,在預氧化階段產生的SO4-·等活性物質,能使水中有機物得到充分的氧化降解,能夠破壞有機物對膠體的保護作用,從而促進混凝,減少混凝劑投量,同時該過程中生產的H+加快了二價鐵氧化成三價鐵的速度。在混凝階段,Fe3+不斷轉化為低電荷高聚合度的狀態,在此狀態下的水中絡合物對水中膠粒產生吸附架橋作用而產生凝聚及絮凝作用[8]。
2.2 不同PMS濃度對TOC去除率的影響
不同PMS投加量條件下,PMS預氧化-鐵鹽混凝體系對試驗用水中TOC的降解效果如圖1所示。
不同PMS投加量條件下混凝體系均具有降解TOC的能力,隨著PMS投加量的升高,兩種混凝體系TOC去除率都呈現升高的趨勢,PMS 濃度從 200 μmol/L 增加至 800 μmol/L時,PMS-Fe2+混凝體系和PMS-Fe3+混凝體系對TOC的去除率分別由9.08%和14.92%增至38.86%和41.78%。說明,隨著PMS濃度的增加,SO4-·等活性物質濃度提高,混凝體系氧化水中有機物的能力提升,對TOC的去除率升高。
對PMS-Fe2+混凝體系和PMS-Fe3+混凝體系兩組數據做比較,可發現在只改變PMS投加量的情況下,PMS-Fe3+混凝體系的TOC去除率相對較高,氧化效果更好。推測是因為PMS-Fe2+混凝體系在預氧化階段產生的部分活性物質用于氧化Fe2+,使氧化能力降低。
2.3 混凝劑濃度對降解TOC的影響
不同混凝劑投加量條件下,PMS預氧化-鐵鹽混凝體系對試驗用水的TOC的降解效果如圖2所示。
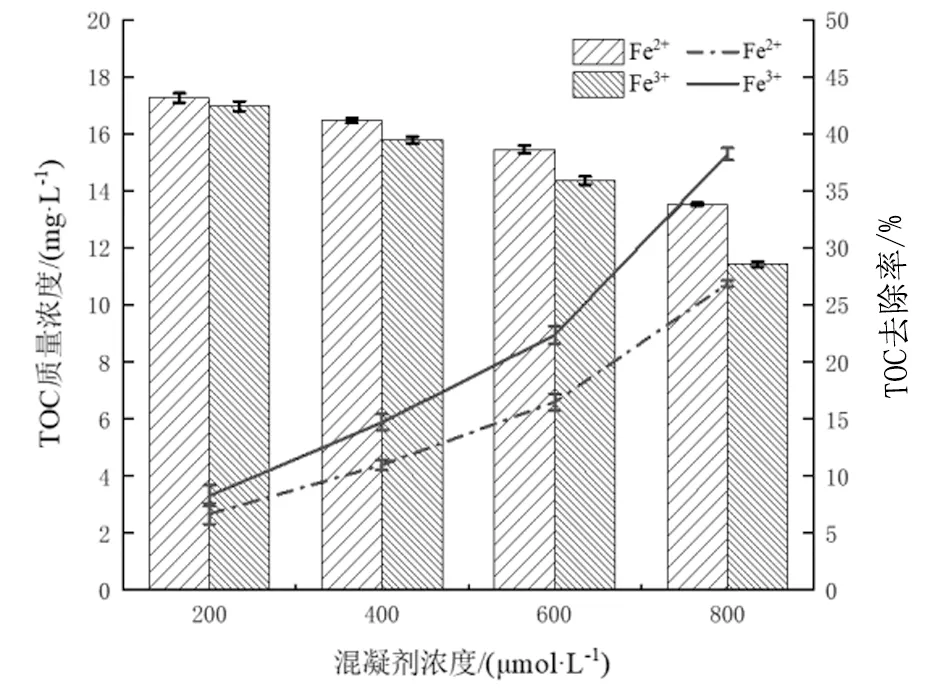
圖2 混凝劑濃度對TOC去除率的影響
不同混凝劑投加量條件下混凝體系均具有降解TOC的能力,隨著混凝劑投入量的升高,兩種混凝體系TOC去除率都呈現升高的趨勢,Fe2+/ Fe3+濃度從200 μmol/L 增加至800 μmol/L時,PMS-Fe2+混凝體系和PMS-Fe3+混凝體系對TOC的去除率分別由6.68%和8.27%增至26.86%和38.22%。說明,隨著混凝劑濃度的增加,鐵離子水解和聚合反應過程加劇,水中的膠粒會強烈吸附水解與聚合反應的各種產物。被吸附的帶正電荷的多核絡離子能夠壓縮雙電層、降低電位,使膠粒間排斥的勢能降低,導致膠粒脫穩,加強混凝效果,混凝體系對TOC的去除率隨之升高。
對PMS-Fe2+混凝體系和PMS-Fe3+混凝體系兩組數據做比較,可發現在只改變混凝劑投加量的情況下,PMS-Fe3+混凝體系的TOC去除率相對較高,氧化效果更好。PMS-Fe3+混凝體系隨著混凝劑濃度增加,TOC去除率增幅更明顯。
2.4 混凝沉淀時間對降解TOC的影響
不同混凝沉淀時間條件下,PMS預氧化-鐵鹽混凝體系對試驗用水中TOC的去除效果如圖3所示。

圖3 混凝沉淀時間對TOC去除率的影響
不同混凝沉淀時間條件下混凝體系均具有降解TOC的能力,隨著混凝沉淀時間的增加,TOC去除率呈現升高的趨勢,但影響并不明顯,反應時間從1 h增加至2.5 h,PMS-Fe2+混凝體系和PMS-Fe3+混凝體系的TOC去除率分別只增加了2.45%和2.72%。說明在PMS預氧化-鐵鹽混凝體系的氧化產物(如SO4-·等)生成速度快,反應快,受時間影響小,且反應后氧化產物穩定,幾乎不能再發揮降解作用了。
對PMS-Fe2+混凝體系和PMS-Fe3+混凝體系兩組數據做比較,可發現在只改變混凝沉淀時間的情況下,PMS-Fe3+混凝體系的TOC去除率相對較高,氧化效果更好。在相同混凝沉淀時間條件下, PMS-Fe3+混凝體系的TOC去除率始終高于PMS-Fe2+混凝體系。
3 結論
通過濕法氧化-非色散紅外探測方法檢測單過硫酸氫鉀預氧化-鐵鹽混凝體系對自然地表水體中TOC的去除效果,結論如下:
(1)PMS預氧化-Fe2+/Fe3+混凝體系能夠在水的預氧化階段有效降解水中有機物,隨著PMS和鐵鹽投加量的增加,混凝體系 TOC去除率升高,降解有機物的能力增強。
(2)不同的PMS濃度條件對混凝體系對水樣中TOC的降解率影響效果顯著。在混凝劑濃度為400 μmol/L ,PMS 濃度為200 μmol/L至800 μmol/L的范圍內時,PMS-Fe2+混凝體系和PMS-Fe3+混凝體系對TOC的去除率均隨PMS 濃度上升,最高去除率分別為38.86%和41.78%。
(3)不同的混凝劑濃度條件對混凝體系對水樣中TOC的降解率影響效果顯著。在PMS濃度為200 μmol/L,Fe2+/Fe3+濃度為200 μmol/L至800 μmol/L的范圍內時,PMS-Fe2+混凝體系和PMS-Fe3+混凝體系對TOC的去除率均隨混凝劑濃度上升,最高去除率分別為26.86%和38.22%。
(4)PMS預氧化-鐵鹽混凝體系氧化速度快,且反應后氧化產物穩定,幾乎不能再發揮降解作用,混凝沉淀時間對混凝體系TOC去除率的影響不明顯,工藝設計中可適當減少混凝沉淀時間。
(5)當PMS、混凝劑投加量均在200 μmol/L至800 μmol/L的范圍內時,PMS-Fe3+混凝體系對水中TOC的去除率高于PMS-Fe2+混凝體系,具有更好的氧化效果,在理論狀態下Fe3+更適合用作PMS預氧化-鐵鹽混凝體系的混凝劑。

