LncRNA HOXB-AS1對乳腺癌MCF-7細胞增殖、遷移、侵襲和凋亡的影響機制研究
王雨珂,田 程,李代龍,許新華
(三峽大學醫學院,湖北 宜昌 443000)
乳腺癌是一種異質性疾病,位列全球第2大腫瘤,每年約有220萬新發病例,68萬死亡病例[1]。目前乳腺癌的治療方法包括手術、放療、化療、內分泌治療、靶向治療和免疫治療[2]。雖然這些治療方法明顯改善了乳腺癌患者的疾病進展、復發風險、總體生存率,但由于其異質性,部分患者療效顯著,部分患者療效卻不明顯。此外,藥物抵抗、腫瘤轉移及復發嚴重威脅著患者的長期生存狀況。
人類轉錄組學研究顯示,超過50%的轉錄本沒有蛋白編碼能力,長鏈非編碼RNA(long non-coding RNA,LncRNA)在轉錄、轉錄后及染色體水平調控基因的表達,影響機體生理、病理進程[3]。LncRNA存在于外泌體、凋亡小體等囊泡結構中,或與某些蛋白結合分泌至血清、尿液和其他體液中。有研究顯示,LncRNA同源異型盒基因B-AS1(HOXB-AS1)在膠質母細胞瘤、子宮內膜癌中表達上調,但在乳腺癌組織及乳腺癌細胞MCF-7、T47-D中的表達下調[4-6]。但HOXB-AS1在乳腺癌發生、發展中的作用目前仍不清楚。本文旨在探討HOXB-AS1對乳腺癌MCF-7細胞增殖、侵襲、遷移、凋亡的影響,以及對Akt/mTOR通路介導自噬的影響。
1 研究材料與方法
1.1 材料與試劑
1.1.1 人乳腺癌MCF-7細胞的來源
人乳腺癌MCF-7細胞于2020年6月20購自中國科學院分子細胞科學卓越創新中心。
1.1.2 藥品和試劑
MEM培養基(Hyclone);胎牛血清(fatal bovine serun,FBS)(Gibco);青霉素-鏈霉素溶液、Annexin V-FITC細胞凋亡檢測試劑盒、胰酶細胞消化液、RIPA裂解液、磷酸酶抑制劑混合物、蛋白酶抑制劑混合物、CCK-8試劑(碧云天);BCA蛋白濃度測定試劑盒、loading buffer、ECL超敏發光液、RNA提取試劑及逆轉錄試劑(Solarbio);SYBR Select Master Mix試劑盒(ThermoFisher Scientific);基質金屬蛋白酶(matrix metalloproteinases,MMP)-2、MMP-9、微管相關蛋白1A/1B-輕鏈3α(microtubule associated protein 1 light chain 3 alpha,LC3A)、磷酸化蛋白激酶B(phosphor-protein kinase B,p-Akt)、Akt、磷酸化雷帕霉素靶蛋白(phosphor-mammalian target of rapamycin,p-mTOR)、mTOR、糖酵解酶3-磷酸甘油醛脫氫酶(glyceraldehyde phosphate dehydrogenase,GAPDH)兔單克隆抗體(CST);p62兔多克隆抗體(abcam);HOXB-AS1過表達質粒(上海吉凱基因科技有限公司);Lipofectamine 3000(Thermo Fisher Scientific)。
1.2 方法
1.2.1 乳腺癌MCF-7細胞的培養、轉染和分組
將MCF-7細胞置于含有10% FBS的MEM培養基中,在37℃的5% CO2孵育箱中培養。將MCF-7分為對照組(Con組,n=3)、陰性對照組(NC組,n=3)和HOXB-AS1過表達組(HOXB-AS1組,n=3)。使用Lipofectamine 3000將陰性對照質粒和HOXB-AS1分別轉染至NC組和HOXB-AS1組的MCF-7細胞。對照組的MCF-7細胞不做處理,NC組和HOXB-AS1組的MCF-7細胞轉染48h后進行其他處理。
1.2.2 CCK-8法檢測乳腺癌MCF-7細胞增殖活力
將MCF-7細胞轉染處理后,接種至96孔板,密度為104個/孔。然后將MCF-7細胞放回孵育箱培養24h,加入細胞增殖-毒性檢測試劑(CCK-8)10μL/孔,繼續孵育1h。在450nM處測定其吸光度(OD)值。
細胞增殖活力=(處理孔OD-對照孔OD)/對照孔OD×100%。
1.2.3 乳腺癌MCF-7細胞的遷移實驗
MCF-7細胞分組處理同1.2.1,將MCF-7細胞接種于6孔培養板中,細胞貼壁后加入絲裂霉素處理。當MCF-7細胞融合達到90%后,用200μL的移液槍槍頭進行細胞劃痕,磷酸鹽緩沖液(PBS)漂洗,去除漂浮細胞,然后再無血清培養基中培養,24h后計算細胞遷移率。
細胞遷移率=(0h劃痕寬度-24h劃痕寬度)/0h劃痕寬度×100%。
1.2.4 Transwell實驗檢測乳腺癌MCF-7細胞的侵襲
將0.5%的Matrigel基質膠加入Transwell小室中,37℃孵育2h。將MCF-7細胞轉染處理后,用不含FBS的MEM培養基重懸細胞,取MCF-7細胞懸液(2×104個細胞)接種至Transwell小室上室;然后將含有10% FBS的MEM培養基加入下室中。將MCF-7細胞繼續孵育24h后,取出Transwell小室,用95%的乙醇洗滌,并用多聚甲醛固定細胞。漂洗后用0.5%結晶紫染色,并用棉簽擦去上室中的細胞,拍照計數細胞數量。
1.2.5 流式細胞儀檢測乳腺癌MCF-7細胞的凋亡
將MCF-7細胞按105個/孔接種至6cm培養皿中,轉染處理后收集各組MCF-7細胞。MCF-7細胞用0.01mol/L的PBS漂洗后,加入1×Binding buffer重懸細胞。加入Annexin-FITC和PI染色液各5μL混勻,室溫避光孵育10min。在1h內使用BD AccuriC6流式細胞儀采集MCF-7細胞數據。
1.2.6 Western blot實驗檢測MMP-2、MMP-9、自噬及Akt/mTOR通路相關蛋白的表達
收集Con組、NC組和HOXB-AS1組的MCF-7細胞,使用RIPA裂解液冰上裂解細胞提取總蛋白,通過BCA法測定蛋白濃度,將樣本95℃水浴處理5min變性;取40μg蛋白樣品進行8%~10%聚丙烯酰胺凝膠電泳(SDS-PAGE)。濕法轉印至聚偏二氟乙烯膜(PVDF)上,用5%脫脂牛奶室溫封閉1h,加入MMP-2、MMP-9、LC3A、Beclin 1、p-Akt、Akt、p-mTOR、mTOR、GAPDH、p62抗體4℃過夜;再加入二抗室溫孵育1h,用凝膠成像系統采集圖像。
1.2.7 實時定量聚合酶鏈反應檢測HOXB-AS1基因的表達
使用TRIzol提取MCF-7細胞的總RNA,并進行RNA定量。取1μg總RNA使用UEIris Ⅱ RT-PCR System進行逆轉錄以得到cDNA。利用SYBR Select Master Mix試劑盒在ABI 7900儀器上進行實時定量聚合酶鏈反應(qRT-PCR)實驗。采用2-ΔΔCt計算基因相對表達量。
引物序列:
HOXB-AS1:5′-GGGGACTCCAGCGAAAT-3′(forward),5′-ACCCGAAGCCCAACCAC-3′(reverse);GAPDH:5′-CAGGAGGCATTGCTGATGAT-3′(forward),5′-GAAGGCTGGGGCTCATTT-3′(reverse)。
1.3 統計學方法

2 結果
2.1 各組LncRNA HOXB-AS1相對表達量情況
qRT-PCR實驗顯示,乳腺癌MCF-7細胞在轉染后,Con組的LncRNA HOXB-AS1相對表達量為0.15±0.05、NC組為0.13±0.03、HOXB-AS1組為0.75±0.04,HOXB-AS1組的LncRNA HOXB-AS1相對表達量顯著高于Con組和NC組(t=16.030,P=0.000),見圖1。
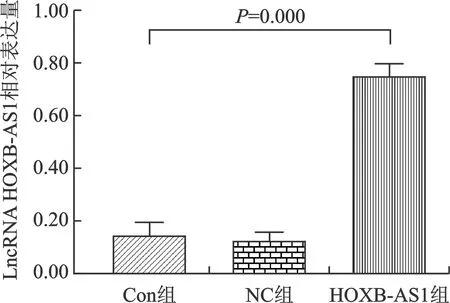
圖1 qRT-PCR實驗檢測MCF-7細胞中LncRNA HOXB-AS1相對表達量的統計
2.2 各組HOXB-AS1對乳腺癌MCF-7細胞增殖的影響
MCF-7細胞經HOXB-AS1處理24h后,CCK-8法檢測顯示,Con組的MCF-7細胞活力為(100.00±9.13)%、NC組為(100.00±2.94)%、HOXB-AS1組為(60.50±5.72)%,HOXB-AS1組的MCF-7細胞活力顯著低于Con組和NC組(t=7.428,P=0.000),見圖2。

圖2 CCK-8法檢測轉染HOXB-AS1后MCF-7細胞增殖活力的統計
2.3 各組HOXB-AS1對乳腺癌MCF-7細胞遷移和侵襲的影響
劃痕實驗顯示,轉染HOXB-AS1后,Con組的劃痕愈合速度為(61.00±3.61)%、NC組為(59.83±2.26)%、HOXB-AS1組為(39.03±3.61)%,HOXB-AS1組的劃痕愈合速度顯著低于Con組和NC組(t=16.090,P=0.002),即MCF-7細胞遷移能力減弱,見圖3。

注:A圖為各組劃痕實驗;B圖為各組遷移率的統計。
Western blot實驗檢測顯示,轉染HOXB-AS1后下調了MCF-7細胞遷移標志蛋白MMP-2和MMP-9的表達,見圖4。
Transwell實驗檢測顯示,轉染HOXB-AS1后,Con組的MCF-7細胞侵襲數為(343.36±20.82)個、NC組為(316.00±29.46)個、HOXB-AS1組為(105.02±15.00)個,HOXB-AS1組的MCF-7細胞侵襲數顯著低于Con組和NC組(t=16.093,P=0.000),見圖5。

注:A圖為Transwell實驗;B圖為MCF-7侵襲細胞數的統計。
2.4 各組HOXB-AS1對乳腺癌MCF-7細胞凋亡的影響
流式細胞儀檢測顯示,轉染HOXB-AS1后,Con組的MCF-7細胞凋亡率為(93.47±4.72)%、NC組為(90.67±7.37)%、HOXB-AS1組為(31.33±2.59)%,HOXB-AS1組的MCF-7細胞凋亡率顯著低于Con組和NC組(t=19.992,P=0.000),見圖6,圖中Annexin V+/PI+為晚期凋亡細胞或壞死細胞;Annexin V+/PI-為早期凋亡細胞。

注:A圖為流式細胞檢測;B圖為MCF-7細胞凋亡的統計。
2.5 HOXB-AS1對乳腺癌MCF-7細胞的Akt/mTOR介導自噬信號通路的影響
采用Western blot法檢測HOXB-AS1對MCF-7細胞的Akt/mTOR信號通路的影響,結果顯示,HOXB-AS1組的LC3B顯著高于Con組和NC組,HOXB-AS1組的p62顯著低于Con組和NC組,HOXB-AS1組的Beclin 1顯著高于Con組和NC組,HOXB-AS1組的p-Akt顯著低于Con組和NC組,HOXB-AS1組的p-mTOR顯著低于Con組和NC組,差異均有統計學意義(P<0.05);HOXB-AS1組的Akt、mTOR與Con組和NC組比較差異均無統計學意義(P>0.05),見表1、圖7。

表1 Con組和NC組及HOXB-AS1組Western blot法檢測各指標的比較
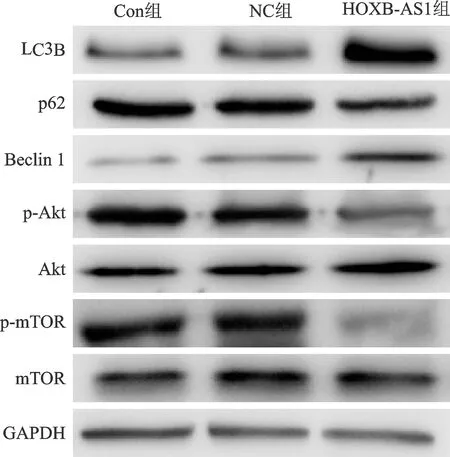
圖7 Western blot法檢測HOXB-AS1對MCF-7細胞的Akt/mTOR信號通路的影響
HOXB-AS1降低了p-Akt(Con組為1.49±0.19,HOXB-AS1組為0.89±0.23)、p-mTOR(Con組為1.26±0.12,HOXB-AS1組為0.45±0.19)蛋白的表達,上調了自噬相關蛋白Beclin 1(Con組為0.43±0.11,HOXB-AS1組為1.09±0.22)、LC3B(Con組為1.06±0.18,HOXB-AS1組為1.75±0.16)的表達,下調了自噬相關蛋白p62(Con組為2.06±0.16,HOXB-AS1組為1.68±0.23)的表達,增強了MCF-7細胞的自噬活性。
3 討論
3.1 HOXB-AS1與乳腺癌的關系
編碼轉錄因子的同源異形盒(homeobox,HOX)基因是生物體內重要的發育調控基因家族。HOX基因高度保守,編碼一類轉錄因子,在胚胎發育中發揮重要調控作用,哺乳動物HOX家族有A、B、C、D亞族,HOXB-AS1為A亞族的一個亞型[7]。研究發現HOXB-AS1在膠質母細胞瘤、子宮內膜癌中表達上調,促進腫瘤細胞的增殖、侵襲和遷移[5-6]。但HOXB-AS1在乳腺癌組織及乳腺癌MCF-7、T-47D細胞中的表達顯著下調[4]。HOXB-AS1在乳腺癌發生、發展中的作用目前仍不清楚。
本研究顯示,上調HOXB-AS1的表達,乳腺癌MCF-7細胞的活力顯著降低,MMP-2、MMP-9的表達水平顯著下降,細胞遷移和侵襲數量顯著降低。MMP-2和MMP-9可以降解細胞外基質,與細胞的遷移、侵襲相關。此外,流式細胞儀檢測結果顯示,HOXB-AS1高表達促進了MCF-7細胞的凋亡。這說明HOXB-AS1可抑制乳腺癌MCF-7細胞的增殖、侵襲、遷移及促進凋亡。
3.2 HOXB-AS1與乳腺癌MCF-7細胞自噬的關系
自噬是受損、變性或衰老的蛋白質及細胞器被溶酶體降解的過程。自噬標志物如Beclin 1影響著自噬囊泡的成核過程;LC3B在自噬體的延伸和成熟中發揮著重要作用;p62作為腳手架蛋白將泛素化蛋白運輸至自噬體。自噬在乳腺癌的發生發展中發揮著重要作用,Beclin 1是一種腫瘤抑制因子,在乳腺癌中的表達降低,與有絲分裂有關[8]。本研究結果顯示,HOXB-AS1促進了Beclin 1的表達。LC3B與自噬小體的數量正相關;p62是一種多聚泛素化蛋白包含LC3B相互作用序列和泛素化結合位點,將泛素化底物和其結合蛋白運輸至自噬體降解,因此,自噬過程中p62和LC3B的表達水平呈相反的趨勢[9]。轉染HOXB-AS1后,LC3B表達水平上調,p62表達下調。這說明HOXB-AS1誘導了乳腺癌MCF-7細胞的自噬。
3.3 Akt/mTOR通路與乳腺癌MCF-7細胞的關系
Akt/mTOR通路在諸多腫瘤中被激活,抑制該通路導致細胞活力降低及促進細胞死亡(包括凋亡和自噬)[10]。本研究顯示,HOXB-AS1降低了p-Akt和p-mTOR的表達,抑制了Akt/mTOR通路的活化,誘導了MCF-7細胞發生明顯的凋亡和自噬。
綜上所述,本研究發現HOXB-AS1通過Akt-mTOR通路介導了MCF-7細胞的凋亡和自噬,抑制其增殖、侵襲、遷移及促進凋亡。LncRNA是MCF-7細胞中信號通路的重要調節因子,包括mRNA的穩定及運輸及miRNA的表達[11]。HOXB-AS1如何作用于下游靶點影響MCF-7細胞的死亡仍需進一步的研究探討。

