輔助性和調節性T淋巴細胞亞群與過敏性紫癜患兒疾病嚴重程度的關系
張麗麗,林慧晶,吳明赴,季正華,李曉忠
(1.揚州大學附屬醫院,江蘇 揚州 225000;2.蘇州大學附屬兒童醫院,江蘇 蘇州 215003)
過敏性紫癜(henoch-schonlein purpura,HSP)是一種免疫性血管炎疾病,兒童期最常見[1-2];全年可發病,且春季多發,男多于女[3]。HSP以皮膚或黏膜下出血、皮膚紫癜(鮮紅或紫紅色)為主要臨床特征,雙下肢和臀部最多見,部分同時存在腹痛、便血、腎損害癥狀及蕁麻疹等多系統疾病[4-5]。HSP屬于良性疾病,具有自限性,病情一般6~8周逐漸緩解,大多數患兒預后良好;但該病易反復發作,機體易受免疫應答及炎性反應損傷而累及腎臟,嚴重者甚至會發生急性腎功能衰竭[6]。
HSP發病機制復雜且尚未明確。相關研究表明,外周血T淋巴細胞亞群在其中發揮了重要作用[7],其為臨床早期治療HSP患兒提供了依據。既往研究大多是關于HSP嚴重程度與輔助性T淋巴細胞(helper T lymphocytes,Th)變化的關系,尚未見與調節性T淋巴細胞(regulatory T lymphocytes,Treg)變化的相關研究。本研究對150例HSP患兒的一般資料和實驗室指標進行了數據分析,以進一步明確Th和Treg的變化與HSP嚴重程度的關系,為早期干預治療提供理論參考,從而避免和減緩病情的發展,改善患兒的預后。
1 研究對象與方法
1.1 研究對象
選擇2018年1月至2021年1月蘇州大學附屬兒童醫院收治的150例HSP患兒為研究對象,其中男87例,女63例;年齡為5~14歲,平均(9.50±1.40)歲;皮膚型56例,腹型35例,關節型17例,腎型24例,混合型18例。根據HSP癥狀積分[8]將患兒分為輕度組(<33分,50例)、中度組(33~67分,56例)、重度組(>67分,44例)。另選擇同期于門診進行體檢的150例健康兒童為對照組,其中男89例,女61例;年齡為5~14歲,平均(9.33±1.74)歲。
納入標準:①符合HSP診斷標準[9];②初次發病;③近2周內未使用過激素及其他免疫抑制劑治療。排除標準:①合并嚴重感染性疾病;②合并其他免疫系統性疾病;③合并心、肝、肺等重要臟器功能障礙。
本研究經蘇州大學附屬兒童醫院倫理委員會審批(批準號:20201112),患兒家屬均簽署知情同意書。
1.2 研究方法
1.2.1 資料的收集
收集患兒的年齡、性別、體質量指數(body mass index,BMI)、HSP類型、過敏原類型、首發癥狀、皮膚紫癜持續時間、HSP癥狀積分等臨床資料。
1.2.2 實驗室指標的測定
清晨空腹狀態下取肘靜脈血3mL,離心,血清保存于-80℃冰箱待檢。①采用全自動血液分析儀(Sysmex CS-5100)檢測外周血白細胞計數(white blood cell count,WBC)、C-反應蛋白(C-reactive protein,CRP)及D-二聚體(D-Dimer,D-D)水平;采用日立7600-010生化分析儀檢測血肌酐(serum creatinine,SCr)水平。②采用酶聯免疫吸附(enzyme-linked immunosorbent assay,ELISA)雙抗體夾心法檢測樣本血清中白細胞介素-21(interleukin-21,IL-21)、轉化生長因子β1(transforming growth factor β1,TGF-β1)、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)水平。③利用免疫比濁法(儀器ADVIA2400,西門子公司)測定血清中免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白M(immunoglobulin M,IgM)水平。④采用流式細胞儀(BD公司,美國)分析樣本T淋巴細胞亞群,分別取CD3-PC5、D8-PE、CD4-PE、CD19-Percp、CD11b-PE、CD5-APC鼠抗人單克隆抗體(BD公司,美國)各10μL,加入肝素抗凝血50μL,混勻后室溫暗處放置20min,分別加入紅細胞裂解液混勻,在流式細胞儀上計數5×104以上細胞,分別記錄Th(CD3+CD4+)、Treg(CD4+CD25+)的陽性率。
1.3 統計學方法
2 結果
2.1 各組兒童的臨床資料
輕度組、中度組、重度組、對照組兒童的年齡、性別、BMI比較差異均無統計學意義(P>0.05),具有可比性,見表1。
表1 各組兒童臨床資料的比較
2.2 不同病情程度HSP患兒的臨床癥狀
輕度組、中度組、重度組患兒皮膚紫癜持續時間>28d的比例比較差異有統計學意義(P<0.05),隨著HSP病情的加重,患兒皮膚紫癜持續時間>28d的比例有所增高;不同病情程度患兒HSP類型、過敏原類型(吸入性和食入性)及首發癥狀的比例比較差異均無統計學意義(P>0.05),見表2。
2.3 各組兒童的實驗室指標
輕度組、中度組、重度組、對照組兒童的WBC、CRP、D-D、IgA、CD3+CD4+、CD4+CD25+、IL-21、TGF-β1及TNF-α水平比較差異均有統計學意義(P<0.05),隨著HSP病情的加重,WBC、CRP、D-D、IgA、TGF-β1及TNF-α水平均有所升高,而CD3+CD4+、CD4+CD25+及IL-21水平均有所降低,組間兩兩比較差異均有統計學意義(P<0.05);輕度組、中度組、重度組、對照組兒童的SCr、IgG、IgM水平比較差異均無統計學意義(P>0.05);組間兩兩比較差異均有統計學意義(P<0.05),見表3。

表3 各組兒童實驗室指標的比較
2.4 曲線擬合及閾值效應分析
在調整年齡、性別、BMI后,經曲線擬合發現,隨著CD3+CD4+和CD4+CD25+水平的升高,HSP癥狀積分呈下降趨勢,見圖1。在曲線擬合的基礎上,進一步進行閾值效應分析發現,當CD3+CD4+>37.3%時,隨著CD3+CD4+水平升高,HSP癥狀積分未受影響,其OR=1.000(95%CI:0.991~1.015,P=0.368),當CD3+CD4+<37.3%時,隨著CD3+CD4+水平升高,HSP癥狀積分呈下降趨勢,其OR=0.962(95%CI:0.947~0.977,P<0.001);當CD4+CD25+>10.2%時,隨著CD4+CD25+水平升高,HSP癥狀積分未受影響,其OR=1.000(95%CI:0.998~1.003,P=0.347),當CD4+CD25+<10.2%時,隨著CD4+CD25+水平升高,HSP癥狀積分呈下降趨勢,其OR=0.976(95%CI:0.953~0.998,P<0.001)。
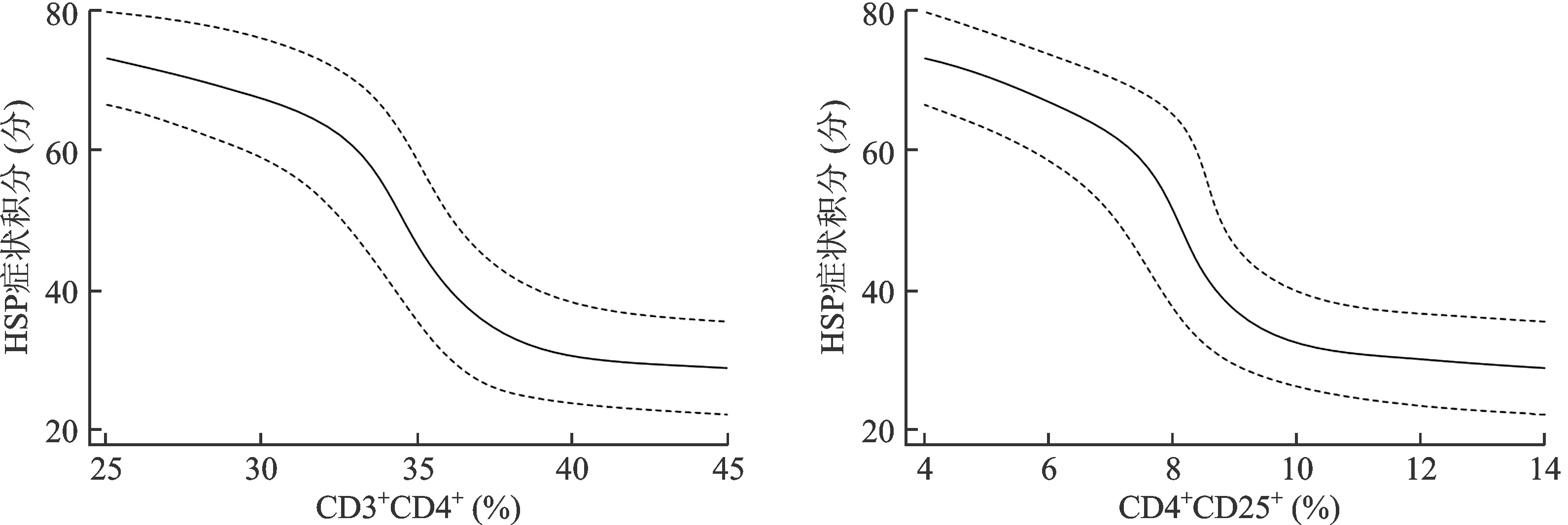
圖1 CD3+CD4+、CD4+CD25+與HSP癥狀積分的曲線擬合分析
2.5 影響HSP加重的多因素Logistic回歸分析
以前述分析中(表1~表3)差異具有統計學意義(P<0.05)的各項指標為自變量,以重度HSP為因變量,納入LASSO模型進行分析,最佳λ值通過交叉驗證法選擇,折疊10次。以λ的對數值為下方橫坐標,以進入模型的非零系數變量的個數為上方橫坐標,以標準誤為縱坐標,然后利用標準誤最小的λ值篩選用于構建LASSO回歸模型的因素,見圖2A;自變量系數隨λ值變化,λ值越大,模型壓縮程度越大,進入模型的自變量個數越少,模型的選擇功能越強,見圖2B。本研究選擇λ值為0.009時性能最優且納入變量最少,此時納入的變量包括CRP、D-D、IgA、CD3+CD4+、CD4+CD25+、IL-21、TGF-β1及TNF-α。

注:A圖為LASSO模型中最佳λ值的判定使用10折交叉驗證和最小準則;B圖為患兒臨床特征的LASSO模型系數曲線。
以LASSO模型分析中篩選出的8個非零特征預測因子為自變量,以重度HSP為因變量,進行多因素Logistic回歸分析,結果顯示,CRP>12.4mg/L、D-D>3.4mg/L、IgA>2.3g/L、TGF-β1≥6.5pg/mL及TNF-α≥14.5pg/mL均為發生重度HSP的獨立危險因素(P<0.05);CD3+CD4+≥32%、CD4+CD25+≥7%及IL-21≥23.1pg/mL均為獨立保護因素(P<0.05),見表4、表5。

表4 多因素Logistic回歸分析賦值表
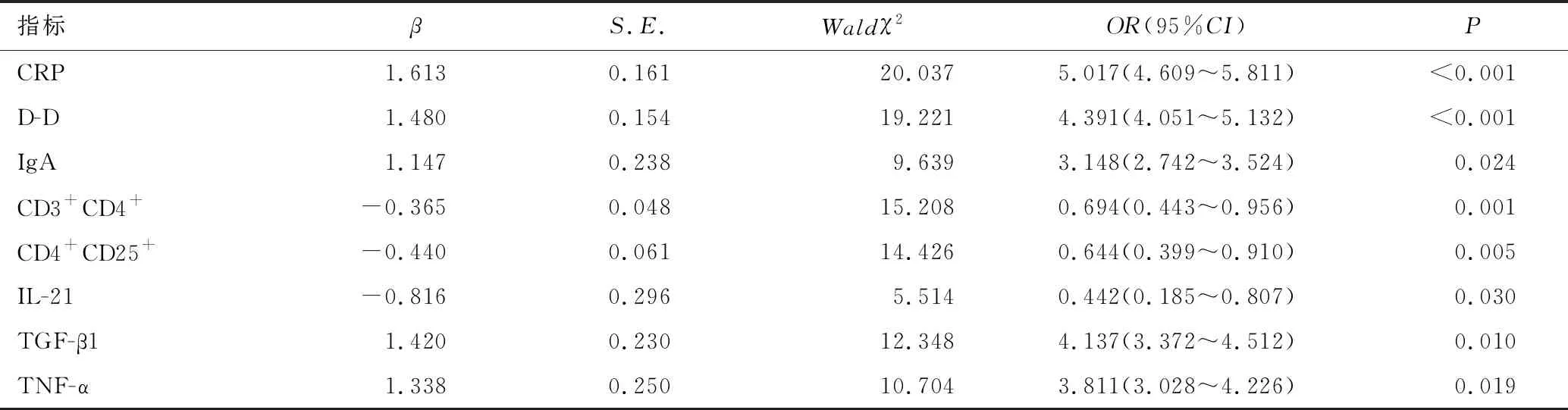
表5 多因素Logistic回歸分析
2.6 BP神經網絡模型的構建
將前述影響發生重度HSP的獨立危險因素作為輸入層納入BP神經網絡模型,采用反復交叉驗證確定隱含層節點數,當隱含層節點數為4時,交叉驗證的均方根誤差最小,見圖3;以HSP嚴重程度作為輸出層,構建BP神經網絡模型,見圖4。對BP神經網絡模型變量重要性評分進行排序,其中CRP(0.160分)、D-D(0.154分)、CD3+CD4+(0.135分)、CD4+CD25+(0.130分)對模型分類的貢獻度較高,IgA(0.100分)、IL-21(0.096分)、TGF-β1(0.114分)、TNF-α(0.111分)也能在一定程度上影響模型的分類結果。

圖3 交叉驗證確定隱含層節點數

圖4 BP神經網絡模型
2.7 BP神經網絡模型的評價
2.7.1 模型區分度的評價
采用Bootstrap自抽樣法進行內部驗證,結果顯示,該預測模型C-index為0.801(95%CI:0.714~0.888),ROC曲線下面積為0.820(95%CI:0.731~0.909),P<0.05,表明該預測模型的區分度尚可,見圖5。

圖5 BP神經網絡模型的ROC曲線
2.7.2 模型校準度的評價
繪制預測模型的校準曲線,結果顯示,模型預測重度HSP發生概率與實際概率擬合度良好,Hosmer-Lemeshow擬合優度檢驗結果差異無統計學意義(P>0.05),表明該預測模型的準確度較高,見圖6。
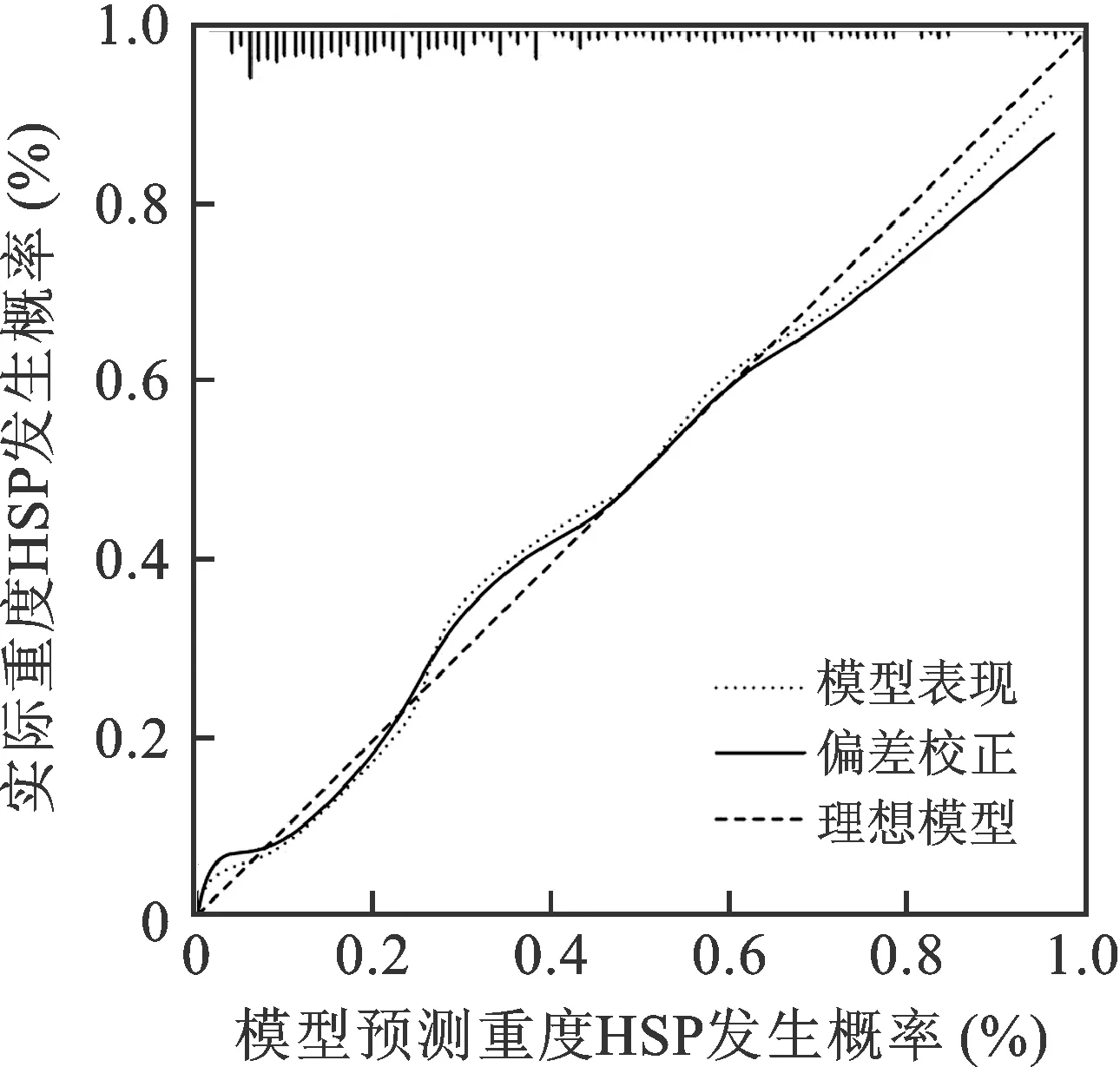
圖6 BP神經網絡模型的校準曲線
2.7.3 模型有效性的評價
預測模型的DCA曲線閾值概率為0.01~0.92,凈獲益率>0,表明其有效性較好,安全可靠,實用性強,見圖7。
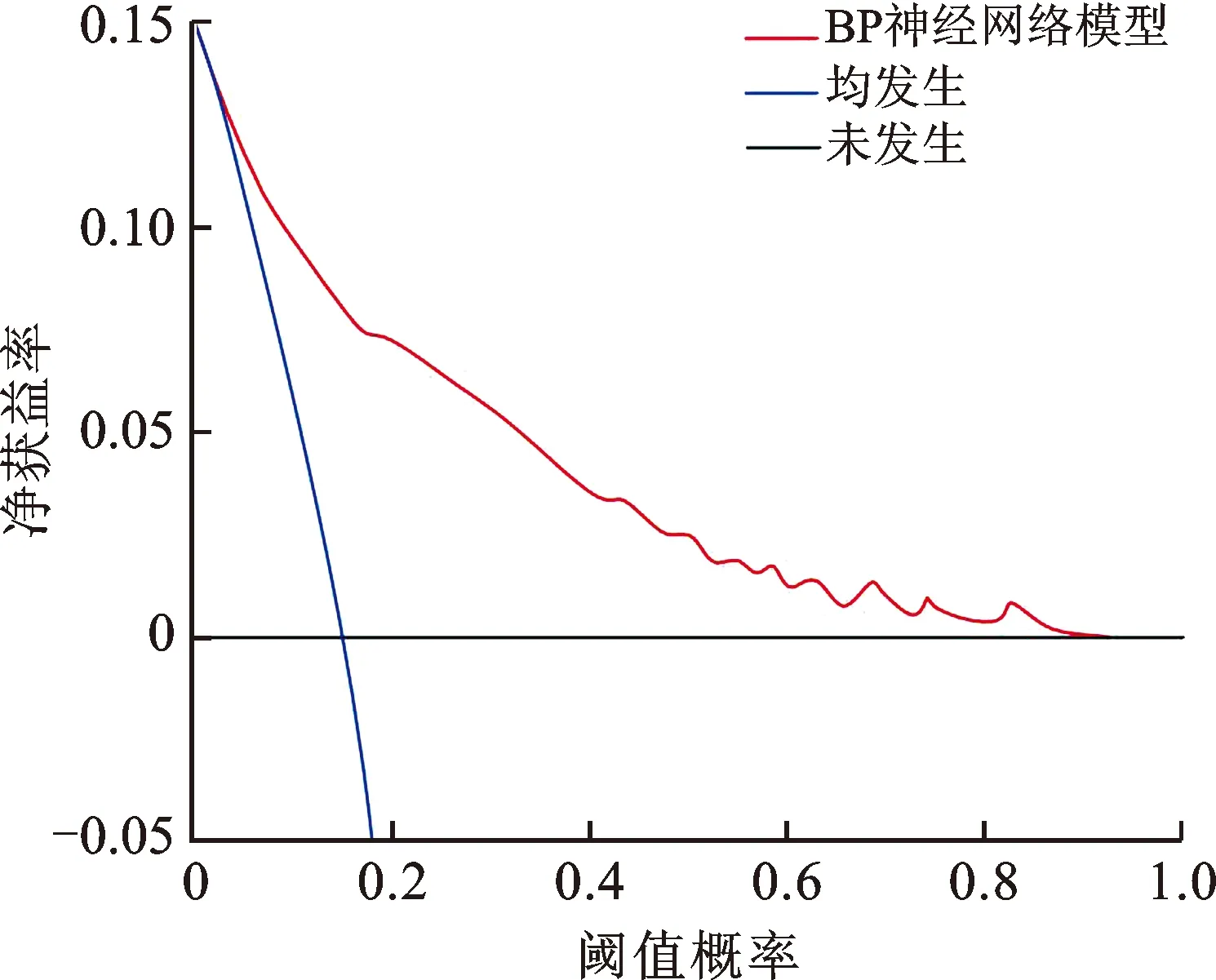
圖7 BP神經網絡模型的DCA曲線
3 討論
HSP發病呈全球性,不同區域和種族存在差異,學齡期高發,6~10歲的兒童約占90%[10-11]。近年來,HSP發病率逐年上升,首發癥狀一般為皮膚紫癜,嚴重的可引起各系統并發癥[12]。目前,臨床大多依靠患兒的臨床癥狀和體征進行診療,以及判斷疾病的活動性,尚缺乏明確性的實驗室診斷指標。因此,對于不典型癥狀者,易因誤診而延誤病情。隨著研究的深入,大多數學者認為HSP發病涉及T淋巴細胞亞群、細胞因子、凝血機制和炎性因子異常等情況,但主要發病機制仍是免疫應答介導的血管炎[13-14]。
3.1 HSP患兒的機體免疫和體液功能分析
相關研究表明,HSP發病與人類白細胞抗原和家庭性地中海基因密切相關,帶有上述基因的兒童,一旦受到致病因子侵襲,便會造成呼吸及黏膜系統損傷,激活T淋巴細胞亞群,進一步導致機體免疫和體液功能發生紊亂[15]。T淋巴細胞是機體免疫的核心部分,在抗原物質刺激下,可引起T淋巴細胞亞群失衡加重、免疫功能紊亂及組織炎性因子分泌失衡,產生相應抗體,使得血清中免疫球蛋白水平升高[16]。本研究顯示,隨著HSP患兒病情加重,IgA、TGF-β1、TNF-α水平均升高,IL-21水平降低,表明HSP病情加重,機體細胞和體液免疫系統紊亂。抗原進入黏膜,激發黏膜免疫系統產生免疫反應,從而使IgA增多。血清中清除IgA的可能機制為,肝細胞表面的脫唾液酸糖蛋白受體特異性識別并結合半乳糖基可清除IgA分子,而其低糖基化使得脫唾液酸糖蛋白受體減少,導致IgA增加。免疫系統紊亂使得組織炎性介質分泌失控,TNF-α為促炎性因子,參與發病過程,可能是HSP病理損傷的重要因素之一;TGF-β1為抑炎性因子,發揮免疫調節作用,二者相互制約和調節;而IL-21水平下降,表明T淋巴細胞分泌IL-21受到抑制,但IL-21分泌不足的機制有待進一步研究。
3.2 HSP患兒的CD3+CD4+和CD4+CD25+水平分析
相關研究表明,HSP的發病主要是由機體免疫功能紊亂所導致,在發病初期,患者存在顯著的免疫失衡[17]。高婧等[8]研究表明,隨著HSP病情加重,CD3+CD4+水平下降。本研究顯示,隨著HSP病情加重,CD3+CD4+、CD4+CD25+水平均降低,Th(CD3+CD4+)通過釋放細胞輔助因子促進效應T細胞活化,進而促使體液及細胞免疫作用調節或增強機體免疫功能,其減少表明患兒此刻機體免疫功能降低;Treg(CD4+CD25+)具有免疫抑制和調節的功能,是機體維持自身免疫耐受的重要組成部分,其減少會導致免疫抑制效應不足,這可能是HSP發病初期機體免疫失衡的重要原因。
3.3 HSP患兒的凝血功能和炎性因子水平分析
本研究顯示,D-D和CRP也是影響患兒病情程度的重要因素。D-D是凝血功能異常的重要指標,可表明是否存在血栓的形成,對HSP病情的評估具有十分重要的意義。CRP是一種急性時相蛋白,與急性感染、組織損傷、心血管疾病等密切相關;在發病急性期,血清中CRP水平迅速上升,病情緩解時,其水平又迅速下降,因此其常作為一種疾病活動時篩查指標。本研究表明,隨著HSP病情加重,D-D、CRP水平均升高。劉鈞菲等[18]研究顯示,D-D水平越高,HSP病情越重;其表明HSP患兒的血漿D-D水平與疾病發展密切相關,提示在臨床治療時,醫護人員應密切監測患兒的D-D水平,以判斷病情的進展情況。HSP屬毛細血管變態反應性疾病,炎癥常累及其他器官,如關節、腎臟等。當HSP病情加重,免疫功能失衡,肝細胞產生CRP且大量釋放進入血液,促進炎性因子TNF-α分泌,加強機體免疫功能。
基于多因素分析結果,本研究構建了BP神經網絡模型,當隱含層節點數為4時,誤差最小,其中CRP(0.160分)、D-D(0.154分)、CD3+CD4+(0.135分)、CD4+CD25+(0.130分)對模型分類的貢獻度較高。ROC曲線、校準曲線和DCA曲線顯示,該預測模型的區分度及準確性和有效性均較高。
3.4 本研究的局限性
本研究為回顧性分析,具有一定的局限性,納入病歷數目較少。但隨著醫療技術的發展,相信有針對性的前瞻性、大樣本量研究可為臨床治療HSP提供更高級別的醫學證據。
綜上所述,CD3+CD4+、CD4+CD25+水平異常變化與HSP癥狀積分密切相關,隨著患兒HSP病情進展,CD3+CD4+、CD4+CD25+水平明顯降低;CRP>12.4mg/L、D-D>3.4mg/L、IgA>2.3g/L、TGF-β1≥6.5pg/mL及TNF-α≥14.5pg/mL均為發生重度HSP的獨立危險因素,CD3+CD4+≥32%、CD4+CD25+≥7%及IL-21≥23.1pg/mL均為獨立保護因素。臨床醫護人員應密切關注相關指標,對HSP患兒做到早發現、早診治,改善其預后。

