氧化應激環境下LncRNA MALAT1 對內皮細胞TLR4/MyD88/NF-κB 信號通路的影響
紀海濤,趙穎馨,于錫巧,柴強,劉振東,張叢叢
隨著老齡化加重,動脈粥樣硬化(atherosclerosis,AS)的發病率逐年升高,其病變部位主要是血管壁[1]。血管內壁是由內皮細胞組成的,而內皮細胞在機體器官中廣泛分布[2];此外,其還可以充當血管壁的調劑器,釋放血管活性物質,調節血管的舒張與收縮[3]。AS的主要病因是內皮細胞對氧化低密度脂蛋白膽固醇(oxidized low density lipoprotein,ox-LDL)的調控失衡[4],而ox-LDL是氧化應激刺激低密度脂蛋白產生的,所以氧化應激是引發AS的重要因素。研究表明,Toll樣受體4(Toll-like receptor 4,TLR4)與AS的發生有關[5-6]。TLR4主要分布在內皮細胞表面,其被激活后可與髓樣分化因子88(myeloid differentiation factor 88,MyD88)結合,從而激活MyD88依賴的信號通路,進而促進核因子κB(nuclear factor-kappa B,NF-κB)的活化及促炎因子的釋放[7]。
近年來長鏈非編碼RNA(long chain non-coding RNA,LncRNA)持續受到學者們的關注,而長鏈非編碼RNA肺腺癌轉移相關轉錄物1(long chain non-coding RNA metastasis-associated lung adenocarcinoma tran 1,LncRNA MALAT1)作為LncRNA家族的一員,在細胞核中表達,具有高度保守性[8]。研究發現,LncRNA MALAT1在血管疾病中發揮作用,可以促進血管生成[9],并且可以保護發生氧化損傷的內皮細胞[10]。但目前LncRNA MALAT1與TLR4/MyD88/NF-κB信號通路的關系尚不清楚。為此,本研究使用過氧化氫(hydrogen peroxide,H2O2)誘導氧化應激細胞模型,然后探究氧化應激環境下LncRNA MALAT1對內皮細胞TLR4/MyD88/NF-κB信號通路的影響,以期為研究氧化應激導致AS等心血管疾病的機制提供依據。
1 材料與方法
1.1 實驗時間 本實驗時間為2022年10—12月。
1.2 實驗材料 人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVEC)由山東省醫學科學院提供;LncRNA MALAT1的小干擾RNA(small interfering RNA,siRNA)購自上海吉碼制藥技術有限公司:TLR4抗體購自美國Abcam公司;MyD88抗體、NF-κB抗體購自美國Cell Signaling Technology公司;Actin、LncRNA MALAT1、TLR4、MyD88、NF-κB的引物購自鉑尚生物技術(上海)有限公司;反轉錄試劑盒和q-PCR試劑盒購自蘇州近岸蛋白質科技股份有限公司;蛋白凝膠購自武漢博士德生物工程有限公司;CCK-8試劑購自MCE公司。
1.3 實驗方法
1.3.1 細胞培養 將HUVEC置于含5%胎牛血清、1%青霉素和鏈霉素的低糖DMEM培養液中,在37 ℃、5% CO2培養箱中培養2~3 d,待細胞貼壁且在培養皿中的覆蓋率達80%左右時進行實驗分組與處理。
1.3.2 H2O2誘導氧化應激細胞模型的最佳干預時間將HUVEC懸液接種在96孔板中(100 μl/孔),將培養板放在培養箱中預培養6~8 h,將其分為A、B、C、D組,分別使用600 μmol/L的H2O2處理0、6、8、10 h,隨后采用CCK-8法測定細胞活性,具體方法為:用PBS清洗掉殘留的培養液和H2O2,再向每孔加入10 μl CCK-8試劑與90 μl低糖DMEM培養液,將培養板置于培養箱內孵育1~4 h,采用酶標儀測定450 nm處的吸光度。以細胞活性為60%時的時間作為本實驗的最佳干預時間,實驗獨立重復3次。
1.3.3 q-PCR檢測LncRNA MALAT1表達水平 將密度為30×104/ml的HUVEC均勻接種至6孔板中,每孔加入2 ml,培養12 h,將其分為對照組(不做任何處理)、H2O2組(使用600 μmol/L的H2O2處理8 h以構建氧化應激細胞模型),采用q-PCR檢測LncRNA MALAT1表達水平,具體方法為:棄去培養基,用PBS清洗1遍,加入500 μl的Trizol以提取細胞中的總RNA,將總RNA吸出并移至EP管,加入200 μl雙重去離子水(double distilled water,ddH2O),放入常溫離心機進行離心,條件為6 720 r/min、15 min(離心半徑為6 cm);吸出上層清液(300~500 μl),加入等量異丙醇后再次離心,條件為6 720 r/min、10 min(離心半徑為6 cm);棄去液體,用75%乙醇溶液清洗,再次離心,條件為4 480 r/min、3 min(離心半徑為6 cm);棄去乙醇溶液后,加入ddH2O以溶解沉淀的LncRNA MALAT1。按照50 ℃ 15 min,75 ℃ 5 min的條件對提取出的LncRNA MALAT1進行反轉錄。以Actin為內參,使用PCR試劑盒對Actin、LncRNA MALAT1進行PCR擴增,加入0.4 μl上/下游引物、2.0 μl cDNA、10.0 μl PCR試劑,用ddH2O將總反應體系補齊到20.0 μl。PCR反應條件:94 ℃ 90 s,94 ℃ 20 s,57 ℃ 20 s,共30個循環;72 ℃ 5 min。Actin的上游引物序列為5'-GAAGAGCTACGAGCTGCCTGA-3',下游引物序列為5'-CAGACAGCACTGTGTTGGCG-3';Lnc RNA MALAT1 的上游引物序列為5'-GGATTCCAGGAAGGAGCGAG-3',下游引物序列為5'-ATTGCCGACCTCACGGATTT-3'。根據公式(ΔCt=Ct目的基因-Ct內參基因)計算LncRNA MALAT1表達水平。實驗獨立重復3次。
1.3.4 Western blot法檢測TLR4、MyD88、NF-κB表達水平 將密度為30×104/ml的HUVEC均勻接種至6孔板中,每孔加入2 ml,培養12 h,將其分為對照組(不做任何處理)、H2O2組(使用600 μmol/L的H2O2處理8 h以構建氧化應激細胞模型)、H2O2+siRNA組(轉染LncRNA MALAT1的siRNA后使用600 μmol/L的H2O2處理8 h以構建氧化應激細胞模型),采用Western blot法檢測TLR4、MyD88、NF-κB表達水平,具體方法為:棄去培養基,用PBS清洗1遍,加入200~300 μl RIPA裂解液和蛋白酶抑制劑的混合液(1∶100),于冰上孵育5~10 min,用刮刀將細胞刮離六孔板并轉移至EP管內,每個樣本進行超聲破碎3次,5 s/次;將其轉移到4 ℃的離心機中,12 000 r/min離心15 min(離心半徑為6 cm);用移液槍吸取上清液,采用BCA法測量蛋白濃度,加入5×Buffer(與提取蛋白樣本量的比例為1∶4),置于干式恒溫器煮蛋白(100 ℃ 10 min);添加10~15 μl的樣品并將其置于蛋白凝膠中電泳1 h,電壓保持在80 V;將蛋白轉移到PVDF膜,轉模方式為濕轉,時間1 h,電壓保持在100 V;將含有蛋白的PVDF膜用5%脫脂奶粉封閉90 min;用1×TBST清洗3次,5 min/次;加入TLR4、MyD88、NF-κB抗體(稀釋比例分別為1∶500、1∶1 000、1∶1 000),于4 ℃孵育6~8 h;于室溫下用1×TBST清洗3次,5 min/次;用相應種屬二抗孵育1 h(稀釋比例為1∶5 000),用1×TBST清洗3次,5 min/次;進行蛋白顯影,分析目標蛋白表達水平。實驗獨立重復3次。
1.3.5 q-PCR檢測TLR4、MyD88、NF-κB mRNA表達水平 將密度為30×104/ml的HUVEC均勻接種至6孔板中,每孔加入2 ml,培養12 h,將其分為對照組(不做任何處理)、H2O2組(使用600μmol/L的H2O2處理8 h以構建氧化應激細胞模型)、H2O2+siRNA組(轉染LncRNA MALAT1的siRNA后使用600 μmol/L的H2O2處理8 h以構建氧化應激細胞模型),采用q-PCR檢測TLR4、MyD88、NF-κB mRNA表達水平,方法同1.3.3。TLR4的上游引物序列為5'-TGGATCAAGGACCAGAGGCA-3',下游引物序列為5'-GAGGACCGACACACCAATGA-3';MyD88的上游引物序列為5'-AAGCGACTGATCCCCATCAAG-3',下游引物序列為5'-TCGCAGACAGTGATGAACCTC-3';NF-κB 的上游引物序列為5'-TCTTTGACAAT CGTGCCCCC-3',下游引物序列為5'-CAGCCIGGTC CCGTGAAATA-3'。
1.4 統計學方法 采用SPSS Statistics 26軟件進行數據分析。計量資料以(±s)表示,兩組間比較采用成組t檢驗,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 H2O2誘導氧化應激細胞模型的最佳干預時間 A、B、C、D組細胞活性分別為(1.00±0.00)、(0.77±0.05)、(0.61±0.09)、(0.52±0.04)。四組細胞活性比較,差異有統計學意義(F=40.08,P=0.001);B、C、D組細胞活性均低于A組,差異有統計學意義(P<0.05)。C組細胞活性最接近60%,故H2O2誘導氧化應激細胞模型的最佳干預時間為8 h。
2.2 對照組與H2O2組LncRNA MALAT1表達水平比較H2O2組LncRNA MALAT1表達水平為(0.76±0.25),低于對照組的(1.28±0.38),差異有統計學意義(t=2.776,P=0.020)。
2.3 對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB表達水平比較 對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB表達水平比較,差異有統計學意義(P<0.05);H2O2+siRNA組TLR4、MyD88、NF-κB表達水平高于對照組,差異有統計學意義(P<0.05);H2O2+siRNA組MyD88、NF-κB表達水平高于H2O2組,差異有統計學意義(P<0.05),見表1、圖1。

圖1 Western blot法檢測對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB表達水平的電泳圖Figure 1 Electropherogram of TLR4,MyD88 and NF-κB expression levels in control group,H2O2 group and H2O2+siRNA group detected by Western blot method
表1 對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB表達水平比較(±s,n=3)Table 1 Comparison of expression levels of TLR4,MyD88,NF- κB in control group,H2O2 group,H2O2+siRNA group
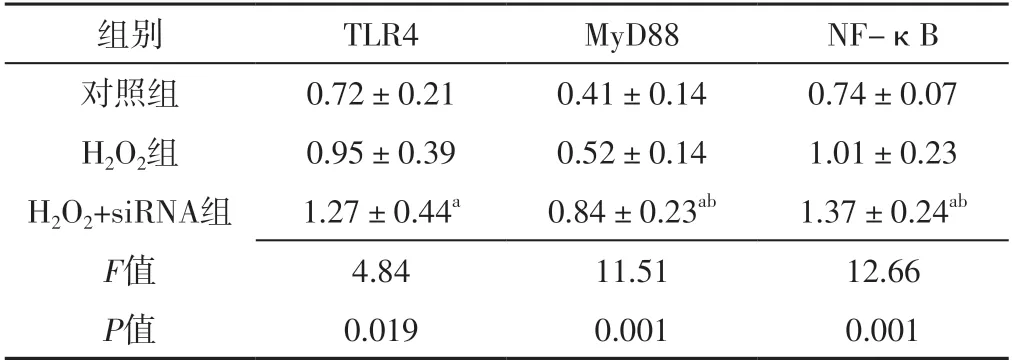
表1 對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB表達水平比較(±s,n=3)Table 1 Comparison of expression levels of TLR4,MyD88,NF- κB in control group,H2O2 group,H2O2+siRNA group
注:H2O2=過氧化氫,siRNA=小干擾RNA,TLR4=Toll樣受體4,MyD88=髓樣分化因子88,NF-κB=核因子κB;a表示與對照組比較,P<0.05;b表示與H2O2組比較,P<0.05
組別TLR4MyD88NF-κB對照組0.72±0.210.41±0.140.74±0.07 H2O2組0.95±0.390.52±0.141.01±0.23 H2O2+siRNA組1.27±0.44a0.84±0.23ab1.37±0.24ab F值4.8411.5112.66 P值0.0190.0010.001
2.4 對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB mRNA表達水平比較 對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB mRNA表達水平比較,差異有統計學意義(P<0.05);H2O2組TLR4、MyD88 mRNA表達水平高于對照組,差異有統計學意義(P<0.05);H2O2+siRNA組TLR4、MyD88、NF-κB mRNA表達水平高于對照組、H2O2組,差異有統計學意義(P<0.05),見表2。
表2 對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB mRNA表達水平比較(±s,n=3)Table 2 Comparison of mRNA expression levels of TLR4,MyD88,NFκB in control group,H2O2 group,H2O2+siRNA group
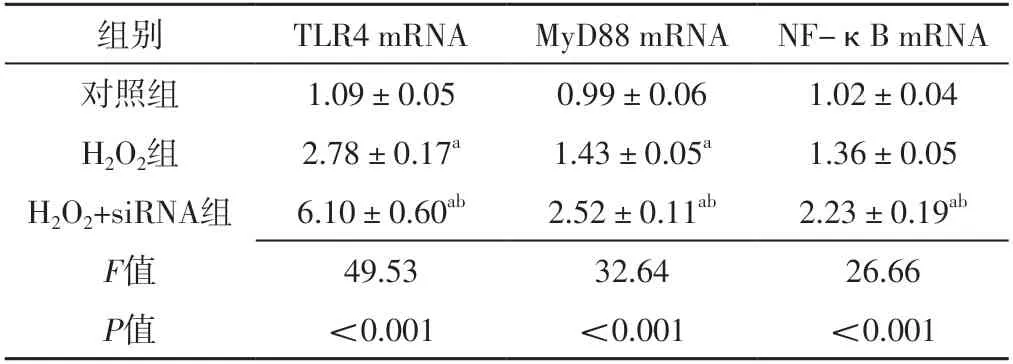
表2 對照組、H2O2組、H2O2+siRNA組TLR4、MyD88、NF-κB mRNA表達水平比較(±s,n=3)Table 2 Comparison of mRNA expression levels of TLR4,MyD88,NFκB in control group,H2O2 group,H2O2+siRNA group
注:a表示與對照組比較,P<0.05;b表示與H2O2組比較,P<0.05
組別TLR4 mRNAMyD88 mRNA NF-κB mRNA對照組1.09±0.050.99±0.061.02±0.04 H2O2組2.78±0.17a1.43±0.05a1.36±0.05 H2O2+siRNA組6.10±0.60ab2.52±0.11ab2.23±0.19ab F值49.5332.6426.66 P值<0.001<0.001<0.001
3 討論
AS是目前比較常見的心血管疾病,能夠導致血管內膜結構與功能發生變化,管壁增厚是其主要病理特點[1]。氧化應激是導致AS發生發展的主要因素之一,當內皮細胞受到氧化應激的刺激后,會引起低密度脂蛋白發生氧化,刺激黏附因子表達,導致細胞黏附性增加及細胞聚集,其還會促進NO的釋放,造成血管功能障礙[11]。同時,慢性炎癥也是造成AS加重的主要原因,研究表明,TLR4/MyD88/NF-κB信號通路在AS的炎癥反應中發揮著重要作用,其中MyD88作為TLR4的銜接蛋白,起著關鍵的信號轉導功能,其在接收到TLR4信號后可激活NF-κB[12]。
本研究構建氧化應激細胞模型前,首先探索合適的誘導條件。氧化應激細胞模型的誘導手段有很多,本研究選擇H2O2,因為其應用較廣泛,作用直接,性質穩定[13]。本研究結果顯示,B、C、D組細胞活性均小于A組,且C組細胞活性最接近60%,故H2O2誘導氧化應激細胞模型的最佳干預時間為8 h。
LncRNA MALAT1定位于染色體11q13.1上,首次在非小細胞肺癌中被發現,其可以調控細胞增殖,影響腫瘤的發生[14]。研究顯示,抑制LncRNA MALAT1可促進乳腺癌模型小鼠癌細胞遷移[15]。同時,LncRNA MALAT1在氧化應激引發的心血管疾病中也能發揮一定作用。LI等[16]研究發現,心肌梗死患者LncRNA MALAT1表達水平升高,LncRNA MALAT1可能成為預測心肌梗死的標志物。有研究者在高脂飲食誘導的AS模型小鼠中發現,過表達LncRNA MALAT1可以通過ox-LDL來調控Wnt/β環,從而促進AS的發生[17]。本研究結果顯示,H2O2組LncRNA MALAT1表達水平低于對照組,與CHEN等[18]研究結果類似,該研究表明,靶向敲除LncRNA MALAT1后小鼠心臟微血管內皮細胞的氧化應激反應更加劇烈。但本研究結果與RADHAKRISHNAN等[19]研究結果不同,可能是所用細胞系及干預方式不同導致的,RADHAKRISHNAN等[19]選擇的細胞系為視網膜內皮細胞,且使用高糖誘導氧化應激。
有研究者采用脂多糖誘導小鼠心肌細胞氧化應激,結果顯示,心肌細胞中TLR4、MyD88、NF-κB表達水平升高[20]。研究顯示,在中樞神經系統中,抑制小膠質細胞TLR4、MyD88、NF-κB的表達,可以減輕氧化應激,進而抑制神經元凋亡[21]。本研究結果顯示,H2O2+siRNA組TLR4、MyD88、NF-κB表達水平高于對照組,MyD88、NF-κB表達水平高于H2O2組;H2O2組TLR4、MyD88 mRNA表達水平高于對照組,H2O2+siRNA組TLR4、MyD88、NF-κB mRNA表達水平高于對照組、H2O2組;提示在氧化應激環境下,LncRNA MALAT1表達水平降低,進而導致TLR4/MyD88/NF-κB信號通路被激活,這與既往研究結果[22]類似。但本研究結果與JIA等[23]研究結果存在差異,可能是采用的細胞和模擬的病理環境不同導致的,JIA等[23]使用人心肌細胞模擬心肌炎,結果顯示,下調LncRNA MALAT1可抑制TLR4/MyD88/NF-κB信號通路的激活。
綜上所述,氧化應激環境下,LncRNA MALAT1表達水平降低,進而導致內皮細胞TLR4/MyD88/NF-κB信號通路被激活,這為預防和治療AS提供了新的理論依據。但本研究為細胞實驗,且未進行動物實驗,后期尚需要進行動物實驗進一步驗證本研究結論。此外,LncRNA MALAT1與多種微小RNA有關,SUN等[24]研究發現,LncRNA MALAT1與miR-503位點結合后可抑制下游JAK2/STAT3信號通路的激活,本研究組后續會對此展開研究。
作者貢獻:紀海濤進行文章的撰寫、數據分析;趙穎馨、柴強、劉振東進行文章的構思與設計;于錫巧、張叢叢進行文獻的收集與整理;趙穎馨進行文章的質量控制及審校,并對文章整體負責、監督管理。
本文無利益沖突。

