基于Notch信號通路研究白頭翁湯對潰瘍性結腸炎小鼠腸黏液屏障的保護作用
劉 偉,劉又前,蔣翠花,張東建,方雨夕,龔 旻,李寅慶,王甜甜,張 健1, , 3*
基于Notch信號通路研究白頭翁湯對潰瘍性結腸炎小鼠腸黏液屏障的保護作用
劉 偉1, 3,劉又前2,蔣翠花1, 3,張東建1, 3,方雨夕1, 3,龔 旻1, 4,李寅慶5,王甜甜5,張 健1, 2, 3*
1. 南京中醫(yī)藥大學第三臨床醫(yī)學院,江蘇 南京 210028 2. 南京市溧水區(qū)中醫(yī)院,江蘇 南京 211200 3. 南京中醫(yī)藥大學附屬中西醫(yī)結合醫(yī)院,江蘇 南京 210028 4. 中國藥科大學中藥學院,江蘇 南京 210009 5. 河北御芝林藥業(yè)有限公司,河北 石家莊 050000
探討白頭翁湯對葡聚糖硫酸鈉(dextran sodium sulfate,DSS)誘導的潰瘍性結腸炎(ulcerative colitis,UC)小鼠腸黏液屏障的保護作用以及對Notch通路的影響。C57BL/6小鼠隨機分為對照組、模型組、美沙拉嗪(50 mg/kg)組和白頭翁湯低、高劑量(7.4、14.8 g/kg)組,對照組小鼠自由飲用純凈水,其余各組連續(xù)8 d自由飲用2.5% DSS溶液誘導UC模型,造模同時各給藥組ig相應藥物。每日記錄小鼠體質(zhì)量、糞便稠度以及血便情況;采用蘇木素-伊紅(HE)染色觀察結腸組織病理變化;采用AB-PAS染色觀察結腸組織黏蛋白2(mucin 2,MUC2)的分泌情況;ELISA法檢測結腸組織中髓過氧化物酶(myeloperoxidase,MPO)活性及促炎因子白細胞介素-6(interleukin-6,IL-6)、IL-1β、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和抗炎因子IL-10的含量;免疫組化法檢測結腸組織Ki67的表達情況;免疫熒光法測定結腸組織富含亮氨酸重復序列的G蛋白偶聯(lián)受體5(leucine-rich repeat-containing G-protein-coupled receptor 5,Lgr5+)腸道干細胞(intestinal stem cells,ISCs)陽性細胞數(shù);Western blotting測定結腸組織Notch-1、Atoh1、Hes1和MUC2蛋白表達。與模型組比較,白頭翁湯能夠緩解DSS誘導的UC小鼠體質(zhì)量降低和疾病活動指數(shù)(disease activity index,DAI)升高(<0.05、0.01、0.001),緩解結腸組織的縮短、水腫以及病理學損傷(<0.01、0.001),減少炎性細胞浸潤、隱窩的破壞與杯狀細胞的丟失,降低結腸組織MPO活性和IL-1β、TNF-α水平(<0.05、0.01),升高IL-10水平(<0.05),增加結腸組織Ki67陽性細胞數(shù)(<0.01),促進MUC2的分泌和Lgr5+ISCs的陽性細胞數(shù),并下調(diào)Notch和Hes-1蛋白表達水平(<0.05、0.001),上調(diào)Atoh1和MUC2蛋白表達水平(<0.05、0.01)。白頭翁湯能夠降低UC小鼠結腸組織促炎細胞因子水平,增加Lgr5+ISCs的增殖和分化,保護隱窩和杯狀細胞結構,促進MUC-2分泌,其作用可能與調(diào)控Notch-1/Atoh1/ Hes1通路密切相關。
白頭翁湯;潰瘍性結腸炎;腸道干細胞;黏液屏障;Notch通路;白頭翁皂苷B4;黃柏堿;小檗堿;表小檗堿;黃連堿;巴馬汀;秦皮甲素;秦皮乙素
潰瘍性結腸炎(ulcerative colitis,UC)是一種腸道炎癥性疾病,通常從直腸黏膜開始,連續(xù)性地延伸至近端結腸,最終累及整個結腸,其臨床癥狀主要為里急后重、腹痛、血性腹瀉[1]。在過去的10年中,全球UC的發(fā)病率顯著上升,同時數(shù)據(jù)表明長期感染UC的患者更容易患結腸癌的風險[2-5]。目前臨床上治療UC的主要藥物為氨基水楊酸鹽類和免疫抑制劑,但由于癥狀容易持續(xù)復發(fā),長期的治療會產(chǎn)生嚴重的不良反應[6]。因此迫切需要尋找療效顯著、不良反應小的藥物用于臨床治療。
目前UC的病因尚未闡明清楚,但諸多證據(jù)表明,黏液屏障功能障礙與UC的發(fā)生發(fā)展密切相關[7-8]。黏液屏障作為抵御腸上皮細胞和腸腔細菌直接接觸的第一道屏障,可以有效地將腸上皮細胞與腸腔內(nèi)容物隔離,保護上皮細胞免受腸道細菌和病原體的侵襲。腸道杯狀細胞分泌的黏蛋白2(mucin 2,MUC2)是構成黏液屏障最主要的成分[9-10]。杯狀細胞由富含亮氨酸重復序列的G蛋白偶聯(lián)受體5(leucine-rich repeat-containing G-protein-coupled receptor 5,Lgr5+)腸道干細胞(intestinal stem cells,ISCs)分化而來,Notch信號被報道在調(diào)控腸道干細胞的增殖和分化中起重要作用[11]。當Notch過度激活時,會限制Lgr5+腸道干細胞向杯狀細胞的分化,削弱黏液屏障[12]。
1 材料
1.1 動物
SPF級雄性C57BL/6J小鼠40只,6~8周齡,體質(zhì)量18~22 g,購自斯貝福(北京)生物技術有限公司,合格證號SCXK(京)2019-0010。動物在標準的實驗室條件下飼養(yǎng),溫度(25±3)℃,相對濕度(53±3)%,12 h明暗光周期,自由進食飲水,適應性飼養(yǎng)7 d后開始實驗。動物實驗方案符合倫理規(guī)定,并經(jīng)江蘇省中醫(yī)藥研究院倫理委員會批準(批準號AEWC-20210810-163)。
1.2 藥材
白頭翁(江蘇亞邦中藥飲片有限公司,批號20042901)、黃柏(貴州同德藥業(yè)有限公司,批號20210302-01)、黃連(亳州市萬珍中藥飲片廠,批號2104005)、秦皮(江蘇同濟中藥飲片有限公司,批號191210)購自南京中醫(yī)藥大學附屬中西醫(yī)結合醫(yī)院中藥房,并經(jīng)江蘇省中醫(yī)藥研究院錢士輝研究員鑒定分別為毛茛科植物白頭翁(Bge.) Regel的干燥根、蕓香科植物黃皮樹Schneid的干燥樹皮、毛茛科植物黃連Franch的干燥根莖以及木犀科植物苦櫪白蠟樹Hance的干燥枝皮。
1.3 藥品與試劑
DSS(相對分子質(zhì)量36 000~50 000,批號160110)購自美國MP Biomedicals公司;美沙拉嗪腸溶片(批號2021125)購自葵花藥業(yè)集團;4%多聚甲醛(批號G1101-500ML)購自武漢賽維爾生物科技有限公司;小鼠白細胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-10、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、髓過氧化物酶(myeloperoxidase,MPO)試劑盒(批號分別為MB-2776A、MB-2899A、MB-2912A、MB-2868A、MB-3074A)購自江蘇酶標生物有限公司;β-actin抗體(批號AF5003)、HRP標記的山羊抗兔二抗(批號A0208)、一抗稀釋液(批號P0023A)、二抗稀釋液(批號P0023D)、10%十二烷基硫酸鈉-聚丙烯酰胺凝膠、TEMED、1 mol/L Tris-HCl(pH 8.8)、1 mol/L Tris-HCl(pH 6.8)、30% Acr-Bis(批號分別為ST628、ST728、ST788、ST768、ST003)購自上海碧云天生物科技有限公司;Notch抗體(批號ab52627)購自美國Abcam公司;Atoh1抗體(批號21215-1-AP)、MUC2抗體(批號27675-1-AP)購自美國Proteintech公司;Hes1抗體(批號GTX108356)購自美國Genetex公司;Ki67抗體(批號ab16667)購自英國Abcam公司;Lgr5抗體(批號A10545)購自武漢愛博泰克生物技術有限公司;對照品白頭翁皂苷B4(批號111766-202103,質(zhì)量分數(shù)99.8%)、鹽酸小檗堿(批號110713-202015,質(zhì)量分數(shù)85.9%)、鹽酸黃柏堿(批號111895-201805,質(zhì)量分數(shù)94.9%)、秦皮乙素(批號110741-202109,質(zhì)量分數(shù)99.9%)、秦皮甲素(批號110740-201806,質(zhì)量分數(shù)92.4%)購自中國食品藥品檢定研究院。
1.4 儀器
MS203DU型電子天平(瑞士Mettler Toledo公司);SynergyH1型酶聯(lián)免疫檢測儀(美國Bio Tek 公司);Hei-VAP Ultimate旋轉(zhuǎn)蒸發(fā)儀(德國Heidolp公司);GMBH37081型倒置光學顯微鏡(德國Carl Zeiss公司);SCIENTZ-48型高通量組織研磨儀(寧波新芝生物科技股份有限公司);SPE10-0111型Western blotting熒光成像儀(美國Azure Biosystem公司);WGH201型超純水系統(tǒng)(日本Yamato Scientific公司);690BR028786型半干轉(zhuǎn)系統(tǒng)、552BR206289型電泳槽、043BR68680型電泳電源(美國Bio-Rad公司);Heraeus Megafuge 8R型高速冷凍離心機(美國Thermo Fisher Scientific公司);JJ-12J型脫水機、JB-P5型包埋機(武漢俊杰電子有限公司);RM2016型病理切片機(上海徠卡儀器有限公司);KD-P型組織攤片機(浙江省金華市科迪儀器設備有限公司);Alltima C18色譜柱(250 mm×4.6 mm,5 μm)、Waters e2695型高效液相色譜儀(美國Waters公司)。
2 方法
2.1 藥物的制備
2.1.1 DSS的配制 用電子天平稱取DSS 25 g,溶解于1 L超純水中,超聲配成2.5% DSS溶液。
2.1.2 白頭翁湯的制備 白頭翁湯由白頭翁15 g、黃柏9 g、黃連9 g、秦皮9 g組成,稱取白頭翁、黃柏、黃連、秦皮藥材飲片,第1次加10倍量的純凈水煎煮,第2次8倍量的純凈水煎煮,每次40 min,合并藥液并濾去藥渣,隨后置于旋轉(zhuǎn)蒸發(fā)儀中,按給藥劑量濃縮至1.48 g/mL,于4 ℃冰箱保存?zhèn)溆谩⒄彰绹称匪幤繁O(jiān)督管理局給出的人體常規(guī)用量和小鼠折算系數(shù)12.3,按照體表面積進行小鼠等量劑量換算作為低劑量組的治療劑量,即7.4 g/kg。根據(jù)《中國藥典》2020年版含量測定的方法,采用高效液相色譜分別測定主要成分的含量,白頭翁中白頭翁皂苷B4的質(zhì)量分數(shù)為4.72%,黃柏中黃柏堿、小檗堿的質(zhì)量分數(shù)分別為0.38%、4.11%,黃連中小檗堿、表小檗堿、黃連堿、巴馬汀的質(zhì)量分數(shù)分別為6.36%、1.04%、1.83%、1.59%,秦皮中秦皮甲素、秦皮乙素的質(zhì)量分數(shù)分別為1.06%、0.17%。
US-FANC技術的核心是病理結果判定。病理科細胞學診斷經(jīng)驗不足一直是制約該項技術開展的主要原因,故US-FANC結果需病理科醫(yī)師和外科醫(yī)師共同判斷、解讀,共同積累診斷經(jīng)驗[12]。
2.2 動物分組、造模和給藥
小鼠適應性喂養(yǎng)1周后,隨機分為對照組、模型組、美沙拉嗪(50 mg/kg[17-18])組和白頭翁湯低、高劑量(7.4、14.8 g/kg)組,每組8只。對照組每天自由飲用純凈水,模型組和各給藥組連續(xù)8 d自由飲用2.5% DSS溶液,造模同時各給藥組ig相應藥物。
2.3 樣本的收集和處理
給藥結束后,于第9天用毛細管玻璃扎入小鼠的眼眶內(nèi)眥靜脈叢,快速旋轉(zhuǎn)進入,采用1.5 mL滅菌的EP管收集血液,室溫靜置2 h,4000 r/min離心15 min取血清,儲存于?80 ℃冰箱中。取血后,立即頸椎脫位處死小鼠,分離盲腸至直腸部位的結腸,對分離后的結腸組織進行拍照,再用預冷的生理鹽水沖洗干凈后,將收集到的結腸組織分成2部分,剪取1 cm的結腸遠端部分別放入4%多聚甲醛和卡諾氏固定溶液[(無水乙醇-氯仿-冰醋酸(6∶3∶1)]中進行固定,用于病理學染色,其余結腸組織轉(zhuǎn)移至?80 ℃的冰箱中儲存用于后續(xù)實驗。
2.4 疾病活動指數(shù)(disease activity index,DAI)評分
每日觀察小鼠活動狀態(tài),稱定體質(zhì)量,觀察糞便性狀以及有無便血情況,按照表1標準進行DAI評分[19-20]。
表1 DAI評分標準
Table 1 DAI score standard
評分體質(zhì)量下降率(x)糞便稠度直腸出血 00<x≤1%正常正常 11%<x≤5%松散,半成形糊狀隱血呈陽性 25%<x≤10%松散明顯,基本不成形隱血呈強陽性 310%<x≤20%稀水樣便肉眼血便 4>20%稀便更加明顯血便更加明顯
2.5 結腸組織蘇木素-伊紅(HE)和AB-PAS染色
2.5.1 HE染色 取小鼠結腸組織,使用4%多聚甲醛固定,隨后進行石蠟包埋、切片、脫蠟、水化后,用HE染色,使用倒置顯微鏡觀察拍照后進行組織病理學觀察。
2.5.2 AB-PAS染色 取小鼠結腸組織,使用卡諾氏固定液固定,隨后進行石蠟包埋、切片、脫蠟、用AB-PAS染色后,使用倒置顯微鏡觀察拍照后觀察杯狀細胞的結構和數(shù)量、黏液層厚度和分泌情況,中性黏液為紅色,酸性黏液呈藍色,中性和酸性混合黏液呈紫色。
2.6 脾臟指數(shù)和結腸長度
DSS誘導的UC小鼠模型表現(xiàn)為結腸長度的縮短,同時過度的炎癥反應會導致脾臟質(zhì)量增大。按照動物倫理相關要求對小鼠處死后,取出肛門至盲腸末端的結腸,PBS沖洗后用直尺測量長度。小心剝離脾臟,濾紙吸去血液后稱定質(zhì)量,記錄并計算脾臟指數(shù)。
脾臟指數(shù)=脾臟濕質(zhì)量/體質(zhì)量
2.7 ELISA法檢測結腸組織中炎癥因子水平
取各組小鼠結腸組織,加入PBS,用勻漿器勻漿,3000 r/min離心20 min,收集上清,按試劑盒說明書測定促炎因子IL-6、IL-1β、TNF-α及抗炎因子IL-10含量和MPO活性。
2.8 免疫組化法檢測結腸組織中Ki67蛋白表達
各組小鼠結腸組織石蠟切片脫蠟至水,3%過氧化氫封閉10 min,EDTA抗原修復緩沖液(pH 9.0)微波輻射進行修復,牛血清白蛋白封閉后,滴加Ki67抗體,4 ℃孵育過夜;滴加二抗,37 ℃孵育30 min,加入DAB顯色劑,顯色完全后,自來水沖洗,蘇木素復染,1%鹽酸乙醇分化,自來水沖洗,氨水返藍,流水沖洗,脫水封片。在顯微鏡下觀察,用Image J軟件定量分析陽性細胞數(shù)。
2.9 免疫熒光法檢測結腸組織中Lgr5+ ISCs數(shù)
取各組小鼠結腸組織石蠟切片脫蠟至水,加入EDTA抗原修復緩沖液(pH 8.0),于微波爐進行抗原修復,隨后加入自發(fā)熒光淬滅劑5 min,流水沖洗10 min,加入牛血清白蛋白孵育30 min,滴加Lgr5抗體,4 ℃孵育過夜。洗滌后,滴加二抗,DAPI復染細胞核,封片,在熒光倒置顯微鏡下觀察并拍照。DAPI紫外激發(fā)波長330~380 nm,發(fā)射波長420 nm,發(fā)藍光;FITC激發(fā)波長465~495 nm,發(fā)射波長515~555 nm,發(fā)綠光。
2.10 Western blotting檢測結腸組織中Notch、Atoh1、MUC2和Hes1蛋白表達
取各組小鼠結腸組織,加入含有1% PMSF的預冷的RIPA裂解緩沖液,勻漿后,4 ℃、12 000 r/min離心15 min,收集上清液。用BCA法測定蛋白濃度。蛋白樣品經(jīng)10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉(zhuǎn)至PVDF膜,用5%脫脂牛奶室溫封閉2 h,分別加入一抗(1∶1000),4 ℃孵育過夜;TBST洗膜4次,每次8 min,加入二抗(1∶1000),室溫孵育2 h,TBST洗膜后,加入ECL化學發(fā)光液顯影,用Image J軟件進行灰度分析。
2.11 統(tǒng)計學分析
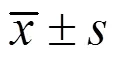
3 結果
3.1 白頭翁湯對UC小鼠DAI評分和體質(zhì)量的影響
對照組小鼠毛發(fā)光滑,黑亮光澤明顯,飲水飲食正常,體質(zhì)量呈平穩(wěn)的上升趨勢,活動狀態(tài)良好,糞便呈緊實棕黃色,無腹瀉、血便等。模型組小鼠在自由飲用2.5% DSS 3 d后,出現(xiàn)倦怠懶動、精神萎靡、毛發(fā)凌亂、食欲減弱現(xiàn)象,隨著時間的增加,DAI評分顯著增加(<0.001,圖1-A),體質(zhì)量顯著下降(<0.001,圖1-B),出現(xiàn)大量稀水樣鮮紅糞便。給予白頭翁湯和美沙拉嗪治療后,小鼠癥狀均較模型組有所改善,DAI評分明顯降低(<0.01、0.001),體質(zhì)量明顯升高(<0.05、0.01)。
3.2 白頭翁湯對UC小鼠脾臟指數(shù)和結腸長度的影響
對照組結腸組織腸壁紋理清晰,黏膜光滑,顏澤棕黃,無紅色充血潰瘍,無黏連。如圖2所示,與對照組比較,模型組小鼠結腸長度顯著縮短(<0.001),脾臟指數(shù)明顯升高(<0.001),且結腸色澤呈現(xiàn)黑紅色。給予白頭翁湯和美沙拉嗪治療后,小鼠結腸長度顯著增加(<0.01、0.001);白頭翁湯低劑量組和美沙拉嗪組小鼠脾臟指數(shù)均明顯降低(<0.05)。
3.3 白頭翁湯對UC小鼠結腸組織病理的影響
如圖3所示,對照組小鼠結腸黏膜上皮完整、隱窩結構正常、固有層腺體呈整齊且緊密排列,無炎性細胞浸潤、充血、水腫和潰瘍的形成,為正常結腸黏膜。模型組小鼠結腸組織中杯狀細胞嚴重丟失,黏膜上皮破損,腺體排列紊亂,隱窩結構被嚴重破壞,并出現(xiàn)大量炎性細胞浸潤。各給藥組結腸病理情況有所改善,隱窩破壞程度較小,保持較好的結腸組織上皮的完整性,炎癥細胞浸潤減少,以及腺體排列較為整體。白頭翁湯低劑量組結腸組織有少量的淋巴浸潤,而白頭翁湯高劑量組相比白頭翁湯低劑量組結腸中間位置有較多炎性浸潤。

與對照組比較:##P<0.01 ###P<0.001;與模型組比較:*P<0.05 **P<0.01 ***P<0.001,下圖同
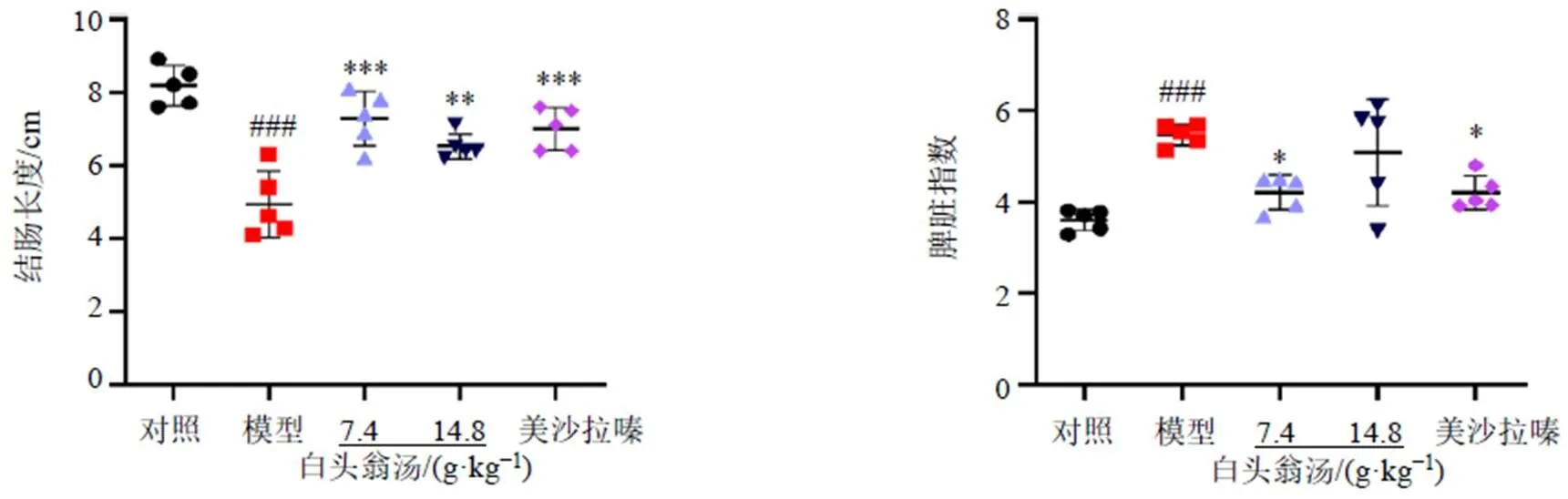
圖2 白頭翁湯對UC小鼠結腸長度和脾臟指數(shù)的影響(, n = 5)

圖3 白頭翁湯對UC小鼠結腸組織病理變化的影響(HE)
3.4 白頭翁湯對UC小鼠結腸黏液屏障的影響
如圖4所示,對照組隱窩結構明顯,每個隱窩里存在大量的杯狀細胞,并有黏蛋白從杯狀細胞分泌,結腸上皮細胞覆蓋著較厚的黏液層,黏液均連續(xù)完整。模型組小鼠的成熟杯狀細胞嚴重缺失,每個隱窩的杯狀細胞數(shù)量明顯減少,黏液層破壞。給予白頭翁湯和美沙拉嗪后,顯著改善了DSS引起的杯狀細胞和黏蛋白的大量消耗。白頭翁湯低劑量組對黏液屏障的保護作用較美沙拉嗪更加明顯,美沙拉嗪組小鼠黏液蛋白聚集在隱窩內(nèi),而沒有分泌出去形成連續(xù)的黏液層。
3.5 白頭翁湯對UC小鼠結腸組織中炎癥因子水平的影響
MPO來源于中性粒細胞,是中性粒細胞浸潤的標志。如表2所示,與對照組比較,模型組小鼠結腸組織IL-6、TNF-α、IL-1β水平和MPO活性均顯著升高(<0.01、0.001),IL-10水平顯著降低(<0.01);與模型組比較,各給藥組TNF-α、IL-1β水平和MPO活性均顯著降低(<0.05、0.01),白頭翁湯低劑量組IL-10水平顯著升高(<0.05),美沙拉嗪組IL-6水平顯著降低(<0.05)。
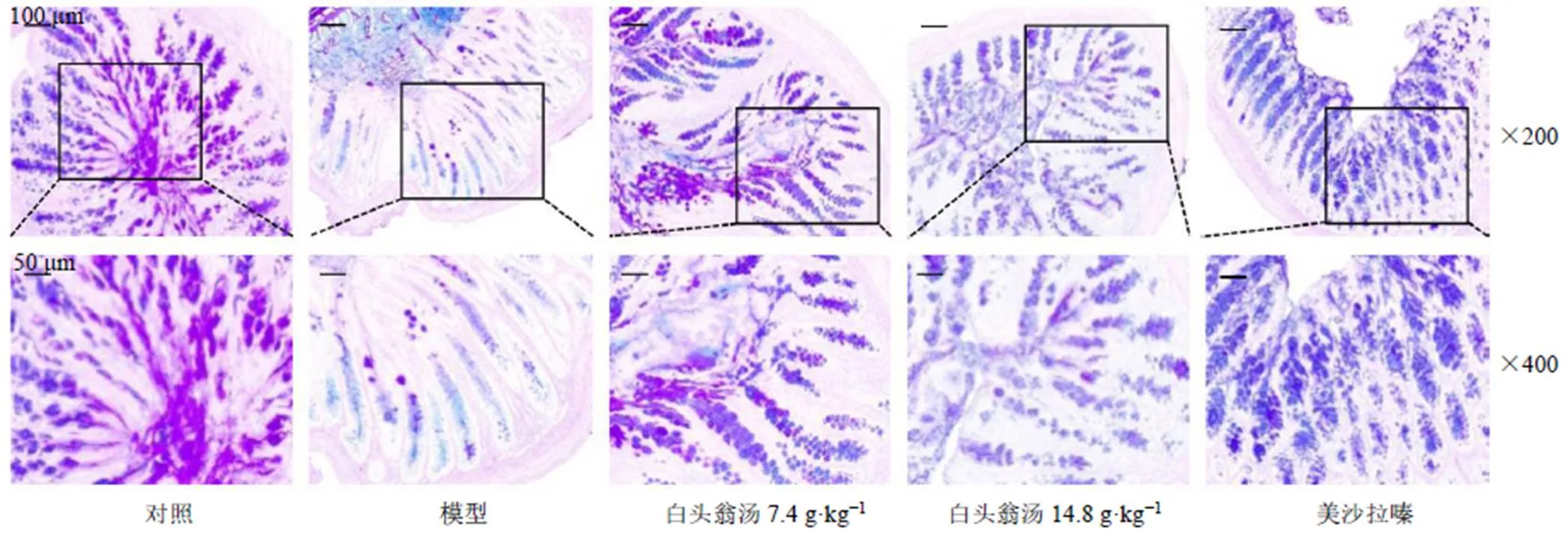
圖4 白頭翁湯對UC小鼠結腸組織MUC2蛋白表達的影響
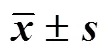
表2 白頭翁湯對UC小鼠結腸組織炎癥因子水平的影響(, n = 5)
與對照組比較:##<0.01###<0.001;與模型組比較:*<0.05**<0.01
##< 0.01###< 0.001control group;*< 0.05**< 0.01model group
3.6 白頭翁湯對UC小鼠結腸組織Ki67蛋白表達的影響
如圖5所示,與對照組比較,模型組小鼠結腸組織中Ki67陽性細胞(棕黃色)明顯減少(<0.001),說明模型組小鼠結腸組織細胞增殖能力較弱;與模型組比較,美沙拉嗪組和白頭翁湯低劑量組Ki67陽性細胞顯著增加(<0.05、0.01),說明白頭翁湯能夠改善UC小鼠結腸細胞的增殖能力。
3.7 白頭翁湯對UC小鼠結腸組織Lgr5+ ISCs的影響
如圖6所示,模型組小鼠結腸組織中Lgr5+ISCs減少,說明模型組ISCs增殖和分化能力降低,分泌型細胞不能得到持續(xù)的更新,杯狀細胞耗竭;給予美沙拉嗪和白頭翁湯治療后,Lgr5+ISCs的數(shù)量減少情況得到緩解,說明白頭翁湯保護了UC小鼠ISCs免受破壞。
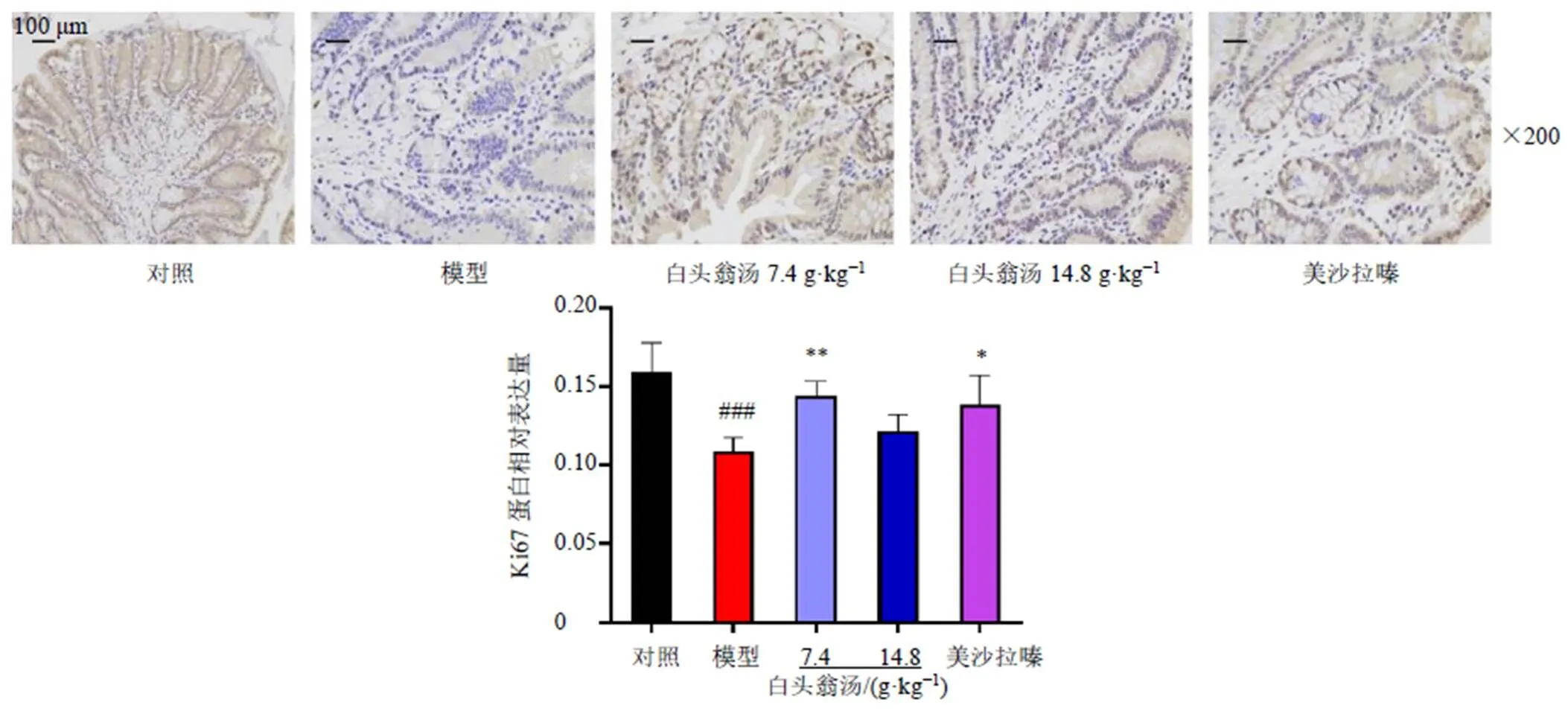
圖5 白頭翁湯對UC小鼠結腸組織Ki67蛋白表達的影響(, n = 3)
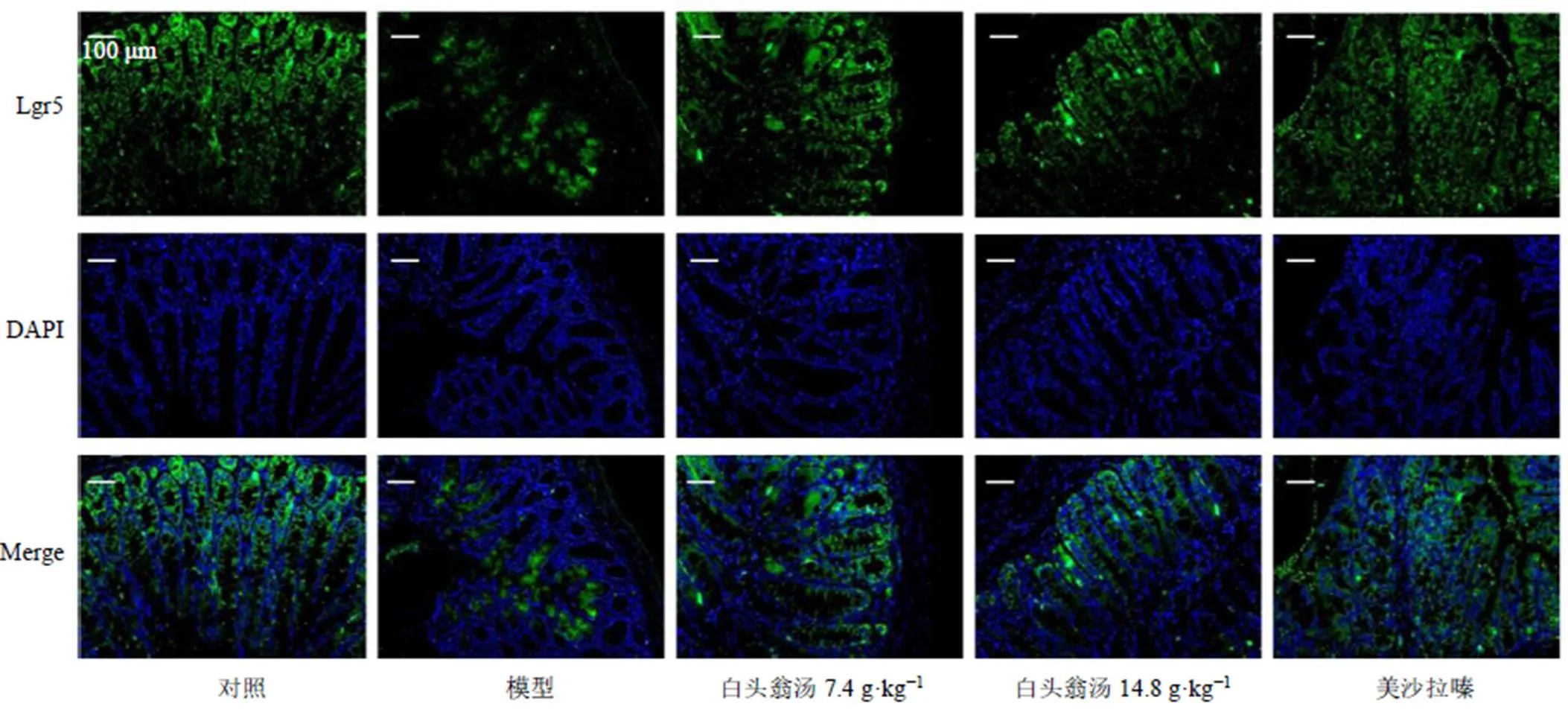
圖6 白頭翁湯對UC小鼠結腸組織Lgr5+ ISCs表達的影響 (×200)
3.8 白頭翁湯對UC小鼠結腸組織Notch、Hes1、Atoh1和MUC2蛋白表達的影響
如圖7所示,與對照組比較,模型組結腸組織Notch1和Hes1蛋白表達水平均明顯升高(<0.01、0.001),說明DSS誘導的UC小鼠Notch信號通路被激活,而下游Atoh1和MUC2蛋白表達水平顯著降低(<0.001);與模型組比較,各給藥組Notch1和Hes1蛋白表達水平均明顯降低(<0.05、0.001),白頭翁湯低劑量組和美沙拉嗪組Atoh1和MUC2蛋白表達水平顯著升高(<0.05、0.01)。表明白頭翁湯可能通過抑制Notch信號通路來增強黏液屏障的功能。
4 討論
本研究進一步證實了白頭翁湯對UC小鼠的治療作用,發(fā)現(xiàn)白頭翁湯可以降低UC小鼠結腸MPO、IL-6、IL-1β和TNF-α水平,促進IL-10的表達抑制炎癥。本研究還發(fā)現(xiàn)白頭翁湯具有改善黏液屏障功能,主要體現(xiàn)在白頭翁湯可以增加杯狀細胞MUC2的分泌并增厚黏液層,減少由DSS誘導Lgr5+ISCs的損失。白頭翁湯影響了Notch-1/Hes1/Atoh1信號通路,該通路的激活可能抑制了ISCs增殖以及向分泌型細胞的分化,進而導致杯狀細胞的耗竭(圖8,由figdraw繪圖)。
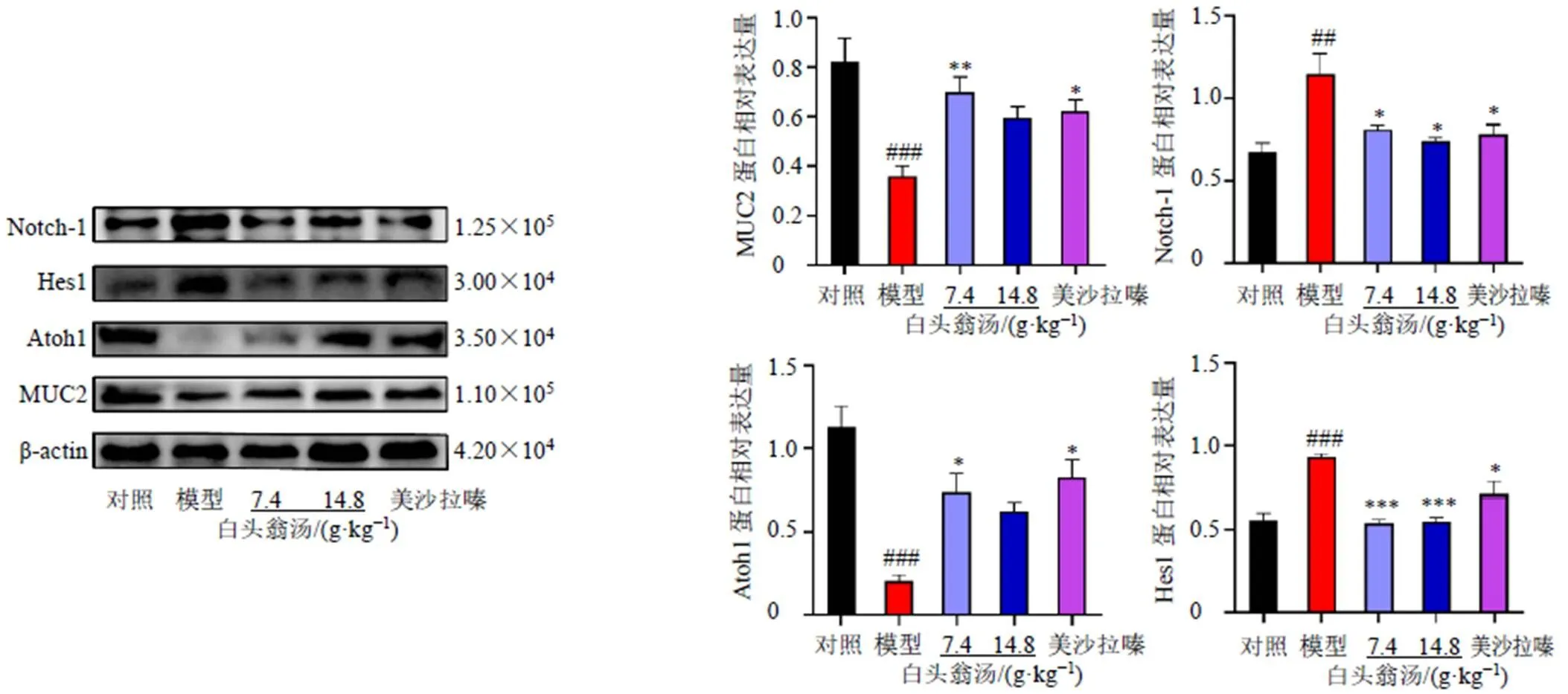
圖7 白頭翁湯對UC小鼠結腸組織Notch-1信號通路相關蛋白表達的影響(, n = 3)
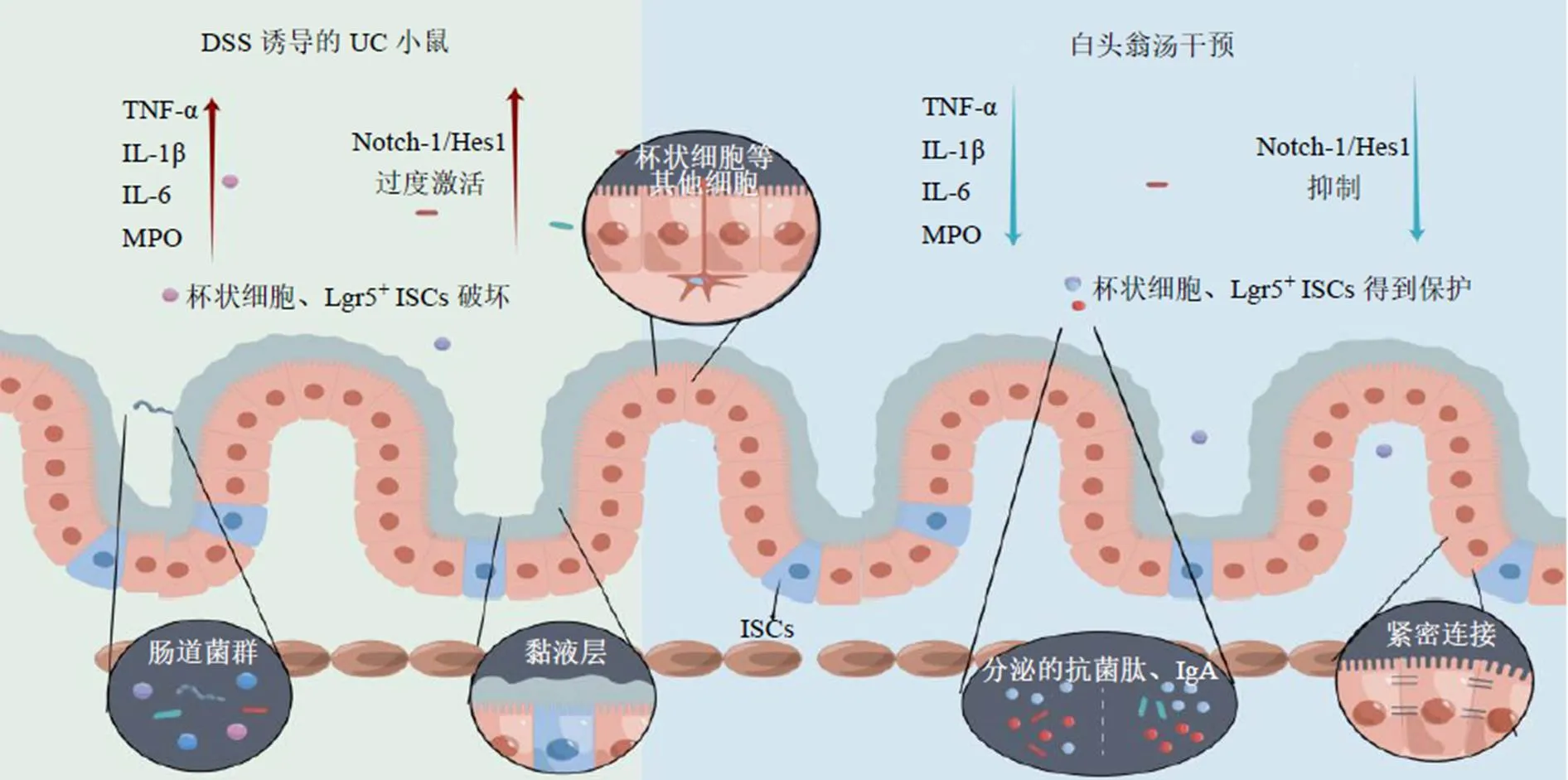
圖8 白頭翁湯通過調(diào)控Notch-1信號通路治療UC小鼠
完整的腸屏障功能對于腸道穩(wěn)態(tài)至關重要[21-22]。腸屏障主要由以黏液層為主的化學屏障、上皮細胞構成的機械屏障和固有層構成的免疫屏障3部分組成[23]。黏液層是腸道屏障的重要組成部分,保護腸上皮細胞免受腸腔病原體的侵襲。黏液屏障約由30種核心蛋白組成,主要包括黏蛋白、抗菌肽和免疫球蛋白A(immunoglobulin A,IgA),其中杯狀細胞合成的MUC2是構成黏蛋白最基本的骨架[24]。在UC患者以及UC小鼠模型中,細菌可以穿透結腸內(nèi)黏液層[25-26]。另有報道表明基因敲除小鼠由于腸道微生物和腸道上皮細胞直接接觸,會自發(fā)發(fā)生結腸炎[10]。結腸組織AB-PAS染色顯示,白頭翁湯可以恢復DSS誘導的杯狀細胞的破壞以及黏蛋白的耗竭。
Lgr5+ISCs的增殖和分化對于維持黏液層的完整性扮演著重要角色[27-29]。Lgr5+ISCs具有高度的自我更新和高分化潛力。由于UC病情的反復發(fā)作,傷及隱窩結構,位于隱窩底部的Lgr5+ISCs則會遷移至傷口處,更新腸道上皮細胞,生成特定的分泌型杯狀細胞和潘氏細胞,維持受損腸黏膜上皮細胞的更新、再生和修復[30]。在不同的結腸炎造模方式中,DSS造模能夠呈劑量相關性地破壞Lgr5+ISCs[28]。在自發(fā)引起結腸炎的敲除小鼠結腸組織中,Lgr5+ISCs異常增殖和分化,分泌譜系細胞丟失[18]。Chen等[12]發(fā)現(xiàn)肝臟固醇12α-羥化酶(sterol 12α-hydroxylase,CYP8B1)/膽酸通路通過抑制過氧化物酶體增殖物激活受體α依賴的脂肪酸氧化,抑制Lgr5+ISCs再生,并最終促進結腸炎。Ju等[31]發(fā)現(xiàn)葡萄外泌體能夠誘導Lgr5+ISCs保護小鼠免受DSS誘導的結腸炎。天然植物產(chǎn)物小檗堿可以調(diào)節(jié)Wnt通路激活Lgr5+ISCs恢復腸穩(wěn)態(tài)[32]。本研究結果證實了白頭翁湯能夠調(diào)節(jié)ISCs增殖分化,促進杯狀細胞再生保護黏液屏障。
白頭翁湯影響Notch信號通路進而維持ISCs平衡分泌型細胞調(diào)節(jié)黏液屏障可能是發(fā)揮功效的原因之一[27,33]。當Notch激活時,Notch胞內(nèi)域進入細胞核,隨后激活轉(zhuǎn)錄因子Hes1的表達,Hes1抑制轉(zhuǎn)錄因子Atoh1的表達,從而限制腸道干細胞向杯狀細胞的分化,導致黏液屏障減弱[34-36]。在UC患者中,Notch信號過度激活[37]。另有研究表明青白湯可以抑制Notch信號恢復黏液屏障功能來緩解UC[38]。本研究發(fā)現(xiàn)白頭翁湯可能通過調(diào)控Notch信號通路,進而可能影響ISCs的增殖和分化。
利益沖突 所有作者均聲明不存在利益沖突
[1] 魏瑋. 潰瘍性結腸炎中西醫(yī)結合診療專家共識 [J]. 中國中西醫(yī)結合雜志, 2023, 43(1): 5-11.
[2] Krugliak Cleveland N, Torres J, Rubin D T. What does disease progression look like in ulcerative colitis, and how might it be prevented? [J]., 2022, 162(5): 1396-1408.
[3] Kobayashi T, Siegmund B, Le Berre C,. Ulcerative colitis [J]., 2020, 6(1): 74.
[4] Feuerstein J D, Moss A C, Farraye F A. Ulcerative colitis [J]., 2019, 94(7): 1357-1373.
[5] Du L, Ha C. Epidemiology and pathogenesis of ulcerative colitis [J]., 2020, 49(4): 643-654.
[6] Yoon H, Jangi S, Dulai P S,. Incremental benefit of achieving endoscopic and histologic remission in patients with ulcerative colitis: A systematic review and meta-analysis [J]., 2020, 159(4): 1262-1275.
[7] Morampudi V, Graef F A, Stahl M,. Tricellular tight junction protein tricellulin is targeted by the enteropathogeniceffector EspG1, leading to epithelial barrier disruption [J]., 2017, 85(1): e00700-e00716.
[8] Wang Y R, You K Y, You Y,. Paeoniflorin prevents aberrant proliferation and differentiation of intestinal stem cells by controlling C1q release from macrophages in chronic colitis [J]., 2022, 182: 106309.
[9] Yao D B, Dai W L, Dong M,. MUC2 and related bacterial factors: Therapeutic targets for ulcerative colitis [J]., 2021, 74: 103751.
[10] van der Sluis M, de Koning B A, de Bruijn A C,. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection [J]., 2006, 131(1): 117-129.
[11] Cheng C W, Biton M, Haber A L,. Ketone body signaling mediates intestinal stem cell homeostasis and adaptation to diet [J]., 2019, 178(5): 1115-1131.
[12] Chen L, Jiao T, Liu W,. Hepatic cytochrome P450 8B1 and cholic acid potentiate intestinal epithelial injury in colitis by suppressing intestinal stem cell renewal [J]., 2022, 29(9): 1366-1381.
[13] 申睿, 劉苗, 朱向東, 等. 中醫(yī)藥治療潰瘍性結腸炎實驗研究進展 [J]. 中草藥, 2018, 49(7): 1721-1725.
[14] 胡靜怡, 朱磊, 連紫宇, 等. 白頭翁湯對潰瘍性結腸炎模型小鼠腸道菌群及短鏈脂肪酸的影響 [J]. 南京中醫(yī)藥大學學報, 2021, 37(6): 817-822.
[15] 高穎, 王遙, 安佰平, 等. 白頭翁湯對放射性腸炎小鼠的抗炎和抗凋亡作用的實驗研究 [J]. 時珍國醫(yī)國藥, 2022, 33(4): 827-830.
[16] 王亞東, 徐志慶, 夏丹, 等. 基于NLRP3炎癥小體研究白頭翁湯正丁醇提取物對白念珠菌定植下小鼠潰瘍性結腸炎的作用機制 [J]. 中草藥, 2022, 53(13): 3997-4006.
[17] Tian X L, Peng Z L, Luo S P,. Aesculin protects against DSS-Induced colitis though activating PPARγ and inhibiting NF-кB pathway [J]., 2019, 857: 172453.
[18] Wang Y R, You K Y, You Y,. Paeoniflorin prevents aberrant proliferation and differentiation of intestinal stem cells by controlling C1q release from macrophages in chronic colitis [J]., 2022, 182: 106309.
[19] Andújar I, Ríos J L, Giner R M,. Beneficial effect of shikonin on experimental colitis induced by dextran sulfate sodium in BALB/c mice [J]., 2012, 2012: 271606.
[20] Liang L, Xiong Q Q, Kong J X,. Intraperitoneal supplementation of iron alleviates dextran sodium sulfate-induced colitis by enhancing intestinal barrier function [J]., 2021, 144: 112253.
[21] Chelakkot C, Ghim J, Ryu S H. Mechanisms regulating intestinal barrier integrity and its pathological implications [J]., 2018, 50(8): 1-9.
[22] 謝晶日, 陳善濤, 劉芝偉. 潰瘍性結腸炎發(fā)病機制研究進展 [J]. 海南醫(yī)學院學報, 2022, 28(23): 1835-1840.
[23] Dong L J, Xie J W, Wang Y Y,. Mannose ameliorates experimental colitis by protecting intestinal barrier integrity [J]., 2022, 13(1): 4804.
[24] Gustafsson J K, Johansson M E V. The role of goblet cells and mucus in intestinal homeostasis [J]., 2022, 19(12): 785-803.
[25] Fang J, Wang H, Zhou Y P,. Slimy partners: The mucus barrier and gut microbiome in ulcerative colitis [J]., 2021, 53(5): 772-787.
[26] Goyal N, Rana A, Ahlawat A,. Animal models of inflammatory bowel disease: A review [J]., 2014, 22(4): 219-233.
[27] Zheng L, Duan S L, Wen X L,. Molecular regulation after mucosal injury and regeneration in ulcerative colitis [J]., 2022, 9: 996057.
[28] Girish N, Liu C Y, Gadeock S,. Persistence of Lgr5+colonic epithelial stem cells in mouse models of inflammatory bowel disease [J]., 2021, 321(3): G308-G324.
[29] Goto N, Goto S, Imada S,. Lymphatics and fibroblasts support intestinal stem cells in homeostasis and injury [J]., 2022, 29(8): 1246-1261.
[30] 李葉華, 陳曄光. 腸上皮干細胞研究進展 [J]. 中國科學: 生命科學, 2018, 48(7): 713-720.
[31] Ju S W, Mu J Y, Dokland T,. Grape exosome-like nanoparticles induce intestinal stem cells and protect mice from DSS-induced colitis [J]., 2013, 21(7): 1345-1357.
[32] Luo Z C, Li Z H, Liang Z,. Berberine increases stromal production of Wnt molecules and activates Lgr5+stem cells to promote epithelial restitution in experimental colitis [J]., 2022, 20(1): 287.
[33] Ludikhuize M C, Meerlo M, Gallego M P,. Mitochondria define intestinal stem cell differentiation downstream of a FOXO/Notch axis [J]., 2020, 32(5): 889-900.
[34] Shinoda M, Shin-Ya M, Naito Y,. Early-stage blocking of Notch signaling inhibits the depletion of goblet cells in dextran sodium sulfate-induced colitis in mice [J]., 2010, 45(6): 608-617.
[35] Zheng X, Tsuchiya K, Okamoto R,. Suppression of hath1 gene expression directly regulated by hes1 via Notch signaling is associated with goblet cell depletion in ulcerative colitis [J]., 2011, 17(11): 2251-2260.
[36] 夏青松, 徐麗君, 陳廣, 等. 信號分子通路網(wǎng)絡對腸干細胞增殖和分化的調(diào)控 [J]. 生理科學進展, 2020, 51(4): 305-310.
[37] Okamoto R, Tsuchiya K, Nemoto Y,. Requirement of Notch activation during regeneration of the intestinal epithelia [J]., 2009, 296(1): G23-G35.
[38] Lin J C, Wu J Q, Wang F,. QingBai Decoction regulates intestinal permeability of dextran sulphate sodium-induced colitis through the modulation of notch and NF-κB signaling [J]., 2019, 52(2): e12547.
Protective effect of Baitouweng Decoction on intestinal mucus barrier in mice with ulcerative colitis based on Notch signaling pathway
LIU Wei1, 3, LIU You-qian2, JIANG Cui-hua1, 3, ZHANG Dong-jian1, 3, FANG Yu-xi1, 3, GONG Min1, 4, LI Yin-qing5, WANG Tian-tian5, ZHANG Jian1, 2, 3
1. School of Third Clinical Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China 2. Nanjing Lishui District Hospital of Traditional Chinese Medicine, Nanjing 211200, China 3. Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China 4. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 210009, China 5. HeBei Yuzhilin Pharmaceutical Co., Ltd., Shijiazhuang 050000, China
To explore the protective effect of Baitouweng Decoction (白頭翁湯, BTWD) on intestinal mucus barrier in mice with ulcerative colitis (UC) induced by dextran sodium sulfate (DSS) and its effect on Notch pathway.C57BL/6 mice were randomly divided into control group, model group, mesalazine (50 mg/kg) group and BTWD low-, high-dose (7.4, 14.8 g/kg) groups. The mice in control group were free to drink pure water, and the other groups were free to drink 2.5% DSS solution for 8 d to induce UC model. At the same time, each group was given corresponding drugs. The body weight, fecal consistency and bloody stool of mice were recorded every day. HE staining was used to observe the pathological changes of colon tissue. The secretion of mucin 2 (MUC2) in colon tissue was observed by AB-PAS staining. The activity of myeloperoxidase (MPO) and contents of pro-inflammatory factors interleukin-6 (IL-6), IL-1β, tumor necrosis factor-α (TNF-α) and anti-inflammatory factor IL-10 in colon tissue were detected by ELISA. The expression of Ki67 in colon tissue was detected by immunohistochemistry. The number of positive cells of leucine-rich repeat-containing G-protein-coupled receptor 5 (Lgr5+) intestinal stem cells (ISCs) in colon tissue was determined by immunofluorescence. Western blotting was used to detect Notch-1, Atoh1, Hes1 and MUC2 protein expressions in colon tissue.Compared with model group, BTWD alleviated the decrease of body weight and increase of disease activity index (DAI) in UC mice induced by DSS (< 0.05, 0.01, 0.001), alleviated the shortening, edema and pathological damage of colon tissue (< 0.01, 0.001), reduced the infiltration of inflammatory cells, destruction of crypts and goblet cells, decreased MPO activity and IL-1β, TNF-α levels in colon tissue (< 0.05, 0.01), increased IL-10 level (< 0.05), increased the number of Ki67 positive cells in colon tissue (< 0.01), promoted the secretion of MUC2 and the number of Lgr5+ISCs positive cells, down-regulated Notch and Hes-1 protein expressions (< 0.05, 0.001), up-regulated Atoh1 and MUC2 protein expressions (< 0.05, 0.01).BTWD can reduce the level of pro-inflammatory cytokines in colon tissue of UC mice, increase the proliferation and differentiation of Lgr5+ISCs, protect crypt and goblet cell structure, and promote the secretion of MUC-2, which may be related to the regulation of Notch-1/Atoh1/Hes1 pathway.
Baitouweng Decoction; ulcerative colitis; intestinal stem cells; mucus barrier; Notch signaling pathway; pulchinenoside B4; phellodendrine; berberine; epiberberine; coptidine; palmatine; esculin; esculetin
R285.5
A
0253 - 2670(2023)16 - 5257 - 10
10.7501/j.issn.0253-2670.2023.16.014
2023-03-21
南京市衛(wèi)生科技發(fā)展專項資金項目(YKK22241)
劉 偉(1996—),男,碩士研究生,研究方向為中藥藥理學。E-mail: lw20201239@163.com
張 健(1973—),男,博士,研究員,碩士生導師,研究方向為中藥化學。E-mail: zhangjian@jsatcm.com
[責任編輯 李亞楠]

