益氣養陰通絡方通過lncRNA UCA1靶向調控miR-485-5p抑制糖尿病腎病大鼠腎小管上皮細胞凋亡及炎癥反應作用機制
宇汝翠,陸智慧,李金虎,張 雁
(1.中國科學技術大學附屬第一醫院 安徽省立醫院中醫科,安徽 合肥 230001;2.解放軍聯勤保障部隊901醫院,安徽 合肥 230071)
糖尿病腎病(Diabetic nephropathy,DN)是糖尿病患者的主要死亡原因之一,其發病率逐年上升,主要表現為尿液蛋白定性試驗陽性、高血壓和腎功能進行性損害[1-2]。DN的發病與代謝和血液在心血管系統中流動改變、體內氧化與抗氧化作用失衡、炎癥等因素的相互調控有著密切聯系,其中最關鍵的是基因誘導細胞死亡[3-4]。目前,該病的治療手段主要包括控制血壓、血糖、血脂水平,但并不能阻止其最終發展為終末期腎病[5]。因此,尋找DN有效的治療靶點和方法十分重要。中醫認為,DN是虛實夾雜之證,初期以陰虛燥熱為主,日久則氣陰兩虛,后期可致陰陽俱損。DN的基本病機為氣陰兩虛,以陰虛為本,血瘀阻絡等標實之邪貫穿其中[6-7]。故而調整陰陽、益氣養陰、補脾益腎兼活血化瘀通絡是DN的主要治法。長鏈非編碼RNA(Long-chain non-coding RNA,lncRNA)是一類非編碼RNA分子,其可參與調控DN的進展[8-9]。有研究發現,lncRNA MALAT可上調ELAVL1的表達,促進炎癥因子的生成和釋放,從而促進DN的焦亡[10]。尿路上皮癌相關分子1(Urothelial carcinoma associated 1,UCA1)是源于人內源性逆轉錄病毒家族的lncRNA分子,其廣泛參與腫瘤、帕金森病、系統性紅斑狼瘡等疾病的進展[11-12]。但是,UCA1在DN中的作用尚不明確。因此,本研究探討益氣養陰通絡方通過lncRNA UCA1靶向調控miR-485-5p抑制DN大鼠腎小管上皮細胞凋亡和炎癥反應的作用機制,為DN的治療提供參考。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物:雄性Wistar大鼠50只,購自銳賽生物技術有限公司,體重180~220 g,在室溫24 ℃、濕度60%的實驗動物房內適應性喂養。將大鼠分為空白組、模型組和益氣養陰通絡方低、中、高劑量組,每組10只。空白組大鼠使用普通飼料喂養,其余組大鼠予高糖高脂飲食,于第8周分別予模型組和益氣養陰通絡方低、中、高劑量組大鼠一次性腹腔注射等量檸檬酸緩沖液和鏈脲佐菌素30 mg/kg,監測大鼠血糖和24 hUTP水平,24 hUTP>30 mg表示DN模型建立成功。
1.1.2 實驗藥物:益氣養陰通絡方由黃芪 20 g,黨參 15 g,丹參、麥冬、五味子、天花粉、山藥、南沙參、北沙參、地龍、生地黃、車前子、澤瀉、山萸肉各10 g,三七粉(沖)3 g組成。以上藥物加水煎煮,收汁,配制2 g/ml生藥濃縮液。分別提取濃縮液32.4 ml(含生藥64.8 g)、64.8 ml(含生藥129.6 g)、129.6 ml(含生藥259.2 g),然后再加蒸餾水至200 ml,攪拌均勻,分別灌胃益氣養陰通絡方低、中、高劑量組大鼠,空白組、模型組每天均灌胃等體積蒸餾水。干預期間大鼠自由進食、飲水。干預8周。
1.1.3 主要實驗試劑與儀器:蒸餾水(批號201902237103SJ);檸檬酸緩沖液(批號20180403,上海索萊寶生物科技有限公司);鏈脲佐菌素(批號S0130,美國Sigma公司);全自動生化分析(型號7600-020,日立公司);ELISA試劑盒(批號20150301,武漢華美生物);離心機(型號6000i,德國Thermo公司);EP管(型號502-GRD-Q,Thermo QSP公司);裂解液(批號C1053,北京普利萊);雙熒光染色試劑盒(批號0629A20,北京雷根生物);流式細胞儀(型號CytoFLEX,美國貝克曼庫爾特);BCA試劑盒(批號20190325,江蘇凱基生物);PCR儀(型號C1000Touch,美國Bio-Rad公司);電泳儀(型號1645050,美國Bio-Rad公司)。
1.2 實驗方法
1.2.1 大鼠腎功能指標和炎癥因子水平檢測:大鼠摘眼球取血,全血靜置40 min后,離心機4000 r/min離心10 min分離血清,全自動生化分析儀檢測24 h尿蛋白(24 hUTP)、血清肌酐(SCr)水平。采用ELISA法檢測大鼠血清白介素-1β(IL-1β)、腫瘤壞死因子-α(TNF-α)水平。血清在37 ℃條件下孵育,洗滌4次,然后加入標記物抗體,37 ℃反應30 min,避光顯色后檢測吸光值。
1.2.2 雙熒光染色法檢測細胞凋亡:提取大鼠腎小管上皮細胞,試劑盒檢測細胞凋亡。收集高糖處理后48 h的細胞,消化、離心、收集沉淀移至EP管,將細胞重懸后分別加入5 μl異硫氰酸熒光素和10 μl碘化丙啶。避光染色15 min后,停止染色,并輕輕混合細胞,以防止高混合力引起的細胞碎片,熒光雙染色流式細胞儀檢測細胞凋亡率。
1.2.3 WB檢測大鼠細胞NLRP3、Caspase-1蛋白表達:提取大鼠腎小管上皮細胞,提取總蛋白,2000 r/min離心3 min,收集沉淀;采用6孔板每孔加入裂解液裂解,再次離心20 min,根據BCA試劑盒測定總蛋白濃度,將各組總蛋白含量調整為30 μg/μl。取每組樣品進行電泳、轉膜,BSA封閉PVDF膜1 h,加入一抗,過夜后加入二抗,洗膜、顯色、凝膠成像。
1.2.4 PCR檢測大鼠細胞UCA1、miR-485-5p mRNA水平:提取大鼠腎小管上皮細胞,提取總RNA,然后將其逆轉錄為cDNA。以β-actin為內參,進行PCR檢測,PCR擴增27個循環。用2-ΔΔCt法對目的基因進行定量分析。
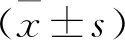
2 結 果
2.1 各組大鼠腎功能指標比較 見表1。與空白組比較,模型組和益氣養陰通絡方低、中、高劑量組24 hUTP、SCr水平較高(均P<0.05);與模型組比較,益氣養陰通絡方低、中、高劑量組24 hUTP、SCr水平明顯降低,且呈劑量依賴性(均P<0.05)。
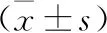
表1 各組大鼠腎功能指標比較
2.2 各組大鼠炎癥因子水平比較 見表2。與空白組比較,模型組大鼠血清IL-1β、TNF-α水平較高(均P<0.05);與模型組比較,益氣養陰通絡方低、中、高劑量組大鼠血清IL-1β、TNF-α水平下降,且呈劑量依賴性(均P<0.05)。

表2 各組大鼠炎癥因子水平比較(ng/L)
2.3 各組大鼠腎小管上皮細胞凋亡率比較 見表3(圖1)。與空白組比較,模型組凋亡率較高(P<0.05);與模型組比較,益氣養陰通絡方低、中、高劑量組大鼠腎小管上皮細胞凋亡率下降,且呈劑量依賴性(均P<0.05)。

圖1 各組大鼠腎小管上皮細胞凋亡率比較

表3 各組大鼠腎小管上皮細胞凋亡率比較(%)
2.4 各組大鼠NLRP3、Caspase-1蛋白表達比較 見表4(圖2)。與空白組比較,模型組大鼠NLRP3、Caspase-1蛋白表達水平較高(均P<0.05);與模型組比較,益氣養陰通絡方低、中、高劑量組大鼠NLRP3、Caspase-1蛋白表達水平降低,且呈劑量依賴性(均P<0.05)。

A:空白組;B:模型組;C:益氣養陰通絡方低劑量組;D:益氣養陰通絡方中劑量組;E:益氣養陰通絡方高劑量組
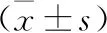
表4 各組大鼠NLRP3、Caspase-1蛋白表達比較
2.5 各組大鼠UCA1、miR-485-5p mRNA表達水平比較 見表5。與空白組比較,模型組UCA1 mRNA表達較低,miR-485-5p mRNA表達較高(均P<0.05);與模型組比較,益氣養陰通絡方低、中、高劑量組UCA1 mRNA表達升高,miR-485-5p mRNA表達降低,且呈劑量依賴性(均P<0.05)。

表5 各組大鼠UCA1、miR-485-5p mRNA表達水平比較
2.6 UCA1與miR-485-5p 的結合位點 UCA1是miR-485-5p的潛在靶基因之一。本實驗構建了其結合位點的UCA1-3’ UTR-WT載體和UCA1-3’ UTR-MUT序列突變載體。UCA1-3’ UTR-NC、UCA1-3’ UTR-WT和UCA1-3’ UTR-MUT分別與miRNA negative control和miR-485-5p共轉染腎小管細胞。與空載對照組比較,共轉染miR-485-5p的細胞UCA1-3’UTR-WT相對熒光酶活性降低(P=0.001)。經證實,miR-485-5p特異性結合UCA1的3’UTR端,抑制UCA1的表達。見圖3、4。

圖3 UCA1與miR-485-5p 的結合位點

圖4 UCA1與miR-485-5p雙熒光素酶報告基因結果
3 討 論
DN是糖尿病的常見并發癥,也是終末期腎病最主要的原因[13-14]。有研究認為,DN患者腎小管上皮細胞轉化為間質表型細胞、腎小囊臟層上皮細胞脫落并死亡與腎小囊臟層上皮細胞功能和形態學改變有關[15-16]。目前,DN的治療方式西醫主要以降糖、調脂為主,而中醫藥對于蛋白尿及臨床癥狀的改善有一定優勢,對于預防DN發病、減慢腎功能衰竭進程有著獨特療效[17]。中醫根據DN臨床表現,可將其歸于“消渴”“水腫”“虛勞”等疾病范疇[18-19]。DN基本病機為氣虛和陰虛[20]。有研究指出,益氣養陰通絡方治療DN臨床效果較佳,方中黨參可以有效減輕炎癥反應,抑制系膜細胞和基質的彌漫性增生,減少細胞周圍由多種大分子組成的復雜網絡的積聚,從而達到緩解DN病情的目的[21]。本研究采用益氣養陰通絡方干預DN大鼠模型,觀察其對腎小管上皮細胞凋亡和炎癥反應的作用機制。
本研究結果顯示,益氣養陰通絡方可顯著改善DN大鼠腎功能指標和炎癥因子水平,且呈劑量依賴性。有研究顯示,炎癥反應可以刺激腎小管上皮細胞,使外周血液中的單核免疫細胞在腎臟積聚,促進疏松結締組織的主要細胞增多,導致腎小球基質廣泛聚集并伴有結構塌陷,加速DN發展[22-23]。本研究檢測了各組大鼠腎小管上皮細胞凋亡率,結果顯示,經不同劑量益氣養陰通絡方治療后,DN大鼠腎小管上皮細胞凋亡率均有所降低,提示益氣養陰通絡方可能通過減少腎小管細胞尤其足細胞的凋亡,延緩DN的進展。在基因控制下細胞自主有序的死亡對DN的發生發展有重要意義,在高糖高脂狀態下機體可產生許多危險因子。NLRP3炎癥小體激活后,會使Caspase-1活化,而其會剪切IL-1β為成熟因子,誘導細胞膜損傷,從而啟動細胞凋亡[24]。因此,本研究對各組大鼠腎小管細胞內NLRP3、Caspase-1蛋白表達進行檢測,結果顯示,治療后,益氣養陰通絡方低、中、高劑量組NLRP3、Caspase-1蛋白表達水平降低,且隨著劑量的增加而降低。以上研究結果進一步明確益氣養陰通絡方可以抑制腎小管上皮細胞凋亡和炎癥反應。有研究表明,lncRNA UCA1的主要作用機制有遺傳印跡、復合物介導以染色質上核小體變化為基本特征的生物學過程、基因降解調控等[25]。lncRNA UCA1最初在膀胱癌中發現,后續研究顯示其在多種癌癥中均高表達。miR-485-5p是一種抑癌基因,其與腫瘤細胞生物學行為關系密切。研究顯示,miR-485-5p可以通過下調TPD52L2抑制膠質瘤細胞的生物學行為[26]。因此,本研究采用PCR檢測UCA1 mRNA和miR-485-5p mRNA在腎小管細胞中的表達水平,結果顯示,與模型組比較,治療后益氣養陰通絡方低、中、高劑量組UCA1 mRNA表達和miR-485-5p mRNA表達均升高,且呈劑量依賴性。其次,本研究驗證了UCA1與miR-485-5p存在結合位點,存在靶向調控關系,說明益氣養陰通絡方可以通過lncRNA UCA1調控miR-485-5p。
綜上所述,益氣養陰通絡方可以通過lncRNA UCA1調控miR-485-5p表達抑制腎小管上皮細胞凋亡和炎癥反應,從而發揮腎保護作用。

