立足平衡,聚焦轉化
謝葉歸
(長沙市東雅中學)
轉化率及平衡轉化率一直是高考的熱門考點,試題往往以真實的化工生產為背景,在真實的情境中考查學生的“理解與辨析、歸納與論證”能力,凸顯化學學科的社會價值。教育部曾印發《關于做好2022年普通高校招生工作的通知》,進一步深化高校考試招生改革。《通知》要求,穩妥推進高考綜合改革,引導減少死記硬背和“機械刷題”現象。筆者對近四年高考試題及2023年浙江省1月真題中有關化學反應平衡試題的命題特點進行了對比分析,總結解答此類問題的策略,避免“題海戰術”,以期對師生的高考復習備考有所幫助。
一、近四年高考真題分析
筆者對近四年全國卷及新高考卷(2019~2022)中化學反應原理題進行分析總結,發現考題特征如下:
(1)此類試題大多以真實的工業生產作為載體,體現了真實情境下的項目式教學,試題的陌生程度增大,引導考生提升綜合素質。
(2)近四年的高考真題中共出現轉化率/化學平衡轉化率考點大約29次,近期的2023年浙江省1月份高考試題就出現了3次,轉化率/化學平衡轉化率年年考,化學平衡圖像重點考,變化的是素材,不變的是原理。
(3)試題往往結合化學圖像來考查轉化率及平衡轉化率,試題綜合性較大,對考生處理信息的能力提出了較高的要求。
二、解題策略
(一)區分好“轉化率”與“平衡轉化率”
某一物質的轉化率等于該物質在反應中已轉化的量與該物質起始總量的比值;某一反應物的平衡轉化率α等于該物質在反應達平衡時已轉化的量與該物質起始總量的比值。
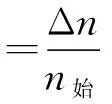
在實際的工業生產中,實際轉化率并非平衡轉化率。工業生產應該統籌考慮反應限度和反應速率的問題,以實現限定時間內的產量最大。其中,轉化率-溫度圖像能真實地反映化工生產過程,在調控溫度時,往往選擇以催化劑的活性最高時的溫度為最佳溫度,此時化學反應速率最大,可實現一段時間內的產量最大化。即轉化率可分為非平衡轉化率與平衡轉化率,非平衡轉化率與化學反應速率快慢有關,平衡轉化率與化學反應限度有關。
(二)影響“轉化率”與“平衡轉化率”的因素


表1 反應物不止一種aA(g)+bB(g)cC(g)+dD(g) ΔH<0

表2 反應物只有一種aA(g)bB(g)+cC(g) ΔH<0
(三)催化劑活性、溫度對轉化率影響的異同
在實際化工生產中,往往采取升溫及加入催化劑的方法來提高化學反應速率,從而提高生產效能。從前面分析可知,催化劑不能使平衡發生移動,不能改變化學平衡轉化率,但可提高非平衡轉化率。對于放熱反應,轉化率-溫度圖像往往呈現為“先升后降”,如何正確突破這類圖像問題成為高考備考中的難點。

表3


回答下列問題:
如圖1為丙烯腈產率與反應溫度的關系曲線,最高產率對應溫度為460℃。低于460℃時,有人認為丙烯腈的產率不是對應溫度下的平衡產率,其理由是________;高于460℃時,丙烯腈產率降低的可能原因是________(填標號)。
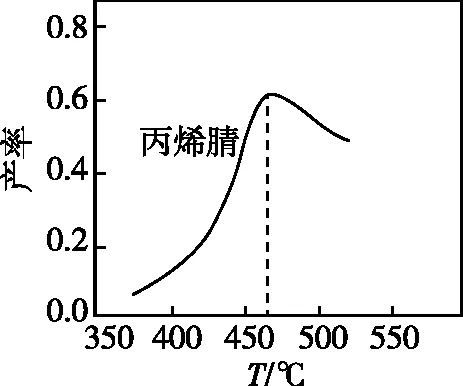
圖1
A.催化劑活性降低
B.平衡常數變大
C.副反應增多
D.反應的活化能增大
【答案】該反應為放熱反應,平衡產率應隨溫度升高而降低;AC
三、真題賞析
【例1】(2019年江蘇卷,15題)(不定項)在恒壓、NO和O2的起始濃度一定的條件下,催化反應相同時間,測得不同溫度下NO轉化為NO2的轉化率如圖2中實線所示(圖中虛線表示相同條件下NO的平衡轉化率隨溫度的變化)。下列說法正確的是
( )
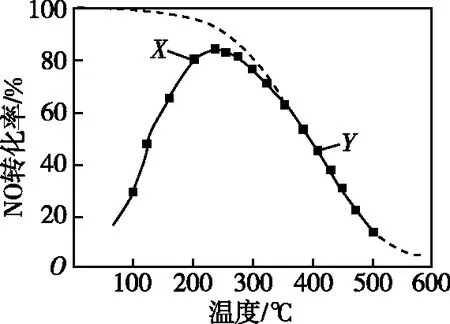
圖2
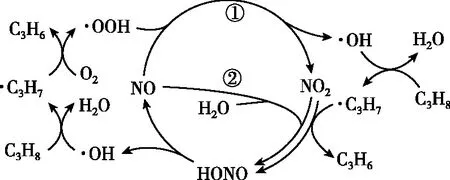
圖3

B.圖中X點所示條件下,延長反應時間能提高NO轉化率
C.圖中Y點所示條件下,增加O2的濃度不能提高NO轉化率
D.380℃下,c起始(O2)=5.0×10-4mol·L-1,NO平衡轉化率為50%,則平衡常數K>2 000
【答案】BD

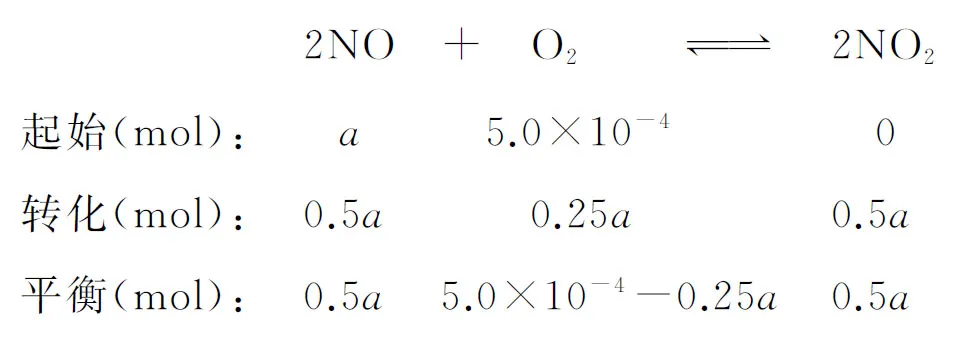
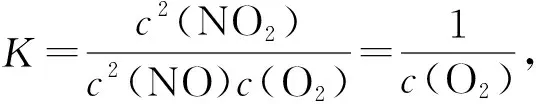
【試題巧解】實線表示催化反應相同時間,不同溫度下NO轉化為NO2的轉化率,虛線表示相同條件下NO的平衡轉化率隨溫度的變化,由解題策略(二)可知,延長反應時間可提高NO轉化率,B正確。
【例2】(2022年山東卷,10題)在NO催化下,丙烷與氧氣反應制備丙烯的部分反應機理如圖所示。下列說法錯誤的是
( )
A.含N分子參與的反應一定有電子轉移
B.由NO生成HONO的反應歷程有2種
C.增大NO的量,C3H8的平衡轉化率不變
D.當主要發生包含②的歷程時,最終生成的水減少
【答案】D

【試題巧解】NO是該反應的催化劑,催化劑不改變化學平衡轉化率,C正確。
【例3】(2023年1月浙江卷,19題節選)“碳達峰·碳中和”是我國社會發展重大戰略之一,CH4還原CO2是實現“雙碳”經濟的有效途徑之一,相關的主要反應有:

ΔH1=+247 kJ·mol-1,K1

(1)有利于提高CO2平衡轉化率的條件是________。
A.低溫低壓 B.低溫高壓
C.高溫低壓 D.高溫高壓
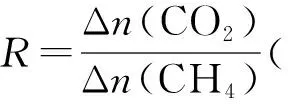
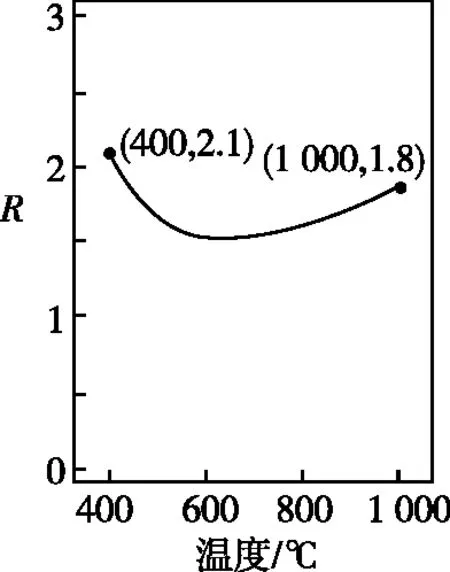
①常壓下CH4和CO2按物質的量之比1∶3投料,某一時段內CH4和CO2的轉化率隨溫度變化如圖4,請在圖5中畫出400~1 000℃之間R的變化趨勢并標明1 000℃時R值。
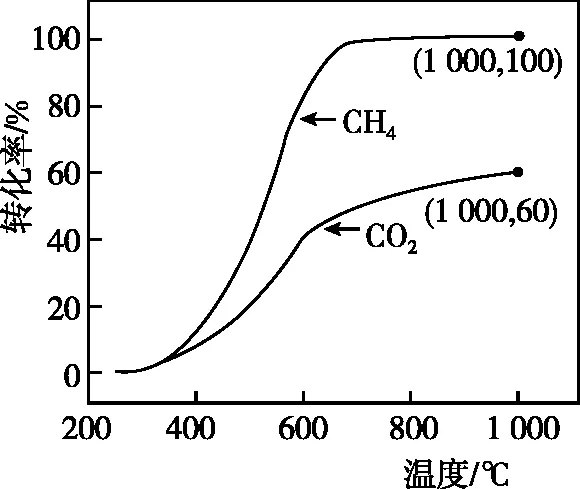
圖4
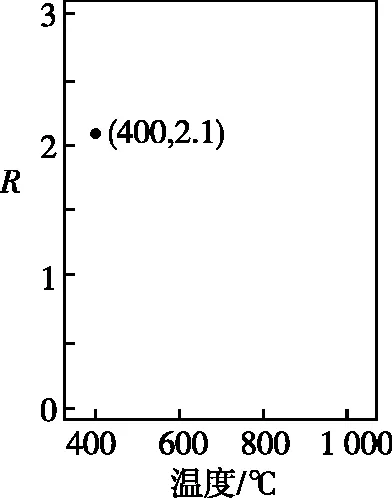
圖5
②催化劑X可提高R值,另一時段內CH4轉化率、R值隨溫度變化如表4所示:
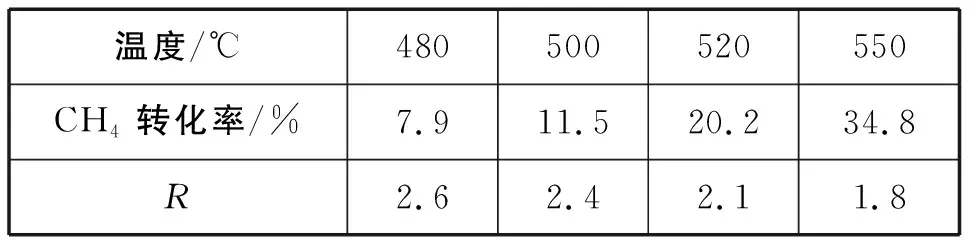
表4
下列說法不正確的是________。
A.R值提高是由于催化劑X選擇性地提高反應Ⅱ的速率
B.溫度越低,含氫產物中H2O占比越高
C.溫度升高,CH4轉化率增加,CO2轉化率降低,R值減小
D.改變催化劑提高CH4轉化率,R值不一定增大
【答案】(1)C
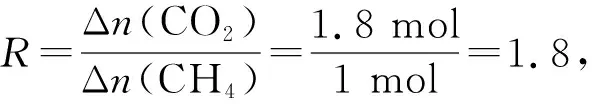
四、原創試題賞析
【例4】將CO、O2、H2、N2混合氣體在銅-鈰氧化物(xCuO·yCeO2,Ce是活潑金屬)催化氧化下可除去H2中少量CO,其可能機理如圖6所示,CO的轉化率隨溫度變化的曲線如圖7所示。已知Ce基態原子核外電子排布式為[Xe]4f15d16s2,下列說法錯誤的是
( )
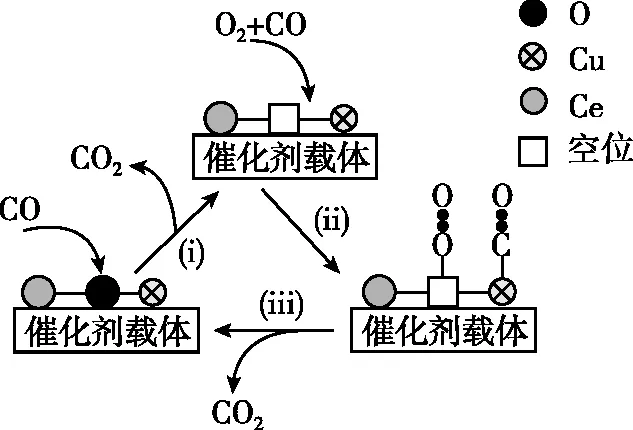
圖6
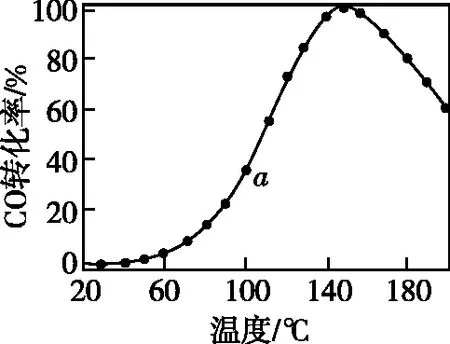
圖7
A.反應ⅰ中,Cu元素的化合價從+2變成+1,Ce元素的化合價從+4變成+3
B.圖中a點所示條件下,延長反應時間能提高CO轉化率
C.選擇合適的催化劑可減小反應體系中氫氣的損耗
D.140℃時曲線上的點為平衡點,繼續升溫平衡逆向移動導致CO轉化率降低
【答案】D

五、總結
從近幾年的高考真題可以看出,轉化率與平衡轉化率已成為落實“變化觀念與平衡思想”學科核心素養的重要載體。試題主要以文字敘述及化學平衡圖像的形式呈現,能力考查突出,情境設置新穎,試題呈現靈活。落腳點往往是考查讀取圖表信息的能力以及利用題目給予的新信息解決問題的能力。充分體現了高考試題的基礎性和創新性,符合高考評價體系的要求。
此外,通過研究高考真題不難發現,轉化率及平衡轉化率的考查始終穩中求新、穩中求變,變化的是題材,不變的是基本考點,在復習備考中,做到深研真題、發掘規律、精準備考,定能事半功倍。

