姜黃素對急性缺血性腦卒中小鼠MCP-1和CCR2水平的影響
張 鑫, 薛 慧, 孟天予, 耿尚勇, 鄭雅楠, 趙吉利, 杜文倩
急性缺血性卒中(acute ischemic stroke,AIS)的發(fā)病率逐年增加[1],AIS常導(dǎo)致腦組織壞死及局灶性神經(jīng)功能損傷,因此致殘甚至死亡。盡管近年來對AIS的病理生理機(jī)制的研究取得重大進(jìn)展,但仍缺乏改善AIS預(yù)后的有效治療藥物。炎性損傷是AIS的發(fā)病機(jī)制中重要的因素,其過度的表達(dá)可以促使AIS損傷進(jìn)一步惡化和發(fā)展。其中,小膠質(zhì)細(xì)胞激活是大腦炎癥反應(yīng)的第一步[2],在神經(jīng)元存活或損傷的調(diào)節(jié)中具有重要影響[3,4]。單核細(xì)胞趨化蛋白-1(monocyte chemoattractant protein-1,MCP-1)是其中至關(guān)重要的趨化因子,其主要由上皮細(xì)胞、小膠質(zhì)細(xì)胞等產(chǎn)生,并通過與7個(gè)跨膜G蛋白偶聯(lián)受體 C-C 趨化因子受體 2 (C-C Chemokine Receptor 2,CCR2)結(jié)合并激活,向這些靶細(xì)胞類型發(fā)出信號(hào)而產(chǎn)生生物學(xué)效應(yīng),使其在各種疾病的損傷和感染部位指導(dǎo)單核細(xì)胞、小膠質(zhì)細(xì)胞等的遷移和浸潤[5]。
姜黃素(curcumin,CUR)是一種從姜黃的植物根莖中提取出來的多酚化合物,因其具有的生物活性繁多,包括抗炎、抗氧化、免疫調(diào)節(jié)等而飽受關(guān)注[6~8]。有研究表明,在dss誘導(dǎo)的結(jié)腸炎中,姜黃素抑制dss刺激的巨噬細(xì)胞中NLRP3炎癥小體的激活,并顯著降低了MCP-1及IL-1β、IL-6的表達(dá)以及組織病理學(xué)損傷,顯著改善結(jié)腸炎的癥狀[9]。Sun等[10]的研究發(fā)現(xiàn)姜黃素可能通過失活A(yù)XL/JAK2/STAT3信號(hào)通路抑制小膠質(zhì)細(xì)胞介導(dǎo)的炎癥反應(yīng),從而改善自身免疫性腦脊髓炎小鼠的癥狀及嚴(yán)重程度。因此,我們猜想姜黃素是否在AIS模型中通過對MCP-1/CCR2的抑制發(fā)揮神經(jīng)保護(hù)作用,故通過建立AIS模型進(jìn)行研究。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物 健康雄性8~10周齡的C57/BL/6小鼠,體質(zhì)量18~23 g,購自內(nèi)蒙古大學(xué)動(dòng)物研究中心,小鼠飼養(yǎng)于室內(nèi)12 h明暗交替,室溫18~23 ℃,標(biāo)準(zhǔn)鼠飼料喂養(yǎng),自由進(jìn)食水。
1.2 實(shí)驗(yàn)試劑和儀器 超凈臺(tái)(山東博科);Western blot電泳轉(zhuǎn)膜儀器系統(tǒng)(Bio-rad);超聲勻漿器(天根);電子天平(奧豪斯);超低溫冰箱(松下);電熱恒溫鼓風(fēng)干燥箱(上海博訊);恒溫水浴鍋(上海博訊);低溫離心機(jī)(艾本德);酶標(biāo)儀(賽默飛);恒溫振蕩器(上海世平);轉(zhuǎn)棒疲勞儀(YLS-4C);電凝器(浩航);解剖顯微鏡(JSZ6-05047272);激光掃描共聚焦顯微鏡(OLYMPUS FLUOVIEW FV3000)。
姜黃素(購于美國Sigma-Aldrich公司),分子式C21H20O6,純度大于94%;二甲基亞砜(dimethyl sulfoxide,DMSO)(北京索萊寶科技有限公司);兔MCP-1多克隆抗體(美國Abcom公司);兔CCR2多克隆抗體(英國Biorbyt公司);鼠抗甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate,GAPDH)多克隆抗體(美國Proteintech公司);Elisa試劑盒(江蘇酶免實(shí)業(yè)有限公司)。
1.3 實(shí)驗(yàn)方法
1.3.1 實(shí)驗(yàn)分組 雄性C57BL/6小鼠隨機(jī)分為3組,即假手術(shù)組(Sham組)、溶劑對照組(dMCAO組)、姜黃素組(CUR組)。假手術(shù)組僅分離頸總動(dòng)脈且不灼燒大腦中動(dòng)脈分支;CUR組于術(shù)后連續(xù)7 d給予姜黃素[200 mg/(kg·d)]腹腔注射;對照組腹腔注射等體積DMSO。
1.3.2 構(gòu)建dMCAO模型 根據(jù)電凝法制作dMCAO動(dòng)物模型[11],水合氯醛(30 mg/kg)腹腔注射麻醉,腹部朝上固定小鼠。頸部去毛后消毒,于正中部位切開一約1.0 cm切口,將左側(cè)頸總動(dòng)脈小心仔細(xì)的分離,盡量避免出血,并用絲線永久性結(jié)扎,縫合頸部切口。然后,將小鼠變化體位,用膠布右側(cè)臥位固定,在耳屏與左側(cè)外眥之間切開皮膚,暴露顳肌,在顯微鏡下用眼科剪將顳肌剪開,顱骨下隱約能看到右側(cè)大腦中動(dòng)脈皮質(zhì)的分支,使用超聲顱錐將顱骨鉆開一小洞,直徑1 mm 左右,完整暴露大腦中動(dòng)脈皮質(zhì)分支,隨后用電凝筆燒灼血管。
1.3.3 Longa評(píng)分 動(dòng)物模型建立成功后,各組小鼠分別在術(shù)后 3 d和 7 d采用改良的Longa 分級(jí)法進(jìn)行行為學(xué)評(píng)分:0分,無缺陷;1級(jí),不能伸展對側(cè)前肢;2分,對側(cè)前肢屈曲;3分,輕度向?qū)?cè)轉(zhuǎn)圈;4分,嚴(yán)重向?qū)?cè)轉(zhuǎn)圈;5分,向?qū)?cè)跌倒。
1.3.4 轉(zhuǎn)棒實(shí)驗(yàn)(rota-rod)評(píng)價(jià)肢體功能 Rotarod 測試用于評(píng)估感覺運(yùn)動(dòng)的平衡和協(xié)調(diào)能力[12]。正式實(shí)驗(yàn)開始前將小鼠置于固定速度為4 r/min 的轉(zhuǎn)棒上訓(xùn)練跑輪,以15 min的間隔對小鼠進(jìn)行連續(xù)3 d的訓(xùn)練,每天3次,選擇能夠保留在轉(zhuǎn)棒上至少60 s的小鼠。正式實(shí)驗(yàn)在 dMCAO 手術(shù)前1 d開始,將小鼠放置在加速的跑輪儀上,使小鼠在 300 s 的時(shí)間內(nèi)以 4 r/min 到 40 r/min 的旋轉(zhuǎn)速度加速運(yùn)動(dòng)。由另一研究者記錄每只小鼠從開始試驗(yàn)到從機(jī)器上掉落下來的持續(xù)時(shí)間。將此次轉(zhuǎn)棒持續(xù)時(shí)間作為AIS前基線水平(baseline)。在 dMCAO 之后的3 d、7 d重復(fù)進(jìn)行 Rotarod 測試,每個(gè)測試日以 15 min的間隔對小鼠進(jìn)行 3 次試驗(yàn),將3次數(shù)據(jù)的平均值作為當(dāng)天的平均轉(zhuǎn)棒持續(xù)時(shí)間。
1.3.5 2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色法 dMCAO術(shù)后7 d,將各組小鼠麻醉后行斷頭處死,迅速取腦,去除額極,置入-80 ℃冰箱冷凍6 min后取出,連續(xù)等距、均勻切取5個(gè)冠狀腦片,厚度約2.0 mm,置于2%TTC溶液中進(jìn)行染色,37 ℃恒溫孵育15 min。染色后棄去TTC,加入4%多聚甲醛固定24 h。染色后顯示為紅色區(qū)域?yàn)檎DX組織,白色區(qū)域則為梗死部分腦組織。數(shù)碼相機(jī)拍照,用Image J軟件進(jìn)行圖像分析,計(jì)算梗死體積:總梗死體積=總梗死面積×腦片的厚度。計(jì)算梗死體積百分比:梗死體積百分比(%)=梗死體積百分比(%)={[總梗死體積-(梗死側(cè)半球體積-梗死對側(cè)半球體積)]/梗死對側(cè)半球體積}×100%。
1.3.6 Western blot蛋白質(zhì)免疫印跡實(shí)驗(yàn) dMCAO術(shù)后7 d,假手術(shù)組、溶劑對照組及CUR組取AIS核心周圍的皮質(zhì)腦組織,采用BCA蛋白定量法檢測蛋白濃度。Western blot方法測定MCP-1、CCR2蛋白表達(dá)水平。
1.3.7 免疫熒光實(shí)驗(yàn) dMCAO術(shù)后7 d,免疫熒光檢測MCP-1/CCR2和IBA1表達(dá):使用多聚甲醛固定腦組織,經(jīng)蔗糖梯度脫水后經(jīng)冰凍切片機(jī)切成18 μm切片,浸泡在PBS溶液中,用0.3%Triton-PBS室溫?fù)u床上漂洗3次,10 min/次;10%山羊血清封閉常溫?fù)u床60 min,一抗上孵育過夜,第2天再用0.3%Triton-PBS室溫?fù)u床上漂洗3次,10 min/次,避光孵育二抗,室溫?fù)u床60 min,后繼續(xù)避光用0.3%Triton-PBS漂洗3次,將切片撈出平鋪在載玻片上,用DAPI染色固定細(xì)胞核后封片,4 ℃避光保存,后續(xù)在熒光顯微鏡400倍視野下采集圖片使用Image J軟件檢測。
1.3.8 Elisa dMCAO術(shù)后7 d,假手術(shù)組、溶劑對照組及CUR組取AIS核心周圍的皮質(zhì)腦組織,采用Elisa法檢測IL1β、IL-6、TNF-α表達(dá)水平。

2 結(jié) 果
2.1 改良Longa評(píng)分 在小鼠清醒時(shí)采用 Zea-Longa方法進(jìn)行神經(jīng)行為學(xué)評(píng)分。dMCAO組與Sham組相比較,dMCAO組神經(jīng)行為學(xué)評(píng)分顯著升高(P<0.05)。CUR組與神經(jīng)行為學(xué)組相比較,CUR組神經(jīng)功能缺損評(píng)分有明顯下降(P<0.05)(見圖1)。

圖1 小鼠改良Longa評(píng)分統(tǒng)計(jì)圖
2.2 轉(zhuǎn)棒實(shí)驗(yàn) 術(shù)前,小鼠在滾輪上的時(shí)間無顯著差異。術(shù)后7 d,與dMCAO組小鼠相比,CUR組小鼠在滾輪上停留的時(shí)間均顯著提高,dMCAO組為66.13 s±23.62 s,CUR組為90.87 s±15.16 s(P<0.05)(見圖2)。
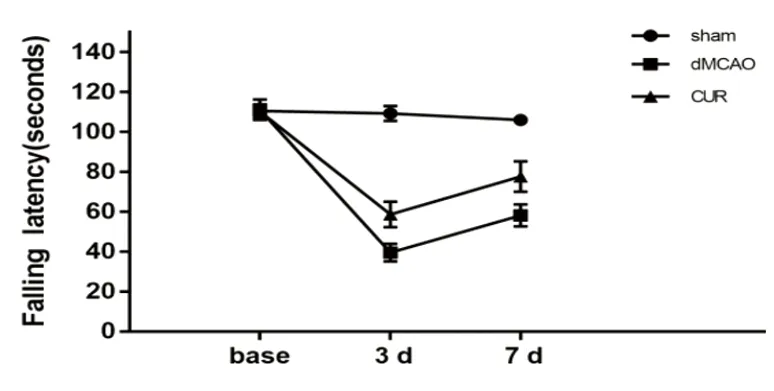
圖2 小鼠轉(zhuǎn)棒實(shí)驗(yàn)統(tǒng)計(jì)圖
2.3 小鼠腦組織TTC染色(見圖3) 采用TTC染色小鼠腦組織,并統(tǒng)計(jì)梗死體積。CUR組小鼠腦組織梗死體積比(33.91%±3.55%)小于dMCAO組(P<0.05)。
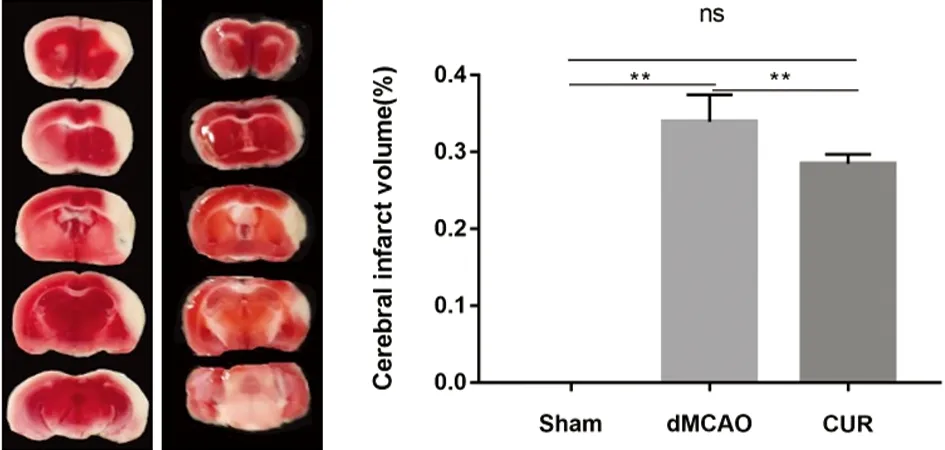
圖3 小鼠腦組織TTC染色圖、AIS體積比統(tǒng)計(jì)圖
2.4 Western blot中MCP-1及CCR2表達(dá)表達(dá)水平的改變(見圖4、圖5) 與Sham組比較,dMCAO組的MCP-1及CCR2蛋白的表達(dá)均明顯升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);dMCAO組和CUR組比較,CUR組中 MCP-1及CCR2蛋白的表達(dá)均有明顯降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。

圖4 MCP-1蛋白表達(dá)及統(tǒng)計(jì)圖

圖5 CCR2蛋白表達(dá)及統(tǒng)計(jì)圖
2.5 小鼠腦組織免疫熒光中MCP-1表達(dá)水平(見圖6) dMCAO組的小膠質(zhì)細(xì)胞及MCP-1蛋白的表達(dá)與Sham組相比,均明顯升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);dMCAO組和CUR組比較,CUR組中小膠質(zhì)細(xì)胞及MCP-1蛋白的表達(dá)均有明顯降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。

圖6 MCP-1及IBA1表達(dá)圖
2.6 炎癥因子TNF-α、IL-1β、IL-6表達(dá)水平改變 dMCAO組的TNF-α、IL-1β、IL-6表達(dá)與Sham組相比,均明顯升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);dMCAO組和CUR組比較,CUR組中TNF-α、IL-1β、IL-6的表達(dá)均有明顯降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)(見表1)。
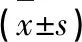
表1 TNF-α、IL-1β、IL-6表達(dá)水平
3 討 論
AIS是指由可由數(shù)種病因?qū)е碌囊环N腦血管疾病,具有發(fā)病率高、致殘率高等特點(diǎn),嚴(yán)重危及患者的健康和生命,是世界第二大死因。AIS導(dǎo)致腦血管急性阻塞和血供中斷,從而引起局部腦組織缺血、缺氧性壞死,進(jìn)而出現(xiàn)神經(jīng)功能障礙產(chǎn)生一系列臨床綜合征,嚴(yán)重影響患者生活質(zhì)量[13,14]。
小膠質(zhì)細(xì)胞是中樞神經(jīng)系統(tǒng)的巨噬細(xì)胞,對腦損傷和疾病極其敏感,在維持中樞神經(jīng)系統(tǒng)穩(wěn)態(tài)中起著重要作用[15]。小膠質(zhì)細(xì)胞在AIS后被激活,并在缺血再灌注損傷產(chǎn)生的炎癥反應(yīng)中發(fā)揮主導(dǎo)作用[16],活化的小膠質(zhì)細(xì)胞可產(chǎn)生包括炎癥因子(如TNF-α)、一氧化氮(nitricoxide,NO)等在內(nèi)的多種促炎介質(zhì)等對腦組織進(jìn)行產(chǎn)生作用[17]。
單核細(xì)胞趨化蛋白-1 (MCP-1/CCL2)是調(diào)控單核細(xì)胞和小膠質(zhì)細(xì)胞招募和激活的關(guān)鍵趨化因子之一,可以與多種受體結(jié)合,但主要通過附著在CCR2的細(xì)胞外區(qū)域來加強(qiáng)其生物學(xué)效應(yīng),它們在各種疾病的損傷和感染部位指導(dǎo)單核細(xì)胞、小膠質(zhì)細(xì)胞、記憶性T淋巴細(xì)胞的遷移和浸潤[18]。MCP-1具有促使黏附分子表達(dá)的作用,影響受損部分腦組織血供,使腦組織損傷更加嚴(yán)重。MCP-1水平升高與卒中遠(yuǎn)期風(fēng)險(xiǎn)增加相關(guān)[19]。因此,阻斷MCP-1/CCR2通路可作為治療AIS后炎癥損傷的一種重要策略。本研究表明,姜黃素顯著抑制AIS后MCP-1/CCR2的產(chǎn)生及釋放。這些說明姜黃素可能對缺血后的炎癥反應(yīng)具有重要的抑制作用。
姜黃素作為一種抗炎劑,在多種疾病模型中發(fā)揮著積極的作用。有研究表明[20],在膠原誘導(dǎo)關(guān)節(jié)炎小鼠模型中,聯(lián)合姜黃素和富含維生素D3和Omage3脂肪酸(VO)的飲食顯著增強(qiáng)了TNF,IFN-γ和MCP-1的抑制,使疾病嚴(yán)重程度降低80%,并最大限度地延遲疾病的發(fā)生和進(jìn)展。Kar等研究者發(fā)現(xiàn)[21],姜黃素和LOXblock-1通過抑制semaphorin-plexin通路減輕炎癥過程,改善缺血-再灌注誘導(dǎo)的炎癥和急性腎損傷,明顯觀察到炎癥因子,如TNF-α、IL-6和MCP-1的顯著降低。除此之外,有報(bào)道顯示[22],姜黃素在結(jié)直腸癌中也發(fā)揮重要作用,研究者使用apc突變小鼠(家族性腺瘤性息肉病模型)來評(píng)估姜黃素的效果,使用500 ppm的姜黃素處理8周可以抑制腸息肉的發(fā)展,并抑制有息肉的腸部分MCP-1和IL-6 mRNA的表達(dá)水平。研究者Boarescudeng等[23]評(píng)估姜黃素納米顆粒(CCNP)與傳統(tǒng)姜黃素(CC)對異丙腎上腺素(ISO)誘導(dǎo)的大鼠心肌梗死(MI)的影響,研究發(fā)現(xiàn)所有劑量的CC和CCNP均可發(fā)揮心肌保護(hù)作用,其中CCNP的效果最好,且CCNP能更有效地抑制心肌梗死后炎性細(xì)胞因子(TNF-α、IL-6、IL-1α、IL-1 β、MCP-1和RANTES)水平的升高,有助于限制心肌梗死后的心臟損傷。因此,我們檢測了姜黃素在AIS相關(guān)dMCAO小鼠模型中對梗死部分腦組織所產(chǎn)生炎癥發(fā)生的治療作用。我們的研究結(jié)果表明:(1)姜黃素降低AIS小鼠的神經(jīng)功能缺損評(píng)分,增加腦血流灌注,減小腦梗死體積;(2)這些功能的改善與小膠質(zhì)細(xì)胞的活化的減少,MCP-1/CCR2及炎癥因子TNF-α、IL-1β、IL-6表達(dá)的水平降低有關(guān)。
綜上所述,本結(jié)果顯示了姜黃素對AIS的保護(hù)作用。在AIS模型中,姜黃素對AIS腦組織損傷的保護(hù)作用可能是通過降低小膠質(zhì)細(xì)胞活化至減低MCP-1/CCR2的表達(dá),下調(diào)炎癥因子的水平實(shí)現(xiàn)的,本實(shí)驗(yàn)的數(shù)據(jù)也表明,姜黃素可能是一種治療急性缺血性卒中的有效藥物,但是我們的研究有一定的局限性,雖然已經(jīng)提出一些數(shù)據(jù)表明姜黃素的療效,還需要更多的劑量反應(yīng)的詳細(xì)研究,以及姜黃素是否通過其它途徑起到腦保護(hù)作用,還需進(jìn)一步研究。

