芒柄花黃素對小鼠腸道菌群結構和豐度的影響
楊翼飛,徐桂瑤,王 琴,趙倩云,羅浩銘,曾久平,吳 旭,2,李明星
1.西南醫科大學藥學院藥理系細胞治療與細胞藥物瀘州市重點實驗室(瀘州646000);2.川南醫學轉化研究院(瀘州 646000)
人體腸道內定植著數萬億的微生物群(細菌、真菌與病毒),這類被稱為腸道菌群的微生物能與宿主長期相互作用,形成“宿主—菌群”共生關系,通過參與和調控宿主一系列生命活動而影響機體的健康與疾病發展[1]。在腸道菌群中有150~170 種細菌占主導地位,并發揮著腸道結構屏障維持、免疫保護、代謝與神經調節等重要功能[2]。
異黃酮類化合物是一類廣泛存在于天然植物中的酚類化合物,具有抗炎、抗氧化、抗菌、抗病毒、抗血栓與免疫調節等作用[3-5]。芒柄花黃素(formononetin,FMN)是一種富含于豆科植物如紅車軸草等的異黃酮化合物,也是甘草、當歸、黃芪、葛根和雞血藤等中藥的活性成分之一,已被證實具有抗炎、抗氧化、抗菌和抗凋亡等多種活性[6]。目前有諸多研究結果表明,FMN能夠有效抑制生殖系統、呼吸系統和消化系統等多種惡性腫瘤細胞的增殖與生長,如乳腺癌[7]、肺癌[8]、胃癌[9]和膀胱癌[10]等。此外,已有研究指出,FMN 作為黃芪有效成分之一,是黃芪治療炎癥性腸病動物模型的主要藥效物質之一[11],同時FMN 也在利用黃芪提取物改善小鼠腸道菌群結構進而抑制結腸癌進展的研究中發揮重要作用[12]。此外,FMN作為一種潛在益生元,可以有效調節宿主代謝和降低全身系統炎癥,改善腸道菌群結構,并可通過提高乙酸和丁酸產生菌豐度緩解高脂飲食導致的肥胖[13]。然而,FMN 對宿主腸道菌群生長的直接影響研究卻鮮見報道。本文擬采用16S rRNA高通量測序技術,研究FMN對小鼠腸道菌群結構與豐度的影響,揭示含有FMN 成分的中藥對腸道菌群生長以及可能對機體健康狀況產生的影響。
1 材料與方法
1.1 實驗動物
12只無特定病原體(specific pathogen-free,SPF)級雄性C57BL/6J小鼠,6周齡,購于斯貝福(北京)生物技術有限公司,飼養于西南醫科大學SPF 級實驗動物中心。本實驗對動物的處置完全遵守對動物的倫理要求,并經西南醫科大學倫理委員會審核批準(編號:201703142)。
1.2 材料與試劑
芒柄花黃素(Solarbio,SF8070),E.Z.N.A.? soil DNA kit(Omega Bio-tek,Norcross,GA,USA),AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA),NEXTflex Rapid DNA-Seq Kit(Bioo Scientific,USA)。
1.3 主要儀器
超微量分析天秤(美國康州HZ 電子有限公司,HZK-FA210S);渦旋混勻器(德國IKA 公司,C-MAGHS7);GeneAmp PCR 儀(美國應用生物系統ABI 公司,9700);Quantus Fluorometer(美國普洛麥格Promega公司)。
1.4 實驗方法
1.4.1 動物給藥與樣品采集 將12只C57BL/6J雄性小鼠飼養于SPF 動物房,適應7 d 后,隨機分為對照組(CTRL)和給藥組(FMN),每組各6 只。給藥組小鼠每天灌服FMN,劑量為5 mg/kg(根據健康成年人每日推薦臨床劑量與小鼠之間按體表面積折算的等效劑量比值計算確定),對照組小鼠每天灌胃與給藥組相同體積的PBS。每天下午5:00~6:00 灌胃給藥,持續10 d。所有小鼠在標準條件下飼養:12 h明暗周期交替,自由取食和飲水。實驗動物中心條件保持在(23±2)℃的恒定溫度。
實驗第11 d,取各組小鼠新鮮糞便收集于無菌1.5 mL EP 管中,干冰速凍后,立即轉移于-80 ℃冰箱保存備用。
1.4.2 DNA提取及測序 將小鼠新鮮糞便用干冰運送至測序公司,根據DNA 提取試劑盒說明書的具體步驟對小鼠糞便中微生物總基因組DNA 進行提取。后續的一系列PCR擴增、PCR產物純化、檢測與定量方法如本團隊前期的研究所報道[14-15]。最后利用Illumina 公司的Miseq PE300 平臺進行微生物群落多樣性及交互式分析(上海美吉生物醫藥科技有限公司)。
1.4.3 序列處理和分析 使用Fastp 0.19.6 軟件對樣本原始測序序列進行質控,并使用Flash 1.2.11 軟件進行拼接。使用Uparse 7.0.1090,把所得序列按照97%的相似度,進行操作分類單元(operational taxonomic units,OTU)聚類,并將嵌合體剔除。利用RDP 2.11軟件對每條序列按照物種分類順序進行注釋,比對Silva 138 16S rRNA數據庫,將比對閾值設置為70%。
用Mothur 1.30.2 繪制稀釋曲線和Alpha 多樣性進行分析。通過QIIME 1.9.1 采用主坐標分析(PCoA)進行Beta 多樣性分析。利用上海美吉生信云平臺的LEfSe程序實現線性判別分析(LDA)。
1.5 統計學分析
2 結果
2.1 Alpha多樣性分析
Alpha多樣性分析是衡量物種豐度的指標,用于反映微生物群落的豐富度和多樣性。本研究主要分析Sobs、Chao、Ace 和Shannon 四個Alpha 多樣性指標,其中Sobs、Chao 和Ace 這三個指數可反映群落的物種數量豐度,值越大,微生物群落數量越豐富。Shannon 指數可衡量微生物組成的多樣性,值越大,微生物群落多樣性越高。從圖1A-1C可以看出,與對照組相比,FMN組 的Sobs、Chao 和Ace 指數值均有顯著增加(P <0.05)。由圖1D可知,FMN組較對照組Shannon指數值明顯升高(P <0.05)。
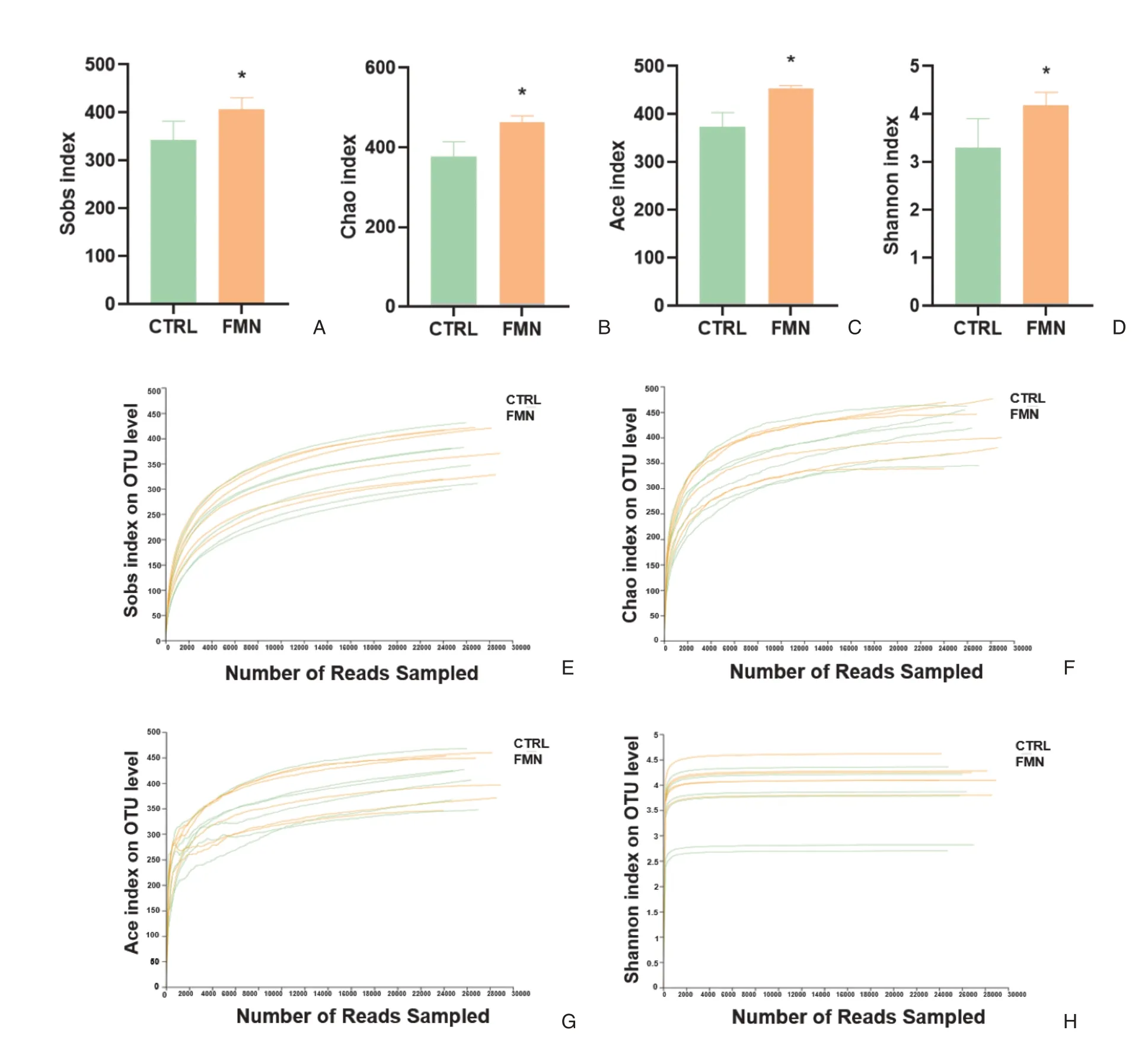
圖1 Alpha多樣性指數及稀釋曲線Figure 1 Alpha diversity indices and rarefaction curve
稀釋曲線從樣本中隨機抽取測序數據量,觀測物種數量(Sobs、Chao 和Ace 指數,圖1E-1G)和多樣性指數(Shannon 指數,圖1H)值曲線圖。由分析曲線結果可知,兩組樣本的稀釋性曲線均趨向平坦,可判斷本研究中測序數據量足夠,測序深度合理,可以準確反映本研究小鼠糞便樣本中絕大多數腸道微生物的多樣性信息,數據可以進行后續分析。
2.2 Beta多樣性分析
Beta多樣性分析可比較不同樣本間群落組成與結構的相似程度或差異關系。為進一步研究FMN 給藥干預后,FMN 組與對照組小鼠腸道菌群結構的相似程度。本研究基于樣本操作分類單元(OTU)水平對兩組的菌群多樣性數據進行主坐標分析(principal coordinates analysis,PCoA)。由圖2 可以看出,兩組菌群相對處于不同區域,且在PC2軸上有明顯差異。
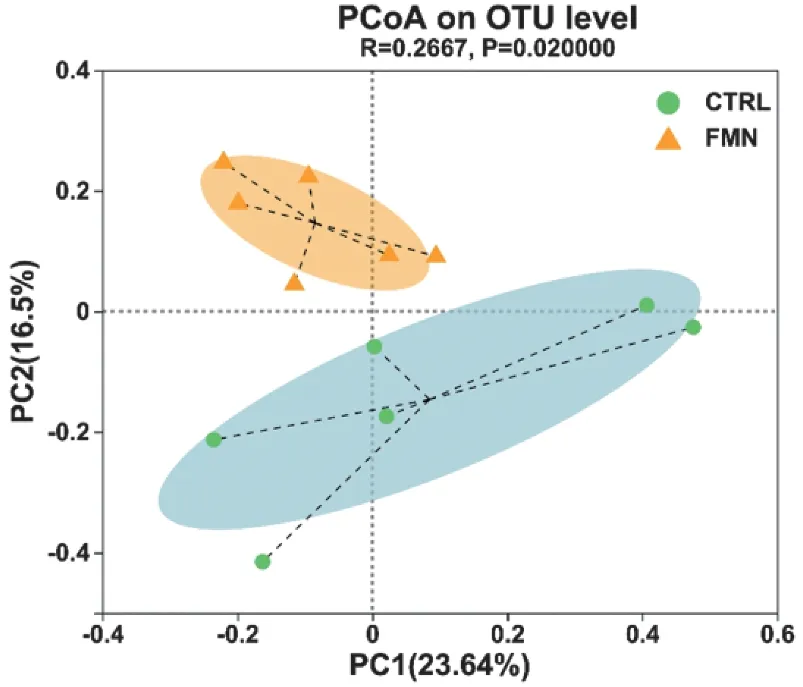
圖2 基于OTU水平的PCoA分析Figure 2 PCoA analysis based on OTU level
2.3 物種分類學分析
2.3.1 菌群構成分析Venn 圖可用于統計多樣本中不同組間所共有和其中單個樣本所獨有的物種數目,有利于直觀的展現不同樣本中物種不同分類水平組成的相似性及重疊情況。如圖3A所示,本研究根據97%的OTU序列相似度對CTRL和FMN兩組的核心OTU進行物種組成分析,對照組平均OTU 數為571,FMN組平均OTU 數為576,其中兩組共有545 個相同OTU,而有31個OTU為FMN組所特有,較對照組有所增加。
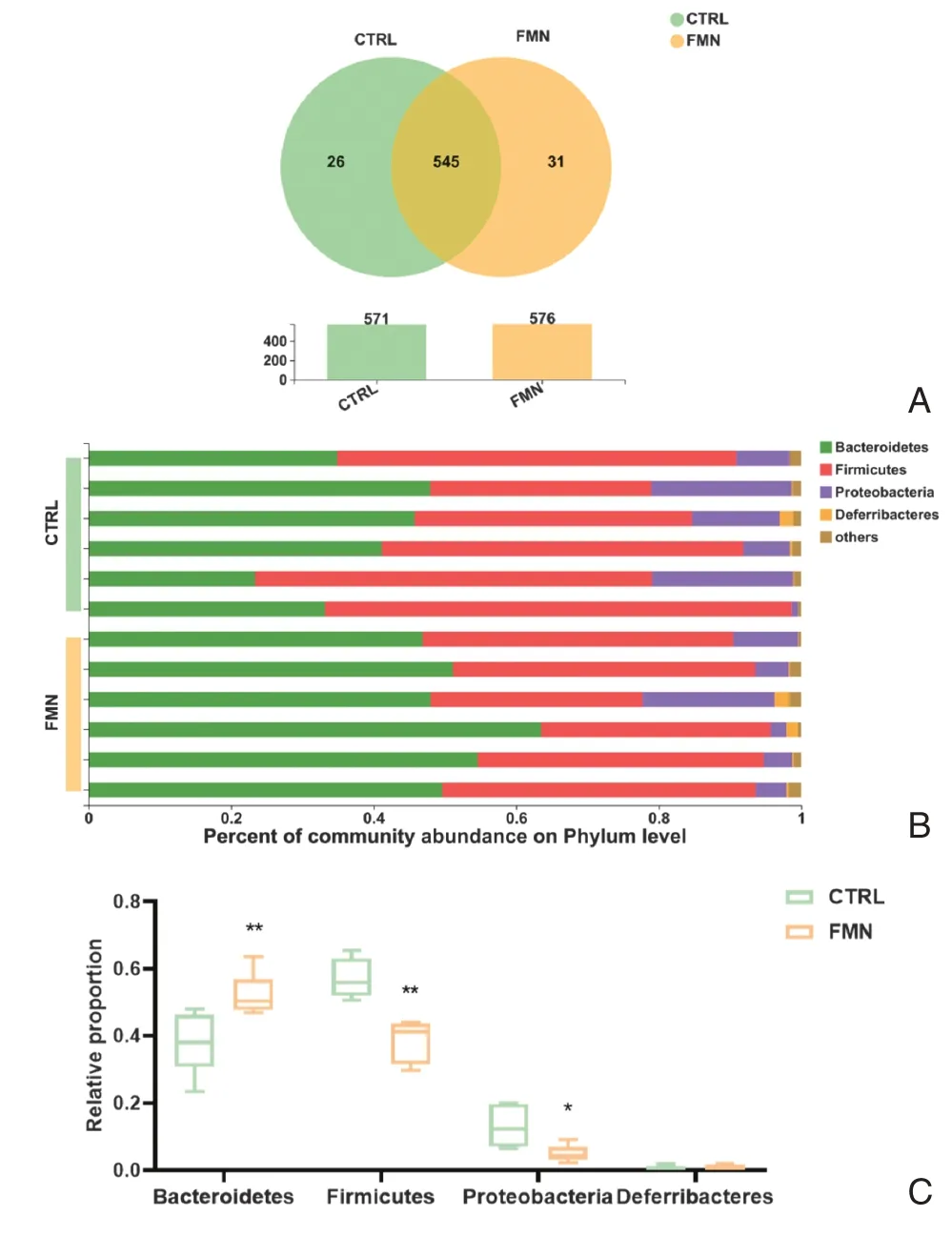
圖3 菌群構成分析Figure 3 Analysis of microbial composition
由圖3B可知,兩組樣品的菌群組成在門水平上分析主要分為4個門,分別為擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)、變形菌門(Proteobacteria)和脫鐵桿菌門(Deferribacteres),其中以擬桿菌門和厚壁菌門為主要菌門。對照組擬桿菌門和厚壁菌門比例分別為37.72%和56.92%,FMN 組對應比例分別為52.29%和38.65%。兩組主要門水平上的菌群豐度差異(圖3C)顯示,與對照組相比,FMN 組擬桿菌門豐度顯著增加(P <0.01),厚壁菌門豐度顯著減少(P <0.01),變形菌門豐度顯著減少(P <0.05),脫鐵桿菌門有上升趨勢,但無顯著性差異(P>0.05)。
2.3.2 屬水平菌群組成及物種差異性分析 在菌群屬水平(圖4A)上,FMN 組相較于對照組有7 個屬明顯增加,其中FMN 組中norank_o__Clostridiales顯著增加(P <0.01),unclassified_o__Clostridiales、顫螺旋菌屬(Oscillospira)、Odoribacter、瘤胃球菌屬(Ruminococcus)、脫鹵桿菌屬(Dehalobacterium)和unclassified_f__Helicobacteraceae均增加,差異有統計學意義(P <0.05)。
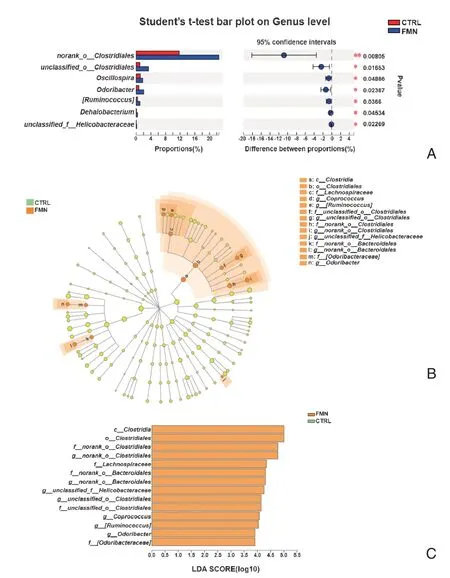
圖4 屬水平菌群組成及物種差異性分析Figure 4 Analysis of microbial composition and difference on genus level
為進一步探究芒柄花黃素對小鼠腸道菌群屬水平菌群組成的影響,確定兩組之間具有顯著差異的微生物類群,在組間進行LEfSe 分析,得到分類進化分支圖(圖4B)和LDA 評分圖(LDA >3.5,圖4C)。結果顯示,FMN 組中,梭菌目(Clostridiales,從綱到目)、毛螺菌科(Lachnospiraceae)、糞球菌屬(Coprococcus)、瘤胃球菌屬(Ruminococcus)、unclassified_o__Clostridiales(從科到屬)、norank_o__Clostridiales(從科到屬)unclassified_f__Helicobacteraceae、norank_o__Bacteroidales(從科到屬)、臭氣桿菌科(Odoribacteraceae)、Odoribacter為優勢富集菌群。
如圖5所示,與對照組相比較,FMN組中糞球菌屬(Coprococcus)(P <0.01)、瘤胃球菌屬(Ruminococcus)(P <0.05)、unclassified_o__Clostridiales(P <0.01)、norank_o__Clostridiales(P <0.01)、Odoribacter(P <0.05)和norank_o__Bacteroidales(P <0.05)豐度顯著增加,而unclassified_f__Lachnospiraceae(P <0.05)較對照組豐度顯著降低。
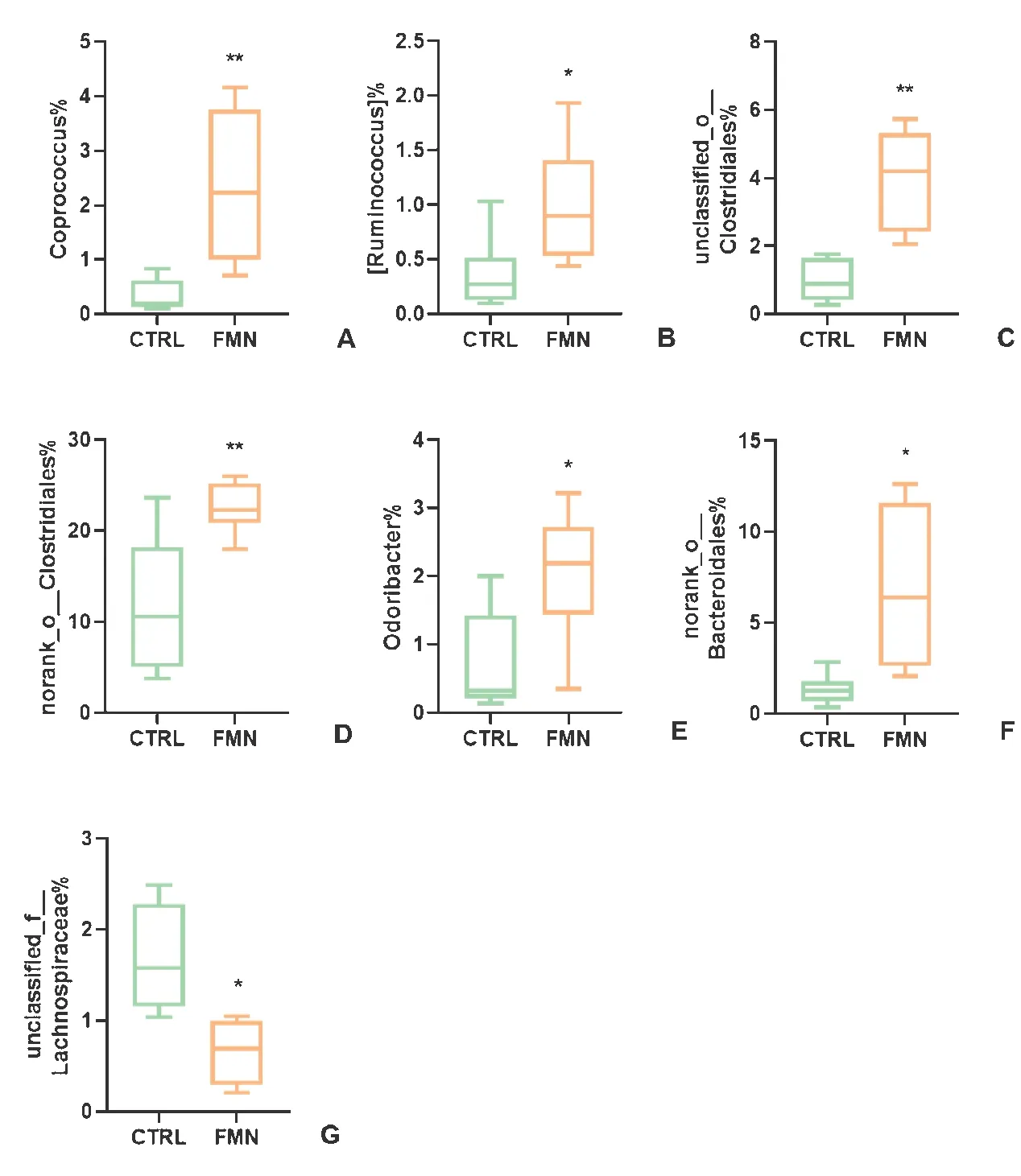
圖5 各組間主要差異關鍵菌屬Figure 5 The specific difference of key genus among the groups
3 討論
定植在宿主腸道中的數萬億的微生物群與宿主之間存在互惠互利的共生關系。宿主為腸道微生物群提供了重要的棲息地和營養物質,而腸道微生物群又通過產生有益的營養物質,如維生素[16-17]和短鏈脂肪酸(short chain fatty acid,SCFAs)[18-19]的合成能有效維持機體正常代謝和腸道免疫系統的成熟。然而,腸道微生物群穩態發生改變即菌群失調,則將會增加一系列腸道疾病風險[20-22]。因此,維護正常的腸道菌群的穩態對機體健康極其重要。
本研究基于16S rRNA 高通量測序技術,探究了芒柄花黃素對小鼠腸道菌群的影響。通過Alpha 多樣性和Beta 多樣性分析可知,芒柄花黃素在一定程度上能夠提高小鼠腸道菌群的群落多樣性及豐富度,并調節菌群結構。此外,基于門屬水平對小鼠腸道菌群結構及關鍵菌屬變化分析表明:與對照組相比,在門水平上,FMN給藥后擬桿菌門、變形菌門和脫鐵桿菌門豐度升高,而厚壁菌門豐度降低;在屬水平上,FMN組糞球菌屬、瘤胃球菌屬、unclassified_o__Clostridiales、norank_o__Clostridiales、Odoribacter和norank_o__Bacteroidales豐度增多,unclassified_f__Lachnospiraceae豐度減少。
早前研究表明,厚壁菌門的增加和擬桿菌門的減少與多種常見高發疾病的發生發展聯系密切,如炎癥性腸病[23]、肥胖與非酒精性脂肪肝[24]。糞球菌屬、瘤胃球菌屬、Odoribacter和屬于擬桿菌門的norank_o__Bacteroidales,這些腸道菌群為常見的SCFAs 的產生菌,如瘤胃球菌屬能夠產生包括丁酸鹽在內的SCFAs[25-27]。這些益生菌能夠幫助宿主分解和利用多糖,且在體內酵解作用產生的SCFAs 能為宿主提供能量,并促進腸道健康,此外,相關SCFAs的增加可以有效降低腸道炎癥風險[28-29]。Clostridiales菌屬能夠發揮抗腫瘤免疫效應從而降低結腸癌風險[30]。有文獻報導unclassified_f__Lachnospiraceae的增加與2型糖尿病、直腸癌的發生相關[31-33]。從這些主要菌群在兩組之間的變化可以看出,FMN 給藥后可使小鼠腸道有益菌群增加而潛在致病菌群減少。
異黃酮作為一類與營養、醫藥和化妝品領域相關的植物雌激素,有廣泛的藥理作用[34]。研究表明,人體每日攝入高劑量異黃酮,例如韓國人和日本人平均每天攝入30 mg異黃酮可減少代謝性疾病的發病率,尤其是肥胖[35]。臨床研究也顯示,異黃酮可極大降低更年期女性的更年期綜合癥、偏頭痛、糖尿病和高血壓等癥狀風險[36-37]。早前的研究結果都提示異黃酮對于人體健康具有潛在的保護效應。而FMN 作為一種被廣泛研究的異黃酮成分,經研究證明可促進有益菌的生長。腸道菌群作為人體肝臟以外的第二個代謝性“隱形器官”,對機體正常的新陳代謝和免疫調節至關重要[38-39]。
本研究以腸道菌群為主要切入點,探究FMN 對健康小鼠腸道菌群組成與結構的影響,揭示FMN 對腸道菌群的調節作用,結果顯示FMN 可能作為一種潛在益生元,有效調節腸道菌群,從而促進腸道微生態健康。
4 結論
芒柄花黃素可提高小鼠腸道菌群豐富度與多樣性,并改變菌群結構、增加有益菌優勢。

