鈦種植體表面構建成骨細胞特異性識別多肽緩釋系統的實驗研究
王 剛,李 思,吳雨峰,吳明月
鈦金屬及合金由于其優良的生物相容性和機械性能,已被廣泛應用于口腔種植領域,但是鈦金屬表面屬于生物惰性材料,影響了臨床骨結合的速度和質量[1]。研究[2]顯示,對鈦種植體表面進行生物化改性,可使其獲得更好的骨誘導性,植入機體后能主動與周圍骨組織特異結合,促進骨結合,實現早期良好的種植體穩定性。
緩釋系統,是指通過一定方法將生物因子與種植體表面緩釋載體結合并植入體內時,可使該生物因子持續釋放延長其作用時間。層層自組裝( layer-by-layer self-assembly,LbL) 是 Decher et al[3]于20世紀90年代所提出的一種在材料表面通過交替吸附帶相反電荷的聚電解質以形成自組裝多層聚電解質復合物(polyelectrolyte complex, PEC)薄膜的方法,通過LbL技術所形成的多層膜結構可作為生物因子的緩釋載體[4]。該研究通過LbL技術將海藻酸鈉、殼聚糖交替吸附沉積于鈦種植體表面,形成聚電解質多層膜結構并裝載成骨細胞特異性多肽,構建其緩釋系統,評價其緩釋效應,為鈦種植體表面生物化改性研究提供新的思路和方法。
1 材料與方法
1.1 材料與儀器
1.1.1實驗材料 鈦片(陜西省寶雞市泰宇鑫金屬材料有限公司);氫氧化鈉(合肥諾一生物科技有限責任公司);異硫氰酸(fluorescein isothiocyanate,FITC)熒光標記的成骨細胞特異性識別多肽(上海科肽生物科技有限公司);羥甲基殼聚糖、藻酸鈉、賴氨酸(合肥苗茁生物科技有限公司);其余一般試劑均購于國藥集團化學試劑有限公司,且試劑均為分析純。
1.1.2實驗儀器 Sirion-500場發射掃描電子顯微鏡(美國FEI公司FESEM);X射線光子能譜儀、傅里葉紅外光譜(美國Thermo-VG Scientific 公司);接觸角測量儀(成德市成慧實驗機器有限責任公司);UV-1800可見光分光光度計(日本島津公司)等。
1.2 實驗過程
1.2.1鈦表面堿熱處理 將純度99.99%、厚度0.3 mm、直徑15 mm圓形成品鈦片經400、600、800、1 000、1 200目金剛砂紙打磨光滑后,依次放入丙酮、75%乙醇溶液、去離子水中,各超聲清洗20 min。干燥后放入濃度為5.0 mol/L氫氧化鈉溶液中,烘箱中60 ℃恒溫浸泡24 h,取出鈦片,用去離子水清洗、烘干;再將鈦片加熱到200 ℃保溫2 h,自然冷卻,獲得堿熱處理鈦片,備用。
1.2.2鈦表面組裝PEC多層膜結構 將堿熱處理后的鈦片放入濃度為2.5 mg/ml多聚賴氨酸溶液中浸泡30 min,0.9%生理鹽水漂洗3次,60 ℃恒溫箱烘干10 min,從而在鈦表面獲得一層穩定的帶正電荷薄膜,并以此作為層層自組裝的啟動基礎;將烘干后鈦片放入濃度為5 mg/ml海藻酸鈉溶液中浸泡30 min,取出鈦片漂洗干燥,使其表面吸附一層帶負電荷的薄膜;隨后將其浸入5 mmol/L的氯化鈣溶液10 min,對海藻酸鈉進行交聯,漂洗干燥;最后將鈦片置入1 mg/ml殼聚糖溶液10 min,漂洗干燥,鈦表面再次吸附一層正電荷薄膜。以上步驟循環操作10次,最終獲得理想的多層聚電解質復合物多層膜,最外層為殼聚糖。
1.2.3實驗分組 實驗分為3組:光滑鈦片組(Ti組),堿熱處理組(PTi組),堿熱處理-海藻酸鈉/殼聚糖組(PTi/PSC組)。
1.2.4復合特異性多肽緩釋結構的制備 將上述3組樣品完全浸入濃度為10-5mol/L成骨細胞特異性識別多肽溶液中,浸泡 2 h后,取出鈦片,去離子水沖洗,干燥,備用。
1.2.5樣品表征及緩釋檢測 SEM觀察各組樣品表面形貌;測量材料表面接觸角分析親水性;FTIR、XPS及熒光顯微鏡對樣品表面成分進行分析;紫外分光光度計檢測樣品表面成骨細胞特異性識別多肽的釋放曲線(將上述3組樣品置于12孔板中,并分別加入1 ml PBS緩沖液,將孔板固定于恒溫搖床,溫度恒定為37 ℃,于1、2、4、8、12、24 h和2、3、4~7 d分別取出200 μl釋放液以檢測特異性多肽濃度,然后向孔板中重新加入200 μl PBS緩沖溶液)。
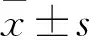
2 結果
2.1 鈦表面形貌特征掃描電鏡顯示:Ti組表面呈光滑鏡面狀,見圖1A;堿熱處理后PTi組表面呈粗糙多孔狀,見圖1B;構建多層膜結構后PTi/PSC組表面呈多孔狀,且部分孔隙被充填,形成一層不均勻膜性結構,見圖1C,該膜性結構放大至60 000倍顯示為類似立體網狀結構,見圖1D。

圖1 鈦表面形貌
2.2 材料表面親水性分析Ti組接觸角較大,顯示出一定疏水性能,見圖2A;相較于Ti組,PTi組材料表面接觸角明顯減小,親水性增強,見圖2B;加載多層膜后,PTi/PSC組接觸角較PTi組大,小于Ti組,親水性相較于PTi組有所下降,但較Ti組仍明顯改善,差異均有統計學意義(F=162.38,P<0.05),見圖2C。各組樣品接觸角角度見表1。

表1 樣品表面接觸角角度

圖2 接觸角測量圖片A:Ti組;B:PTi 組;C:PTi/PSC組
2.3 X射線光電子能譜分析結果顯示經過堿熱處理后 Ti 的特征峰強度下降,表明鈦表面形成二氧化鈦薄膜,見圖3A、3B;PTi/PSC組可見 Ti 2p減少和 N1s峰出現,表明海藻酸鈉和殼聚糖已成功修飾鈦表面,見圖3C;在400 eV,多肽修飾組N1s峰升高表明特異性多肽已成功搭載至殼聚糖-海藻酸鈉聚合多層膜內,見圖3D。

圖3 XPS分析圖譜A: Ti組;B: PTi 組;C: PTi/PSC組;D: 多肽修飾組
2.4 傅里葉紅外光譜檢測結果與Ti組相比,PTi組FTIR光譜于3 000~3 500 cm-1處出現寬峰,該吸收峰是鈦片堿熱處理后所形成的弱堿性鈦酸鹽上羥基伸縮震動造成的,表明堿熱處理后鈦表面出現了-OH特征官能團;PTi/PSC組在1 620 cm-1、1 403 cm-1處出現吸收峰,見圖4A,表明在鈦表面已成功構建殼聚糖-海藻酸鈉多層膜結構。搭載特異性多肽后,當吸收波為1 630 cm-1時,PTi/PSC組的波峰與標準多肽基本一致,證實特異性多肽已成功搭載于鈦基材表面,見圖4B。

圖4 FTIR檢測結果A-a:Ti組;A-b:PTi 組;A-c:PTi/PSC組; B-d:多肽修飾組;B-e:多肽標準光譜
2.5 免疫熒光分析3組材料表面均可見不等量的熒光,Ti組材料表面見極少量熒光分布;PTi組及PTi/PSC組表面熒光分布量較Ti組明顯增多,其中PTi/PSC組表面熒光分布量最多且均勻,證實已成功于鈦表面固定目的多肽,見圖5。

圖5 熒光分析圖片 ×200A: Ti組;B: PTi 組;C: PTi/PSC組
2.6 多肽釋放量分析由釋放曲線可見:多肽的釋放量隨著時間延長逐漸增加,釋放速度逐漸減慢。最初24 h時內,多肽釋放量迅速增加,其中Ti組最少且后續未見明顯上升,表明24 h基本完全釋放;PTi組多肽釋放速度及釋放量介于Ti組與PTi/PSC組之間,持續釋放至第4天;PTi/PSC組多肽釋放過程持續時間最長,至第7天釋放量仍持續增加,緩釋效果較其他兩組更為理想,見圖6。

圖6 特異性多肽釋放曲線
3 討論
鈦種植體表面改性的方法主要有物理方法、化學方法和生物學方法,其中運用生物學技術對種植體表面進行生物化改性成為當前的研究熱點[5]。概括而言,生物化改性就是通過組織工程學方法,將具有特異性識別功能的生物活性因子吸附到材料表面,形成一個與生物活體相適應的材料表面過渡層以控制骨整合的過程,該方法具備如下優點:① 可利用的生物活性分子有多種,包括膠原、生長因子、細胞自分泌胞外全基質、細胞識別短肽、釉原蛋白等;② 通過一定的方法,采用生物可降解材料在鈦表面構建載負生物活性分子的微結構,形成具備較好骨誘導性的種植體表面結構,促進骨結合[2,6]。本研究所選擇的生物活性分子為人成骨細胞特異性識別多肽,是通過噬菌體展示技術及噬菌體隨機肽庫篩選方法,獲得的特定多肽結構,為課題組前期研究成果,且經體內、體外系列研究均證實該多肽結構可以顯著促進骨結合[7-9]。
如何將生物活性分子與種植體結合,在鈦種植體表面構建目的因子的緩釋系統并充分發揮其活性,是鈦種植體表面生物化改性研究的重要環節。緩釋系統可以模擬體內環境,將活性因子與緩釋載體結合后植入體內以持續保持其活性并延長其作用時間,維持生物活性分子最佳的生物學功能。緩釋系統的功能有如下三個方面:① 可載負生長因子并使之與周圍組織均勻接觸;② 對周圍細胞的增殖分化具備誘導功能;③ 作為支架結構以促進組織生長[10]。目前,在鈦種植體表面吸附和釋放生物大分子的方法主要包括:物理吸附法、化學固定法、載體法[11]以及層層自組裝法。其中,層層自組裝法是目前在材料表面構建生物因子緩釋系統應用較多較為成熟的方法,已成功應用于有機材料及金屬無機材料的表面改性研究[12]。該方法具有如下優點:① 不受基材形狀的限制,制備條件簡單溫和且緩釋薄膜具有較高的熱力學穩定性;② 緩釋效果顯著,可通過調節涂層循環次數以控制涂層的量并由此實現對目的因子載負量的可控。因此,本研究采用LbL技術在鈦種植體表面構建聚電解質多層膜結構。鈦片經過堿熱處理后,表面富含帶負電荷的Ti-OH基團的鈦酸鈉凝膠,由此可作為層層自組裝的啟動基礎[13],聚賴氨酸溶液浸泡后,在Ti-OH基團的作用下,使鈦表面獲得一層穩定的正電荷薄膜,此時再將海藻酸鈉、殼聚糖在鈦表面進行交替吸附沉積,最終獲得理想的聚電解質復合物多層膜,在此多層膜基礎上搭載多肽,如此成功實現鈦種植體表面對特異性多肽良好的緩釋效應。由釋放曲線可見:光滑鈦片組多肽突釋明顯,釋放速度最快,在24 h內幾乎釋放殆盡;堿熱處理組樣品所吸附多肽釋放較光滑組變慢且持續時間也較長;相比之下,層層自組裝組樣品在3組中對多肽的緩釋效果最為理想,其釋放速度明顯慢于前兩組,雖然在前24 h內也有部分突釋,但后續釋放隨之減緩且持續時間較長,延續至第7天仍可見多肽釋放,由此可見,層層自組裝組樣品對多肽的緩釋效果最為理想。究其原因,主要是層層自組裝樣品的制備有別于前兩組,首先是在堿熱處理的基礎上,形成多孔的鈦表面結構,相較于光滑表面,該多孔結構可吸附一定量的多肽;其次,因層層自組裝樣品制備的多個循環,可以盡可能多的將多肽吸附在多層膜內;再者,層層自組裝的多層膜結構具備良好的熱力學穩定性以及半透膜性,由此,可實現載負多肽量較好的穩定性及可控性,且3組樣品中其緩釋效果最佳。
研究[14]表明,生物因子的緩釋系統應該具備以下標準:緩釋系統載體及其降解產物應為生物可吸收材料,可抑制各種病理過程,便于使用且無菌半透,有利于愈合與再生且可以作為新生組織的結構支撐。殼聚糖、海藻酸鈉是天然多糖類高分子聚合物,具備良好的生物相容性、易生物降解性及可加工成型性,目前被廣泛應用于骨組織工程領域支架材料的制備[15]。由于海藻酸鈉的分子鏈上有大量的羧基,殼聚糖分子鏈上有大量的伯氨基,因此,可以通過正負電荷的吸引形成殼聚糖和海藻酸鈉相互吸附的聚電解質膜結構[16],此類膜結構可作為生物因子的釋放載體,因此,本研究采用殼聚糖和海藻酸鈉作為構建緩釋系統的基本材料。 SEM結果顯示:PTi/PSC組表面形成一層不均勻的膜性結構,經放大后顯示為類似立體網狀結構;XPS結果也證明海藻酸鈉-殼聚糖多層膜已成功修飾鈦表面(圖3C)。以此多層膜結構作為載體,構建載負成骨細胞特異性識別多肽的緩釋系統,XPS圖譜見400 eV處多肽組N1s峰明顯升高(圖3D),同時FTIR光譜顯示,吸收波為1 630 cm-1時多肽修飾組波峰與標準多肽基本一致,均表明特異性多肽已成功復合至殼聚糖-海藻酸鈉多層膜內(圖4B)。綜上所述,本實驗結果證實在鈦種植體表面成功構建具備良好緩釋效應的多肽緩釋系統。
本研究依據生物材料表面改性理論,運用靜電自組裝技術,選擇天然可生物降解材料海藻酸鈉以及類似于細胞外多糖的天然氨基多糖殼聚糖作為生物涂層的基本成分,在活化(堿熱處理)的鈦種植體表面進行細胞外基質化的構建,形成多層膜結構,同時利用此多層膜裝載成骨細胞特異性識別多肽,由此構建成骨細胞特異性多肽的緩釋系統,實現對生物涂層量的可控和生物活性分子的緩釋,本研究構建的鈦種植體表面緩釋涂層的生物學效應尚有待相關的體外體內系列實驗進一步驗證。

