蛋白質精氨酸甲基轉移酶5在胃癌中的表達及作用研究
陳 萍,王慧之,王德強,劉駿強
胃癌的全球發病率在癌癥中居第5位,易導致患者死亡,預后不佳[1]。目前早期胃癌的診療以內鏡下手術和外科手術為主,治療可達到完全切除效果[2]。進展期患者失去了胃癌根治機會,存在轉移、復發可能,預后及生存質量遠遠不及早癌患者。
蛋白翻譯后修飾是腫瘤表觀遺傳改變研究的重要領域之一,其中甲基化、磷酸化、羥基化等修飾形式受到廣泛關注[3]。蛋白質精氨酸甲基轉移酶家族(protein arginine methyltransferases,PRMTs)被認為將甲基轉移至精氨酸殘基上,通過不同的甲基化修飾影響腫瘤細胞發生發展[4]。依據催化形成的不同產物,PRMTs家族大致分成4型,其中Ⅱ型PRMTs主要催化修飾形成對稱性二甲基,包括PRMT5和PRMT9[5]。有研究[6]表明PRMT5在肺癌細胞中高表達,促進肺癌轉移。同時有研究[7]表明PRMT5通過ERK信號通路促進肝癌細胞增殖,另外,PRMT5是乳腺癌干細胞增殖以及自我更新的重要調控因子[8],因此,PRMT5扮演著癌基因角色,以PRMT5作為靶點的分子抑制劑的抗腫瘤研究也日益增多[9]。該研究通過相關腫瘤數據庫分析PRMT5在胃癌組織中表達,體外實驗分析PRMT5在不同胃癌細胞株中的表達差異及其相關生物學作用,進而為胃癌診療提供可行性參考依據。
1 材料與方法
1.1 材料人源胃癌細胞(AGS、BGC823、SGC7901、MGC803)均來自江蘇大學醫學院實驗室細胞保存庫。質粒均由江蘇大學醫學院基礎研究所保存提供。胎牛血清購自美國Gibco公司,PRMT5抗體購自美國Santa Cruz公司,基質金屬蛋白酶2(matrix metallopeptidase 2,MMP2)、基質金屬蛋白酶9(matrix metallopeptidase 9,MMP9)、上皮間質轉化(epithelial mesenchymal transition,EMT)相關蛋白抗體以及內參抗體β-Tubulin均購自美國CST公司,蛋白Marker 以及Lipofectamine 2000轉染試劑購自美國Invitrogen公司,ECL發光液購自美國Millipore公司,CCK-8試劑盒購自上海酶聯生物研究所。
1.2 方法
1.2.1質粒轉染 將細胞消化接種培養,待其鋪滿約60%單孔面積可開始轉染。把5 μl的LipofectamineTM2000與2 μg質粒各自加進含有100 μl培養液滅菌EP管中,各自充分重懸后放置5 min,將兩者輕柔充分混合并靜置25 min。隨后吸取轉染試劑和質粒的混合液加進細胞培養板中,放入溫箱里孵育6 h。
1.2.2細胞克隆形成實驗 將細胞消化種板后放置溫箱中孵育培養,間隔2 d行半換液,約2周待細胞克隆集落出現后移去培養基,用PBS輕柔清洗,沿板壁添入提前配制的4%多聚甲醛試劑固定細胞30 min,PBS洗滌2次,控干并添加0.1%結晶紫試劑,室溫控干后在顯微鏡下拍照后計數。
1.2.3Transwell遷移實驗及侵襲實驗 將細胞消化種板后放置溫箱中孵育培養。各組消化計數 50 000 個/孔種于Transwell小室中,并以5%胎牛血清配置的條件培養基定容為200 μl,下室則以10%胎牛血清配置的條件培養基定容為800 μl。放置12 h后移出小室,使用棉簽小心擦拭上室底膜,孔內沿板壁加入多聚甲醛試劑,30 min后棄液加入結晶紫試劑,控干后將下室放在顯微鏡下計數。侵襲實驗中提前使用基質膠在小室底膜加入100 μl, 于37 ℃中靜置30 min待其凝固,剩余步驟同上。
1.2.4CCK-8實驗 將細胞消化種板后放置溫箱中孵育培養。各組消化計數1 000個/孔種在96孔板內,同時設置5個復孔。在溫箱中孵育24、48、72、96 h等不同時間段,按照說明書分別在每孔加入10 μl CCK-8試劑并在溫箱中避光培育2 h, 隨后立即測450 nm處的吸光度。
1.2.5定量PCR實驗 使用RNeasy Minikit試劑盒分離總RNA后反轉錄成cDNA。使用SYBRGreen PCR Master Mix進行實時PCR,并通過ABI Prism 7900工具進行分析。PRMT5引物正向序列為5′-CGATCAGACCTACTGCTGTCA-3′,反向序列為5′-CTCGGAGTTCCTGCGAATCT-3′;GAPDH引物的正向序列為5′-GCCACCCAGAAGCATGTGGATGGC-3′,反向序列為:5′-CATGTAGGCCATGAGGTCCACCAC-3′。
1.2.6蛋白免疫印跡法 用預冷PBS洗滌培養板,按配比加入提前煮沸的2×SDS-Loading Buffer細胞裂解液,隨后用細胞刮仔細刮下孔內貼壁細胞,將混合液體吸入準備好的EP管中,隨后將其放進100 ℃容器內5 min,瞬離EP管10 s,使用超聲破碎EP管內細胞10 s,將EP管在4 ℃、11 000 r/min離心10 min,最后標本置于冰箱冷凍后擇期盡快實驗。按照說明書準備試劑分別制備不同濃度的分離膠和濃縮膠,提前取出所需蛋白樣品室溫融化并瞬離10 s,在膠孔內加入樣本蛋白后進行電泳及轉膜。依據蛋白分子量和Marker切取所需檢測條帶,室溫下用5%脫脂奶粉封閉2 h,在目的蛋白條帶上滴加相應抗體,4 ℃下搖床過夜,次日TBST溶液清洗條帶后按配比滴加適量的二抗,將條帶放置搖床上室溫孵育2 h,用TBST溶液清洗。最后配制好一定量的顯影液,曝光條帶顯色。
1.2.7生信GEO數據庫分析 從GEO數據庫中搜索“Gastric Cancer scRNA”后下載GSE134520數據集的數據,讀入矩陣后使用Seurat工具創建對象后對其進行聚類降維,將所需數據樣本來源進行可視化,繪制成小提琴圖和直方散點圖。
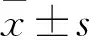
2 結果
2.1 GEO數據庫研究PRMT5在胃癌組織中表達胃癌前病變包括腸化生(intestinal metaplasia,IM)和慢性萎縮性胃炎(chronic atrophic gastritis,CAG),該研究在數據庫(www.ncbi.nlm.nih.gov/geo)讀取GSE134520數據集,該數據集分別對3例慢性非萎縮性胃炎(non-atrophic gastritis,NAG)、3例慢性萎縮性胃炎、6例腸上皮化生、1例早期胃癌(early gastric cancer,EGC)患者的胃病理組織進行單細胞RNA測序,通過該數據集的結果分析顯示PRMT5在慢性非萎縮性胃炎、慢性萎縮性胃炎至腸上皮化生逐級演變至早期胃癌中均有表達,其中在早期胃癌及胃癌前病變組織中表達較慢性非萎縮性胃炎增高,并且早期胃癌組織中表達水平最高。見圖1。
2.2 Ualcan、HPA數據庫研究PRMT5在胃癌組織中表達通過數據庫(http://ualcan.path.uab.edu)繼續研究正常胃和胃癌組織中PRMT5在mRNA表達水平,統計結果顯示胃癌組織中PRMT5在mRNA水平高于正常胃組織(圖2A),而且在不同腫瘤TNM臨床分期(Stage1~4)胃癌組織中的PRMT5在mRNA水平均高于正常胃組織(圖2B)。通過數據庫(http://Human Protein Atlas)分析PRMT5在正常胃組織和胃癌組織中的蛋白表達情況,結果顯示胃癌組織中PRMT5蛋白水平明顯高于正常胃組織(圖2C)。
2.3 PRMT5在胃癌細胞中的表達水平為了繼續探究PRMT5在胃癌發生發展中的作用,首先通過Western blot測定PRMT5在4種不同胃癌細胞(AGS、BGC823、SGC7901、MGC803)中蛋白表達水平,結果顯示,PRMT5在MGC803細胞株中表達最高,在AGS細胞株中表達最低(圖3A)。

圖3 PRMT5在胃癌組織中的表達水平
該研究在相對高表達PRMT5的MGC803細胞株中通過質粒(sh-PRMT5)敲低PRMT5表達水平,為了驗證質粒干擾效率,篩選穩轉細胞株后,通過Western blot以及Real-time PCR分別檢測PRMT5在MGC803中蛋白及mRNA表達水平,結果顯示,與對照組sh-EGFP組相比, sh-PRMT5組PRMT5細胞中蛋白及mRNA水平明顯降低(P<0.05)(圖3B)。同時在相對低表達PRMT5的AGS細胞株中通過質粒(pHA-PRMT5)促進PRMT5表達,為了驗證質粒過表達效率,篩選穩轉細胞株后,通過Western blot以及Real-time PCR分別檢測PRMT5在AGS中蛋白及mRNA表達水平,結果顯示,與對照組pHA-Venus組相比, pHA-PRMT5組細胞中PRMT5蛋白及mRNA水平明顯升高(P<0.05)(圖3C)。
2.4 PRMT5對胃癌細胞增殖的影響利用CCK-8實驗以及克隆實驗分析PRMT5對胃癌細胞增殖能力的影響。敲低PRMT5表達后,與對照組sh-EGFP相比, 實驗組sh-PRMT5組細胞增殖率明顯下降(P<0.001)(圖4A),同時sh-EGFP組(225±23)比sh-PRMT5組(128±13)細胞克隆數目減少(t=6.359,P<0.01)(圖4B)。增強PRMT5表達后,實驗組pHA-PRMT5細胞增殖率較對照組pHA-Venus明顯升高(P<0.001)(圖4C),同時pHA-PRMT5組(310±25)比pHA-Venus組(104±9)細胞克隆數目增多(t=13.43,P<0.001)(圖4D)。
2.5 PRMT5對胃癌細胞遷移與侵襲的影響利用劃痕實驗探究PRMT5對胃癌細胞遷移能力的影響。敲低PRMT5表達后24 h,sh-PRMT5組細胞遷移速度低于sh-EGFP組(t=25.98,P<0.001)。過表達PRMT5后24 h,pHA-PRMT5組中細胞遷移速度明顯高于pHA-Venus組(t=5.824,P<0.01)(圖5A)。繼續通過Transwell試驗驗證PRMT5對胃癌細胞遷移能力以及侵襲能力的影響。敲低PRMT5表達后,sh-PRMT5組細胞遷移(84±5)(t=21.17,P<0.001)及侵襲數目(108±7)(t=16.81,P<0.001)小于sh-EGFP組遷移數目(336±20)和侵襲數目(360±25)。過表達AGS細胞株PRMT5后,pHA-PRMT5組中細胞遷移(192±11)(t=22.79,P<0.001)以及侵襲(168±10)(t=24.12,P<0.001)數目大于pHA-Venus組遷移數目(38±4)和侵襲數目(26±2)(圖5B)。

圖5 PRMT5促進胃癌細胞遷移與侵襲
利用Western blot分析各組胃癌細胞中MMP2和MMP9侵襲蛋白的表達,繼續驗證PRMT5促進胃癌細胞的侵襲。結果顯示:敲低PRMT5表達后,與對照組相比,sh-PRMT5組細胞MMP2和MMP9侵襲蛋白表達水平下降。而增強表達PRMT5后,與對照組相比,pHA-PRMT5組細胞MMP2和MMP9侵襲蛋白表達水平升高(圖5C)。
2.6 PRMT5對胃癌EMT的影響利用Western blot實驗檢測PRMT5對胃癌上皮細胞相關蛋白和間質細胞相關蛋白表達影響。實驗結果顯示,與sh-EGFP組相比, 敲低PRMT5表達后sh-PRMT5組N-cadherin、β-catenin、Vimentin等間質細胞相關蛋白表達明顯下降,而上皮細胞蛋白E-cadherin表達水平上升(圖6A);同時與pHA-Venus組相比, 過表達PRMT5后pHA-PRMT5組N-cadherin、β-catenin、Vimentin等間質細胞相關蛋白表達明顯升高,而上皮相關蛋白E-cadherin水平明顯下降(圖6B)。結果顯示,PRMT5可以促進胃癌細胞EMT過程。

圖6 Western blot檢測PRMT5對胃癌細胞EMT相關蛋白表達影響A:MGC803;B:AGS
3 討論
胃癌一直是威脅人類生命健康的嚴重疾病之一,雖然近年因生活條件的改善,內鏡檢查需求較前增多,胃癌患病率及病死率較前有所下降,5年生存率相對升高,但由于胃癌患者早期僅有噯氣、飽脹等不典型臨床表現,同時部分患者對內鏡檢查存在恐懼心理,當患者出現腹痛加重、嘔血黑便、體質量明顯減輕等嚴重癥狀時,往往已錯過最佳手術診療時期且預后差,由此可見早期胃癌的診斷尤其重要。臨床中除傳統的放療化療外,免疫治療、分子靶向治療、術前新輔助治療等手段也發揮重要作用。胃癌的局部進展以及轉移一直是學術界關注的焦點,其相關的蛋白以及分子靶點具有一定的研究潛力。PRMT5是一種將精氨酸殘基催化形成對稱二甲基化的相關蛋白,在家族中屬于Ⅱ型。近年來研究顯示該蛋白在不同腫瘤的發生發展中具有重要作用,如肺癌[10]、乳腺癌[11]、肝癌[12]、胰腺癌[13]。作為熱點腫瘤癌基因,可繼續研究其在胃惡性腫瘤發生演變中的作用。該研究首先通過生信分析顯示PRMT5在早期胃癌組織中表達較慢性萎縮性胃炎以及腸化生癌前病變組織表達升高,通過不同數據庫檢索,與正常胃黏膜組織進行比較后顯示,各個胃癌分期組織中PRMT5在mRNA以及蛋白表達水平升高,由此該實驗提出假說PRMT5在胃癌的演變進展機制中具有相關作用。通過Western blot測定PRMT5在4種不同胃癌細胞中蛋白表達水平,由此該實驗選出PRMT5表達量較高的MGC803細胞株與表達量較低的AGS細胞株。隨后該實驗在MGC803細胞株中通過質粒(sh-PRMT5)敲低PRMT5表達水平并在AGS細胞株中通過質粒(pHA-PRMT5)促進PRMT5表達。穩定篩選及轉染質粒后,該實驗利用CCK-8與成克隆形成實驗顯示PRMT5具有提升胃癌細胞的增殖能力。同時在相關實驗中表明PRMT5具有提升胃癌細胞的遷移能力和侵襲能力。該研究通過對胃癌細胞EMT相關上皮間質蛋白進行檢測顯示,PRMT5可以促進胃癌細胞EMT過程。
綜上所述,該研究闡明了PRMT5對胃癌細胞具有促進其增殖、遷移、侵襲以及EMT能力,在胃癌的早期診斷以及預后評估中,PRMT5也有很好的研究前景,其相關機制仍需進一步研究。

