人牙源性間充質干細胞成骨分化潛能的比較
付貴強,鄒多宏,2
骨缺損是一種骨質缺失導致骨不連或不愈合進而引起功能障礙疾病[1]。引起骨缺損常見的原因有創傷、炎癥和腫瘤等[2]。一般輕微的骨缺損可以由自身組織修復再生,但是嚴重骨缺損超越了自身愈合的極限,必須采用骨移植或生物材料促進缺損修復。因此,開發一種新型骨移植系統,包括理想的支架材料及優異的種子細胞[3]等,在組織工程中尤為重要。間充質干細胞是組織工程中最有潛力的種子細胞。隨著研究的深入,越來越多的口腔來源間充質干細胞被發現[4],這些干細胞與骨髓間充質干細胞有著類似的細胞表面標志物、克隆增殖能力和多向分化潛能,已被研究應用于骨、血管、神經等疾病。
人根尖乳頭干細胞(human apical papilla stem cells,SCAPs)、牙髓間充質干細胞(dental pulp mesenchymal stem cells,DPSCs)和牙槽骨間充質干細胞(alveolar bone mesenchymal stem cells,ABMMSCs)取材便宜、易培養,能夠穩定傳代擴增,可以作為骨組織工程中優異的種子細胞庫。為了研究三者之間的差異,該實驗通過衰老檢測、細胞增殖實驗、成骨誘導后染色和成骨相關基因檢測來研究3種細胞之間的異同。
1 材料與方法
1.1試劑與儀器Ⅰ型膠原酶(美國西格瑪公司), 胎牛血清(中國賽默飛世爾科技有限公司),青-鏈霉素、ALP染色試劑盒(上海碧云天生物技術有限公司),0.25%胰蛋白酶(上海碧云天生物技術有限公司),CD24、CD90、CD34、CD73(美國博奧派克生物科技有限公司),RNAiso Plus(北京寶日醫生物技術有限公司),CCK-8試劑(日本同仁化學研究所),成骨誘導培養基(蘇州賽業生物科技有限公司),SYBR Green master mix(上海弈圣生物科技有限公司),LightCycler 96(瑞士羅氏公司),酶標儀(美國賽默世爾科技有限公司)。
1.2 細胞分離與培養供體年齡為14~20歲,采用來自第3磨牙的健康牙齒和牙槽骨。將牙根面牙髓組織、根尖乳頭組織用磷酸鹽緩沖液(PBS)沖洗后剪成小塊,分離培養DPSCs和SCAPs。用3 mg/ml Ⅰ型膠原酶消化,在37 ℃下孵育40 min。1 200 r/min離心5 min,重懸于含20%胎牛血清和100 U/ml青-鏈霉素的α-MEM培養基中。隨后將牙槽骨夾碎成小塊,接種在上述培養基的培養皿中。將細胞在37 ℃含5% CO2的細胞培養箱中孵育。在約80%融合時,用0.25%胰蛋白酶消化分離細胞,并按1 ∶3傳代。培養基每3 d更換1次,取第3代細胞進行實驗。
1.3 流式檢測用胰蛋白酶消化收集第3代細胞,1 200 r/min離心5 min,然后用PBS重懸細胞轉移到測試管中。使用FITC偶聯CD24、CD90和PE偶聯CD34、CD73以及相應的同型抗體作為對照,避光孵育30 min,收集到流式細胞儀中,用CytExpert軟件對結果進行分析。
1.4 細胞衰老檢測當第2代細胞生長至90%時,胰酶消化離心。新鮮培養基重懸計數,按照2×105個/孔的密度將細胞接種在6孔板中。待細胞生長至90%時吸棄培養基,PBS清洗2次,加入RNAiso Plus裂解細胞,提取RNA。
1.5 細胞增殖當第2代細胞生長至90%時,胰酶消化離心。新鮮培養基重懸計數,按照1 500個/孔的密度將細胞接種在96孔板中,設置3個復孔,每孔加入10 μl的CCK-8試劑37 ℃孵育2 h,接種細胞24 h后用酶標儀檢測450 nm波長下的吸光度,連續檢測7 d,繪制生長曲線。
1.6 成骨分化在6孔板中以2×105個/孔接種3種細胞,用含10%胎牛血清的α-MEM培養,當細胞達到60%融合時,更換成骨誘導培養基,每3 d更換新鮮的培養基,誘導14 d。
1.7 ALP染色和茜素紅染色成骨誘導7 d后,按照ALP染色試劑盒染色,PBS清洗2次,加入染色固定液固定15 min,PBS清洗2次,加入染色液,避光孵育10 min后PBS清洗2次。使用掃描儀捕捉數字圖像。吸棄培養基,PBS清洗2次,加入RNAiso Plus裂解細胞,提取RNA。
1.8 茜素紅染色誘導成骨14 d后,PBS清洗2次,加入染色固定液固定15 min,PBS清洗2次,加入染色液染色5 min,PBS清洗2次。使用掃描儀捕捉數字圖像。吸棄培養基,PBS清洗2次,加入RNAiso Plus裂解細胞,提取RNA。
1.9 提取RNA和實時熒光定量PCR(qRT-PCR)用RNAiso Plus提取RNA。使用酶標儀檢測RNA濃度和純度。用Yeasen逆轉錄試劑盒合成cDNA,使用SYBR Green master mix和LightCycler 96進行qRT-PCR。引物序列在表1中列出。各基因的相對表達量以GAPDH RNA歸一化得到的2-ΔΔCt值作為對照。

表1 qRT-PCR引物序列
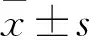
2 結果
2.1 SCAPs、DPSCs和ABMMSCs的細胞形態提取3種細胞的原代,在培養基中傳代擴增,用倒置顯微鏡觀察P0和P3代細胞形態。P0代細胞從組織塊中爬出,成放射狀生長,細胞的形態類似成纖維細胞,長梭形,密度較高時表現為漩渦狀。傳代后細胞形態光滑,繼續保持成纖維細胞樣外觀,3種細胞的形態無明顯差異。見圖1。

圖1 SCAPs、DPSCs 和 ABMMSCs原代和P3代細胞的形態特征 ×40
2.2 流式結果分析數據顯示內皮細胞和造血干細胞表面標志物CD24和CD34為低表達,而間充質干細胞表面抗原標志物CD73和CD90呈現高表達(圖2)。該結果表明提取的3種細胞均為間充質干細胞,細胞免疫表型無明顯差異。

圖2 SCAPs、DPSCs 和 ABMMSCs 表面抗原標志物的表達
2.3 衰老相關基因檢測圖3顯示qRT-PCR檢測結果表明,衰老相關基因p16(F=3.386,P=0.103 7)、p21(F=4.004,P=0.078 6)、p53(F=1.997,P=0.216 4)在3種細胞的表達差異無統計學意義。說明體外培養的P2代3種細胞狀態良好,無衰老差異。

圖3 3種細胞衰老相關基因的表達
2.4 患者SCAPs、DPSCs和ABMMSCs增殖能力曲線用P3代的SCAPs、DPSCs和ABMMSCs連續測量7 d的吸光度,如圖4顯示,3種細胞在前3 d的生長能力相似,但在5 d后DPSCs和SCSPs的增長能力明顯高于ABMMSCs,且SCAPs的生長快于DPSCs,說明SCAPs具有很強的生長潛力,而ABMMSCs的增殖能力較弱,見圖4。5 d(F=105.5,P<0.000 1),6 d(F=26.53,P<0.001),7 d(F=197.4,P<0.000 1)。

圖4 第三代SCAPs、DPSCs和ABMMSCs的增殖曲線
2.5 成骨誘導和相關基因檢測成骨誘導7 d后進行ALP染色,ABMMSCs的藍色范圍最廣,染色最深,DPSCs次之,SCAPs染色最淺(圖5A)。誘導3周后茜素染色與7 d的ALP 染色一致,ABMMSCs紅色最深,SCAPs與其他2種細胞相比染色較少(圖5B),且在顯微鏡下觀察細胞形成紅色礦物質結節,ABMMSCs明顯多于SCAPs和DPSCs(圖6)。qRT-PCR結果表明成骨誘導7 d和14 d后ALP、OSX、COL-1、OCN、OPN在ABMMSCs中的表達均高于其他2種細胞,DPSCs次之,SCAPs中上述成骨基因的表達在3種細胞中的表達最低(圖7)。ALP(F=523.8,P<0.000 1),OSX(F=21.17,P<0.001 9),COL-1(F=51.35,P<0.000 2),OCN(F=638.6,P<0.000 1),OPN(F=2 659,P<0.000 1)。

圖5 3種細胞成骨誘導7 d和14 d后ALP和茜素紅染色A:ALP染色;B:茜素紅染色

圖6 茜素紅染色鏡下觀察 ×40

圖7 qPCR定量檢測成骨誘導7 d和14 d后成骨相關標志物表達
3 討論
間充質干細胞在再生醫學骨組織工程的相關研究中已得到了廣泛的應用[5-10]。但不同的間充質干細胞有著不同的分化潛能和特性,因此挑選合適的干細胞作為種子細胞尤為重要。
該實驗主要研究作為骨組織工程的種子細胞SCAPs、DPSCs和ABMMSCs 在體外生物學特性方面之間的不同。將來自14~20歲供體的牙齒和牙槽骨通過酶消化-組織塊法提取原代SCAPs、DPSCs和ABMMSCs。經過體外傳代培養后,細胞生長旺盛,類似成纖維細胞,形態均一穩定。流式細胞術檢測造血干細胞表面標志物CD34陰性,CD90和CD73陽性率高達90%以上。說明此方法分離得到的細胞符合間充質干細胞的標準。
骨組織工程需要大量的細胞,因此,細胞狀態和增殖能力關系到其在組織工程中的治療效果。細胞衰老是指細胞出現持續性的周期阻滯[11],其中衰老相關標志物p53、p21、p16發揮重要的作用。腫瘤抑制因子p53介導的DNA損傷反應(DDR)通路在細胞對基因組不穩定性的內在反應中發揮重要作用,包括短暫的細胞周期阻滯、衰老和凋亡,p21和p16作為一種細胞周期依賴性激酶抑制劑阻礙細胞周期加速衰老進程[12-13]。該實驗通過qRT-PCR檢測了3種細胞的衰老相關標志物p53、p21、p16的表達,結果顯示3者之間無顯著差異,表明P2代的3種細胞之間狀態一致。貼壁培養后連續7 d檢測3種間充質干細胞的增殖能力。結果顯示所有間充質干細胞在第3天均達到對數生長期,此后快速生長,SCAPs生長速度最快,DPSCs次之,ABMMSCs生長最慢。
作為骨組織工程的種子細胞,其成骨分化能力也發揮重要的作用。為了進一步探究SCAPs、DPSCs和ABMMSCs 3種細胞成骨能力的差異,該實驗設計了體外成骨誘導實驗。成骨誘導7 d后,ALP染色可見,ABMMSCs的染色范圍最廣,顏色最深,其次是DPSCs,SCAPs的染色最淺。誘導14 d后進行茜素紅染色,與ALP染色一致,ABMMSCs染色最強,SCAPs染色最弱。鏡下觀察在成骨誘導過程中細胞外基質形成礦物質結節,其中ABMMSCs形成的鈣結節最多,對成骨分化誘導最為敏感。ALP、OSX、COL-1、OCN、OPN是成骨分化過程中重要的調控因子[14-15]。通過在轉錄水平上分析這些標志物的表達進一步探究三者之間成骨分化的能力。ALP是成骨細胞合成礦化骨基質的早期經典標志物,是反映成骨分化程度的良好指標;成骨分化過程中的關鍵調節因子OSX特異性表達于成骨細胞,并調控成骨標志物的表達;Ⅰ型膠原COL-1是骨基質中主要的膠原成分;骨鈣素(OCN)、骨橋蛋白(OPN)是成骨后期指標;這些因子可以相互協同共同促進成骨分化。qRT-PCR檢測顯示, 7 d成骨誘導后ABMMSCs中ALP 的表達水平最高,SCAPs最低,隨著誘導至14 d,差異更加顯著,OSX和COL-1也表現出類似的趨勢。晚期指標OCN和OPN在14 d誘導后達到較高水平,且ABMMSCs和DPSCs中的表達量顯著高于SCAPs。
以上研究結果表明,口腔來源的3種細胞體外培養擴增后狀態良好,均可保持穩定的增殖能力。SCAPs相比DPSCs和ABMMSCs更容易生長擴增,但是體外成骨誘導后顯示,ABMMSCs的成骨能力較強,表明該細胞治療骨相關疾病更有效,是骨組織工程最為理想的種子細胞。該結果為臨床上培養和選用種子細胞提供了理論支持,未來還需要開展更多的體內研究為最佳種子細胞的臨床應用奠定基礎。

