蔬菜栽培土壤中沙門菌熒光定量PCR檢測方法
呂新,劉蘭英,李玥仁
1.福建省農業科學院農業質量標準與檢測技術研究所(福州 350003);2.福建省農產品質量安全重點實驗室(福州 350003)
沙門菌是全球范圍內最重要的幾種食源性致病菌之一,由其引起的食物中毒占細菌性食物中毒病例的前2位[1]。據世界衛生組織不完全統計,每年至少有1 600萬沙門菌感染病例,導致約60萬人死亡。僅在2005—2011年間,國外發生的19件蔬菜因食源性致病菌污染而導致的食物中毒事件,其中11件的元兇是沙門菌[2]。在我國沙門菌也是最主要食源性致病菌,其中80%左右的細菌性食物中毒事件為沙門菌污染所致[3],國內已發現多種蔬菜中存在沙門菌污染風險[4-6]。農產品產地環境的質量安全是農產品質量安全的前提,蔬菜產地環境包括大氣、灌溉水源和栽培土壤等因素,其中栽培土壤又是產地環境中最重要因素之一,蔬菜的沙門菌污染可能發生在從農田到餐桌的每個環節[7-8],近年來,隨著對蔬菜供應鏈每個環節中沙門菌污染風險和來源的深入研究,研究發現蔬菜沙門菌污染主要還是發生在栽培環節中,尤以栽培土壤中沙門菌污染而導致蔬菜二次污染為甚,這也是防控蔬菜沙門菌污染重要節點[8-12]。
沙門菌檢測所采用的GB 4789.4—2016《食品安全國家標準 食品微生物學檢驗 沙門氏菌檢驗》[13],主要包括沙門菌疑似菌落篩選和生化試驗鑒定,整個檢測過程不但步驟繁瑣而且耗時費力,從樣品開始檢測到最終檢測結果取得需要5~7個工作日,難以滿足大規模樣品檢測需求,且最終檢測結果也僅為定性分析難以定量分析。而實時熒光定量PCR(quantitative real-time PCR,qPCR)方法則可以完美解決上述問題,已被應用于沙門菌、副溶血弧菌、陰溝腸桿菌、蠟樣芽孢桿菌、單核細胞增生李斯特菌等病原菌的分析檢測[14-20],但國內尚未見有關蔬菜栽培土壤中沙門菌定量檢測方法的研究報道。qPCR方法包括探針法和嵌合熒光法,其中嵌合熒光法以使用SYBR Green I熒光染料為主,其原理是SYBR Green I作為一種具有綠色激發波長的熒光染料,主要結合于雙鏈DNA(dsDNA)雙螺旋小溝區域,在游離狀態下SYBR Green I不會散發熒光信號,但當與雙鏈DNA結合后其熒光信號將顯著增強,其熒光信號強度與雙鏈DNA的數量呈正比,因此可利用SYBR Green I熒光信號強弱變化監測PCR體系中雙鏈DNA的數量。試驗以沙門菌特有侵襲蛋白A(invasion protein A)基因為靶基因,建立基于SYBR Green I嵌合熒光法的沙門菌實時熒光定量PCR檢測方法,可滿足蔬菜栽培土壤中沙門菌污染的定量檢測技術需求,以期為蔬菜產地環境中沙門菌污染的防控和蔬菜質量安全的提升提供技術支撐。
1 材料與方法
1.1 材料與試劑
胰蛋白胨大豆瓊脂(TSA)、蛋白胨緩沖水(BPW)、胰蛋白胨大豆肉湯(TSB)、無菌均質袋(北京陸橋技術有限責任公司);TB Green?Premix Ex TaqTM(Tli RNaseH Plus,日本寶生物公司);細菌基因組DNA提取試劑盒(北京天根公司);FastDNA?Spin Kit for Soil土壤提取試劑盒(美國MP Bio公司);NaCl(分析純,阿拉丁公司);熒光定量PCR八聯管(無錫Nest公司)。
供試土壤樣品采自福州市閩清縣東橋鎮綠輝蔬菜種植農場,按五點采樣法采集0~20 cm土壤表層樣品,混合均勻后置無菌袋中放置在4 ℃冷藏箱中運回,挑出植物根系、石頭等雜物,土壤理化指標測定前過2 mm篩網。具體土壤理化指標:土壤類型為黃紅壤,0~20 cm土層pH 5.31,有機質含量16.61 g/kg,堿解氮含量126.54 mg/kg,速效磷含量18.25 mg/kg,速效鉀含量113.79 mg/kg。
1.2 儀器與設備
實時熒光定量PCR儀(BIO-RADTMCFX96 Touch,美國伯樂公司);核酸提取儀(FastPrepTMFP120,美國MP Bio公司);拍擊式均質器(easyMixTM,法國AES Chemunex公司);臺式離心機(Sigma 1-14,德國希格瑪公司);恒溫培養箱(DHP-9082,上海一恒科學儀器有限公司);核酸蛋白定量儀(Qubit 2,美國Thermo Scientific公司);超凈工作臺(C2HJH-C1112B,上海智城公司)。
1.3 菌株
供試的7個菌株微生物菌株除鼠傷寒沙門菌為陽性對照菌株外,其余6個菌株均為試驗的干擾菌株,菌株來源分別為中國工業微生物菌種保藏管理中心(CICC)、中國普通微生物菌種保藏管理中心(CGMCC)和美國典型培養物保存中心(ATCC)。具體菌株編號及來源等信息見表1。

表1 供試菌株
1.4 試驗方法
1.4.1 引物設計
根據沙門菌侵襲蛋白A(invA)基因(Genbank Accession:M90846.1),使用Primer Premier 5.0軟件設計1對qPCR引物invA-U/invA-D用于沙門菌實時熒光定量檢測。檢測引物交由生工生物工程(上海)股份有限公司合成。具體檢測引物序列見表2。
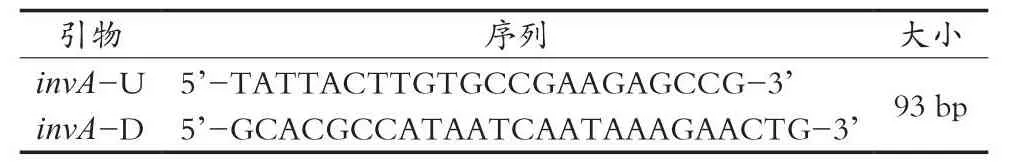
表2 qPCR擴增引物
1.4.2 沙門菌計數及基因組DNA提取
沙門菌計數。將-70 ℃保存的沙門菌菌株在TSA平板內劃線后,置37 ℃培養箱倒置培養16~24 h,在5 mL TSB液體培養基中使用無菌牙簽挑取TSA平板內的單個沙門菌菌落進行接種,置37 ℃、160 r/min振蕩培養16~24 h后,取1 mL振蕩培養的TSB液體培養基轉接于新的100 mL TSB液體培養基中,在37 ℃、160 r/min振蕩養至A600=0.55的對數生長期。以10倍濃度梯度將對數生長期菌液進行稀釋后,吸取100 μL稀釋液在TSA平板上進行涂布,置37 ℃培養18~24 h后計數。
沙門菌基因組DNA提取。吸取1 mL沙門菌培養菌液,在臺式離心機上按12 000 r/min離心4 min,吸棄上清液,菌體沉淀使用細菌基因組DNA提取試劑盒按步驟進行提取。使用Qubit 2測定DNA濃度后,置于-20℃保存備用。
1.4.3 qPCR反應體系和反應條件優化
分別對qPCR反應體系和反應條件中的引物濃度、退火溫度進行優化,其中:引物濃度分別為0.1,0.2,0.4,0.6,0.8和1.0 μmol/L;退火溫度分別設置55,56,57,58,59,60和61 ℃。每個因子設置3個重復,同時以無菌水為模板設置陰性對照,利用Bio-Rad CFX Manager軟件進行數據分析,以擴增曲線獲得最小的Ct值和熔解曲線不產生非特異性擴增峰為指標,確定最佳引物濃度和退火溫度。
1.4.4 qPCR反應特異性檢測
以鼠傷寒沙門菌為陽性對照菌株、金黃色葡萄球菌等6個菌株為干擾菌株,使用細菌基因組DNA提取試劑盒提取各菌株DNA,對沙門菌qPCR反應進行特異性分析。采取已優化的qPCR反應體系和條件進行分析,以管內熒光信號強弱變化來判斷陰陽性,陽性管內具有明顯的熒光擴增曲線,陰性管內則沒有明顯的熒光擴增曲線。每個菌株DNA模板均設置3個重復,同時以無菌水為模板設置陰性對照。
1.4.5 qPCR反應靈敏度檢測
將沙門菌DNA按10倍遞減方式稀釋至1×104,1×103,1×102,1×101,1,0.1和0.01 pg/μL 7個濃度,以上述DNA為模板對沙門菌qPCR反應靈敏度進行檢測。反應結束后,陽性管內具有明顯的熒光擴增曲線,陰性管內則沒有明顯的熒光擴增曲線。每個濃度的DNA模板均設置3個重復,同時以無菌水為模板設置陰性對照。
1.4.6 標準曲線的建立
取6份10 g無沙門菌污染的栽培土壤樣品,加入0.5 mL不同濃度的沙門菌菌液,制備沙門菌濃度分別為2,20,200,2×103,2×104和2×105CFU/g的土壤樣品,全部轉移至含90 mL蛋白胨緩沖水的均質袋中,將均質袋放置在拍擊式均質器中拍打1~2 min混勻,置37 ℃的恒溫培養箱中增菌4 h。增菌后重新混勻樣品,吸取1 mL混勻土壤樣品至FastDNA?Spin Kit for Soil試劑盒中的土壤裂解管中,按12 000 r/min離心3 min,吸棄上清液,在FastPrepTMFP120核酸提取儀上按操作說明提取土壤微生物總DNA,用于栽培土壤中沙門菌的標準曲線建立。
以不同濃度沙門菌提取的DNA作為定量標準品,利用優化的qPCR方法檢測各濃度標準品的Ct值,以不同濃度沙門菌對數值為橫坐標,qPCR擴增Ct值為縱坐標,建立Ct值與不同濃度沙門菌對數值線性函數關系的定量標準曲線。
1.4.7 蔬菜栽培土壤中沙門菌污染對比檢測
采用qPCR方法和GB 4789.4—2016《食品安全國家標準 食品微生物學檢驗 沙門氏菌檢驗》,分別對采自全省的35份栽培土壤樣品中沙門菌污染情況進行檢測,驗證所建立的qPCR方法應用于蔬菜栽培土壤中沙門菌污染檢測的準確性。
2 結果與分析
2.1 qPCR方法的建立
分別對qPCR反應體系和反應條件中引物濃度、退火溫度進行優化,確定qPCR檢測最佳反應體系25 μL,包括12.5 μL 2×TB GreenPremix Ex Taq(Tli RNaseH Plus),0.2 μmol/LinvA-U,0.2 μmol/LinvAD,DNA模板1 μL,滅菌水補足至25 μL體積。優化退火溫度后反應條件:95 ℃/30 s,95 ℃/5 s,56 ℃/30 s和72 ℃/30 s,擴增40個循環。優化的qPCR方法反應結果如圖1所示,其熒光擴增曲線實時反映PCR的指數增長期和平臺期,且熔解曲線只有單一擴增峰,未見非特異性擴增峰。
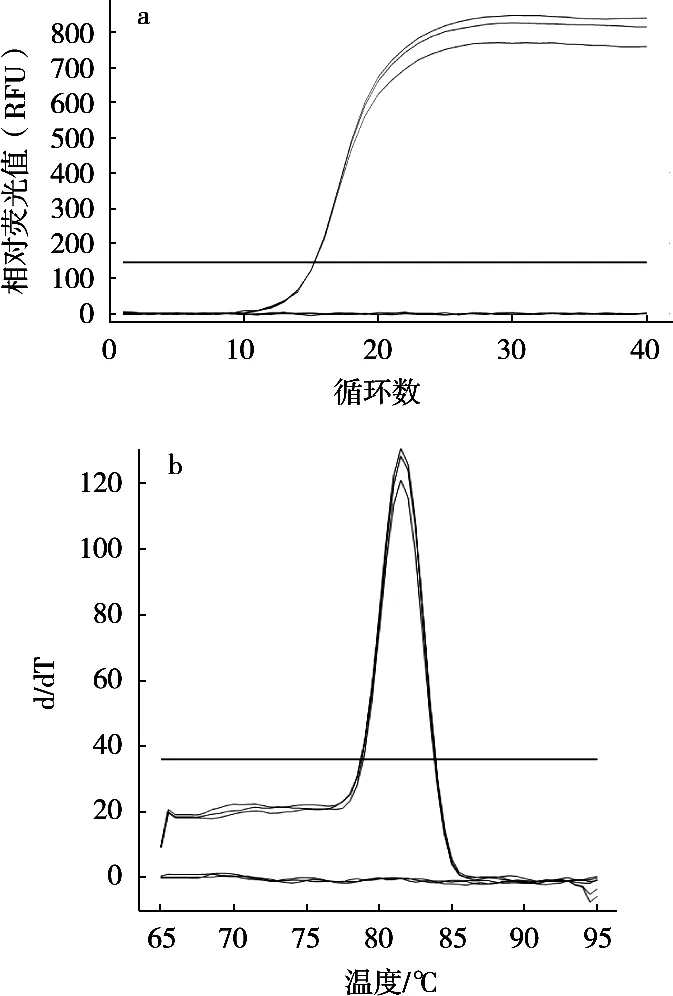
圖1 qPCR方法檢測沙門菌
2.2 特異性檢測結果
采用優化的qPCR方法,以鼠傷寒沙門菌、大腸埃希菌O157:H7、金黃色葡萄球菌、單核細胞增生李斯特菌等7個菌株DNA為模板進行特異性分析,結果顯示,除鼠傷寒沙門菌能產生明顯的熒光擴增曲線,且呈現陽性結果,其余大腸埃希菌O157:H7等6個干擾菌株DNA及無菌水陰性對照均無明顯熒光擴增曲線產生,均呈現陰性結果(圖2)。試驗表明所建立的qPCR方法具有良好的特異性。
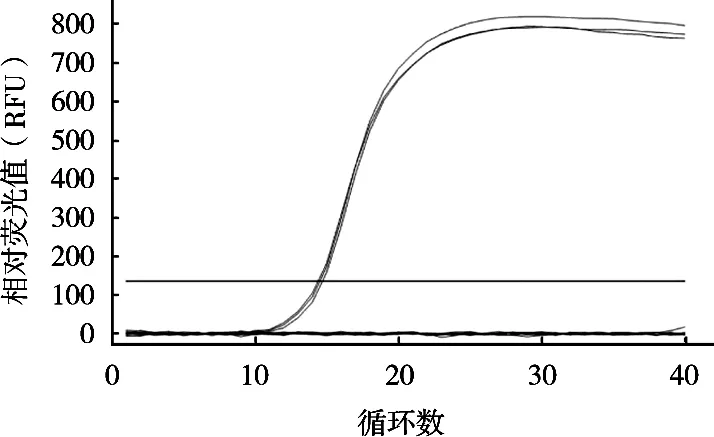
圖2 qPCR方法檢測沙門菌的特異性
2.3 靈敏度檢測結果
使用7個不同濃度沙門菌DNA為模板進行擴增檢測qPCR體系的靈敏度,檢測結果顯示,在每管25 μL qPCR反應體系中沙門菌DNA濃度為0.1~1×104pg/μL時均出現明顯的熒光擴增曲線,3個平行樣品間擴增曲線重復性好且Ct值均<35,而當沙門菌DNA濃度0.01 pg/μL時雖然也出現熒光擴增曲線,但3個平行樣品間擴增曲線重復性較差且Ct值均>35(見圖3)。因此,qPCR反應體系的檢測靈敏度為0.1 pg/μL的沙門菌DNA。
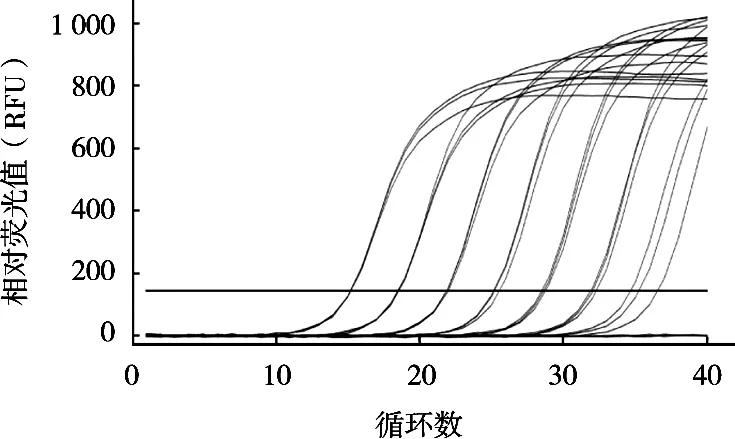
圖3 qPCR方法檢測沙門菌的靈敏度
2.4 標準曲線結果
將6個10倍梯度稀釋的定量標準品在優化的沙門菌qPCR反應體系和條件下進行擴增,建立不同沙門菌濃度對數值與Ct值之間對應關系的定量標準曲線。結果顯示,所制作的標準曲線在2~2×105CFU/g濃度之間的Ct值相差均勻,符合qPCR的Ct值與起始濃度對數值之間的線性關系(圖4)。分別以Ct值為縱坐標,沙門菌濃度對數值為橫坐標,得出起始濃度對數值與Ct值的線性方程:Y=-3.427 1X+32.08,斜率-3.427 1,截距32.08,相關系數R2為0.998(圖5)。在對樣品進行檢測時,根據其Ct值和線性方程可以計算該樣品沙門菌濃度。
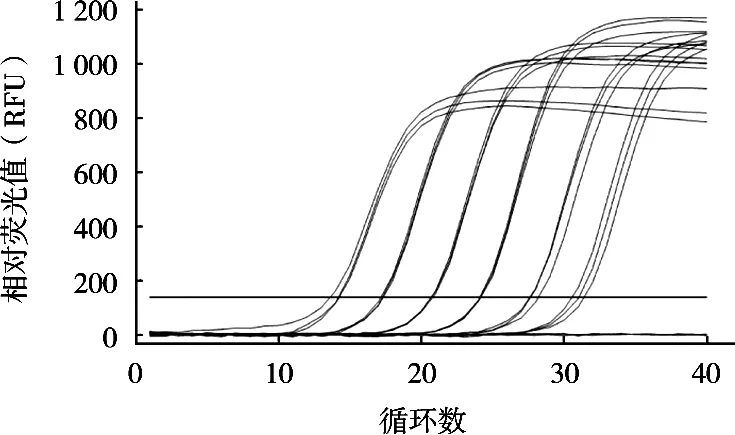
圖4 不同濃度沙門菌qPCR擴增曲線
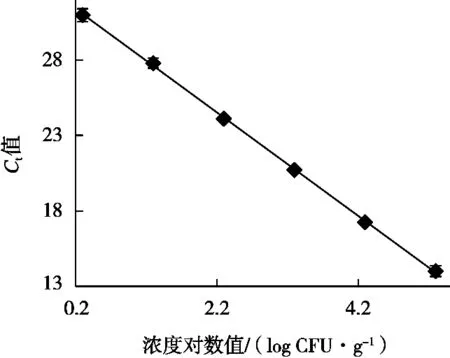
圖5 沙門菌qPCR標準曲線
2.5 蔬菜栽培土壤中沙門菌污染對比檢測結果
分別采用qPCR方法和GB 4789.4—2016方法對采自全省的35份栽培土壤樣品中沙門菌污染情況進行分析,結果如表3所示。35份栽培土壤樣品檢測結果均顯示為沙門菌污染陰性樣品,2種方法檢測結果一致,但qPCR方法在保證準確性的前提下,將檢測時間縮短至6 h內,縮短了GB 4789.4—2016方法的檢測時間,降低了檢測強度,同時提高了檢測效率,為大量栽培土壤樣品中開展沙門菌污染檢測提供可能。

表3 2種方法對比檢測蔬菜栽培土壤沙門菌污染結果 單位:份
3 結論與討論
蔬菜產地環境安全是防控蔬菜沙門菌污染的前提,而檢測技術則是防控沙門菌污染的有力武器。采用GB 4789.4—2016《食品安全國家標準 食品微生物學檢驗 沙門氏菌檢驗》,由于檢測時間長難以滿足大規模檢測需求且檢測結果僅為定性分析,普通PCR方法雖然解決GB 4789.4—2016方法檢測時間長的短板,但也不具備定量分析的能力。利用qPCR方法則兼具檢測時長短和通量大的優點,更彌補GB 4789.4—2016方法和普通PCR方法不能定量檢測的不足。qPCR方法包括探針法和嵌合熒光法,探針法由于探針引物設計要求高、合成費用貴等原因,導致探針法使用成本較高,而嵌合熒光法則可以使用普通PCR引物再輔以熒光染料如SYBR Green I,相對在引物設計上要求簡單和使用成本上低廉,在qPCR中得到越來越多應用。
沙門菌侵襲蛋白基因是一類與沙門菌吸附和侵襲腸道上皮細胞相關的基因,包括invA~invE等多個基因,其中對invA基因的研究和應用最為廣泛,以invA基因為靶基因的沙門菌qPCR方法在蛋糕、乳品、烤肉、新鮮農產品、雞蛋和牛肉淋巴等中得到成功應用[21-23]。試驗根據沙門invA基因序列設計特異性qPCR引物,建立一種基于SYBR Green I嵌合熒光法的蔬菜栽培土壤中沙門菌實時熒光定量檢測方法,對沙門菌DNA的檢測靈敏度可達0.1 pg/μL,所制作的qPCR擴增標準曲線在2~2×105CFU/g濃度之間有較好的線性關系,可滿足對沙門菌進行準確的定量分析要求,且qPCR方法與GB 4789.4—2016方法具有相同的準確性,可應用于蔬菜栽培土壤中沙門菌的定量檢測分析,對于有效防控蔬菜沙門菌污染風險保障蔬菜質量安全具有重要意義。

