超聲引導下經(jīng)皮射頻消融術與腹腔鏡肝切除術治療小肝癌的對比研究
張建平,汪志偉,方宏才
(九江學院附屬醫(yī)院肝膽外科,江西 九江 332000)
肝癌的發(fā)病率呈逐年上升趨勢,惡性程度高,治愈率低,在癌癥相關性死亡中居第三位[1]。小肝癌是早期肝癌的主要形式,亞太肝病研究協(xié)會指南將單發(fā)腫瘤直徑≤3 cm定義為小肝癌,是肝癌中預后較好的類型[2]。近年來小肝癌的治療逐漸趨向于微創(chuàng)化,其中較常見的為射頻消融術和腹腔鏡肝切除術。本研究分析九江學院附屬醫(yī)院2014—2016年收治的96例小肝癌患者的臨床資料,比較超聲引導下經(jīng)皮射頻消融術與腹腔鏡手術的治療效果,旨在發(fā)現(xiàn)更有利于患者的肝臟腫瘤微創(chuàng)治療方法。
1 資料與方法
1.1 一般資料
九江學院附屬醫(yī)院2014—2016年96例小肝癌患者,根據(jù)治療方式不同分成射頻組46例和腹腔鏡組50例。射頻組46例,男40例,女6例;年齡47~68歲,平均(56.3±4.5)歲;Child-Pugh分級A級36例、B級10例;合并微血管侵犯(MVI)13例。腹腔鏡組50例,男43例,女7例;年齡45~69歲,平均(57.4±5.4)歲;Child-Pugh分級A級38例、B級12例;合并MVI 15例。2組患者的一般情況比較差異無統(tǒng)計學意義(P>0.05),具有可比性。
納入標準:1)首次確診病例;2)腫瘤直徑≤3 cm;3)腫瘤數(shù)目小于3個;4)無鄰近病灶及遠處轉(zhuǎn)移;5)肝功能Child-Pugh A—B級;6)無放化療史。
1.2 治療方法
射頻組采用超聲引導下經(jīng)皮射頻消融術治療。患者平臥位,腹壁局部麻醉,超聲引導下將射頻針置入腫瘤中心,消融范圍包括腫瘤周圍1~2 cm正常肝組織,有時需要多點疊加消融,術中超聲造影,發(fā)現(xiàn)殘余腫瘤需補充消融,確保腫瘤消融完全。
腹腔鏡組采用腹腔鏡手術治療。患者取平臥位,全身麻醉,臍下切口建立氣腹,置入腹腔鏡探查,與上腹部建立3~4個操作孔,置入相關操作器械。根據(jù)術中情況確定是否行第一肝門阻斷。根據(jù)腫瘤部位、肝硬化程度等情況行解剖性肝切除或局部切除術(切緣距腫瘤2~5 cm)。
1.3 觀察指標
比較2組患者術中及術后一般情況,包括手術時間、術中出血量(RFA術中出血量根據(jù)穿刺針中帶血量,紗布塊沾血量來估測)、住院費用、住院時間;觀察2組術后并發(fā)癥發(fā)生情況;記錄2組患者術前及術后1個月肝功能(AST、ALT)和甲胎蛋白(AFP)的變化。
通過電話隨訪的方式了解2組患者1、2、3年無瘤生存、總生存情況;以患者復發(fā)(包括原位復發(fā)及遠處轉(zhuǎn)移)為無瘤生存的終點,以患者死亡為總生存的終點。并比較2組合并MVI患者的生存情況。
1.4 統(tǒng)計學方法
應用SPSS22.0軟件進行統(tǒng)計分析。計量資料比較采用t檢驗,計數(shù)資料比較采用χ2檢驗;生存分析采用Kaplan-Meier法,比較采用log-rank檢驗。以P<0.05為差異有統(tǒng)計學意義
2 結(jié)果
2.1 2組患者術中及術后一般情況比較
射頻組患者術中出血量、手術時間、術后住院時間、住院費用均少于腹腔鏡組(P<0.05)。見表1。

表1 2組患者術中及術后一般情況比較
2.2 2組患者術后并發(fā)癥比較
射頻組并發(fā)癥的發(fā)生率為10.87%(5/46),低于腹腔鏡組的28.00%(14/50)(χ2=4.429,P=0.035)。見表2。

表2 2組患者術后并發(fā)癥比較 例
2.3 2組患者術后肝功能及AFP水平的比較
2組患者術前ALT、AST和AFP水平比較差異無統(tǒng)計學意義(P>0.05),術后1個月2組ALT、AST和AFP水平均較術前下降,且射頻組ALT、AST和AFP水平低于腹腔鏡組(均P<0.05)。見表3。

表3 2組患者肝功能及AFP水平的比較
2.4 2組患者無瘤生存率及總生存率的比較
2組患者1、2、3年的無瘤生存率及總生存率比較差異無統(tǒng)計學意義(P>0.05);2組患者3年總生存時間、無瘤生存時間比較差異無統(tǒng)計學意義(P>0.05)。見表4、圖1—2。

總生存時間/月

無瘤生存時間/月

表4 2組患者無瘤生存率及總生存率的比較 n(%)
2.5 合并MVI肝癌患者3年總生存率比較
合并MVI的肝癌患者腹腔鏡組生存時間明顯長于射頻組(P<0.05)。見表5。
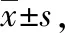
表5 2組合并MVI肝癌患者總生存時間比較月
3 討論
肝移植是治療肝癌的重要的手段,其術后1年生存率達90%,5年生存率也可達80%[3]。但由于受肝源的限制,肝切除術成為目前治療小肝癌的主要手段,因其對腫瘤的大小、數(shù)目、部位等無特殊要求,適用范圍較廣。但開腹肝切除術損傷大,術后并發(fā)癥及死亡的發(fā)生率較高。對于部分能夠耐受手術的患者,如想同時兼顧病灶切除的徹底性及微創(chuàng)性,可選擇行腹腔鏡肝切除術。隨著腹腔鏡操作技術的提高及器械的不斷更新,腹腔鏡手術的適應證不斷擴大。
對比開腹肝切除術,腹腔鏡肝切除術創(chuàng)傷小,對肝功能影響小,術后并發(fā)癥少,但術后3年生存率與開放式相當,具有較高的治療價值[4]。隨著對微創(chuàng)理念及精準治療的不斷認識,近年來小肝癌射頻消融術也逐漸受到了關注。射頻消融術是利用影像學技術,經(jīng)皮將射頻針插入腫瘤組織,發(fā)出高頻射頻波,產(chǎn)生熱量,殺傷腫瘤細胞,從而達到治療腫瘤的目的;對于不適宜外科手術或處于早期階段的腫瘤,射頻消融術已成為一種重要的替代療法[5]。射頻消融術的實質(zhì)是保留腫瘤病灶的消融損毀術,而腹腔鏡手術是將病灶完整切除的手術。因此對于兩種手術的療效意見并不一致。有研究[6-7]發(fā)現(xiàn)射頻消融術后并發(fā)癥的發(fā)生率低于腹腔鏡手術(3.75%比20.00%),但2組根治率,復發(fā)率,1、2、3年生存率比較差異無統(tǒng)計學意義。但也有研究[8-9]認為腹腔鏡肝切除術在治療早期肝癌患者中具有更好的長期生存率,且不增加并發(fā)癥的發(fā)生率。本研究射頻組的并發(fā)癥發(fā)生率為10.87%,低于腹腔鏡組的28.00%;2組1、2、3年無瘤生存率,1、2、3年總生存率比較差異無統(tǒng)計學意義。可見射頻消融術在控制并發(fā)癥的發(fā)生率上有一定的優(yōu)勢,且更加微創(chuàng)。在肝功能的影響方面,有研究[10]發(fā)現(xiàn)射頻組術后1個月ALT、AST水平低于腹腔鏡組,與本研究結(jié)果一致;射頻組采用局部麻醉的方式相比較于腹腔鏡組對患者心肺及肝功能的損傷更低。本研究射頻組術中出血、手術時間、住院時間、住院費用均低于腹腔鏡組,這與PAN等[11]的研究結(jié)果相似。另外本研究結(jié)果顯示射頻組術后AFP水平明顯降低,且低于腹腔鏡組。綜上,本研究發(fā)現(xiàn)射頻組與腹腔鏡組近遠期療效相當,但射頻組在圍手術期、肝功能恢復等方面具有明顯優(yōu)勢,且射頻組更加微創(chuàng)。
MVI是一個病理學概念,指內(nèi)皮細胞襯覆的血管腔內(nèi)有癌細胞巢團,癌細胞巢團>50個。是肝癌術后復發(fā)和生存的獨立危險因素[12]。本研究中發(fā)現(xiàn)射頻組有13例患者合并MVI,腹腔鏡組15例患者合并MVI。合并MVI的肝癌患者,腹腔鏡組生存時間明顯長于射頻組。說明合并MVI的腫瘤行腹腔鏡肝切除術效果更好。
雖然在小肝癌的治療方法中,腹腔鏡手術與射頻消融術同為微創(chuàng)治療方法,但許多研究[13-15]都發(fā)現(xiàn)射頻消融術具有創(chuàng)傷小,并發(fā)癥低,操作簡單,熱療效率高,原位滅活腫瘤徹底等優(yōu)勢。此外利用射頻消融的可重復性,可治療肝功能較差患者。也有文獻[16]報道射頻消融術對于特殊部位腫瘤也有良好效果。由此可見射頻消融術的療效并不受腫瘤部位的影響。隨著射頻消融技術的不斷發(fā)展,在未來有取代手術切除的趨勢[17]。

