二氧化碳捕集技術發展現狀
姜 鑫, 金文龍, 鐵 宇
(北京市燃氣集團研究院, 北京 100011)
1 概述
2019年,全球人類活動排放的二氧化碳為390×108t,其中,中國排放量為100×108t左右。在世界范圍內,化石能源消費相關二氧化碳排放量在全部排放量中的比例從1990年的70%上升至2020年的75%左右[1]。根據預測,到2030年之前,全球依然將以化石燃料為主要能源[2-3]。為有效控制溫室氣體特別是二氧化碳的排放,需要開展二氧化碳捕集工作。根據吸收材料不同,二氧化碳捕集技術分為固體吸附法、化學吸收法、膜分離法等。
2 固體吸附法
固體吸附法是利用CO2分子與吸附劑表面形成范德華力,或者與吸附劑中的極性離子形成作用力達到吸附分離的目的。固體吸附法工作溫度范圍較寬(最高可達700 ℃),CO2吸附量較大,脫附方便,吸附劑材料穩定性較高,一般不產生揮發或者有毒物質[4]。吸附劑選擇一般從以下幾個方面考慮:二氧化碳吸附量大、吸附-脫附速率快、可以重復利用、對待吸附氣體中含有的其他雜質要求低、可吸附CO2體積分數范圍寬、價格低廉等。常見的固體吸附材料有碳類吸附材料、沸石、金屬類吸附材料等。
2.1 碳類吸附材料
碳類吸附材料一般由碳和其他物質構成,該類吸附材料主要通過物理吸附的方式,將CO2吸附分離,常見的碳類吸附材料有活性炭、碳納米管、碳分子篩和石墨烯等。不同類型的碳類吸附材料在實驗室條件下的吸附能力見表1。
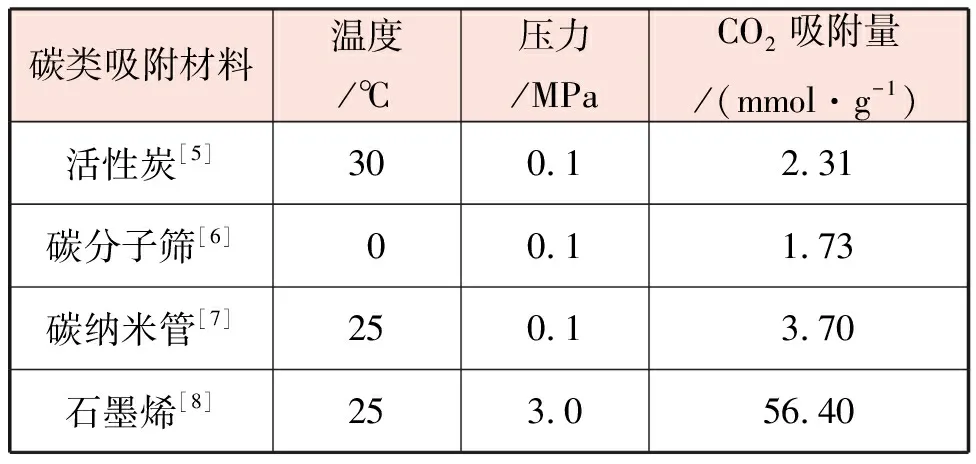
表1 不同類型的碳類吸附材料在實驗室條件下的吸附能力
碳類吸附材料加工方便,材料成本較低,但是主要靠范德華力完成吸附過程,所以受溫度影響較大,當溫度高于60 ℃時,吸附能力明顯減弱。
2.2 沸石
沸石是一類具有骨架結構的微孔材料,一般為帶結晶水的堿金屬或堿土金屬的硅鋁酸鹽。CO2通過這種材料微孔的時候,會與堿金屬陽離子之間產生強靜電作用,從而發生吸附作用。不同沸石對二氧化碳吸收能力對比見表2。
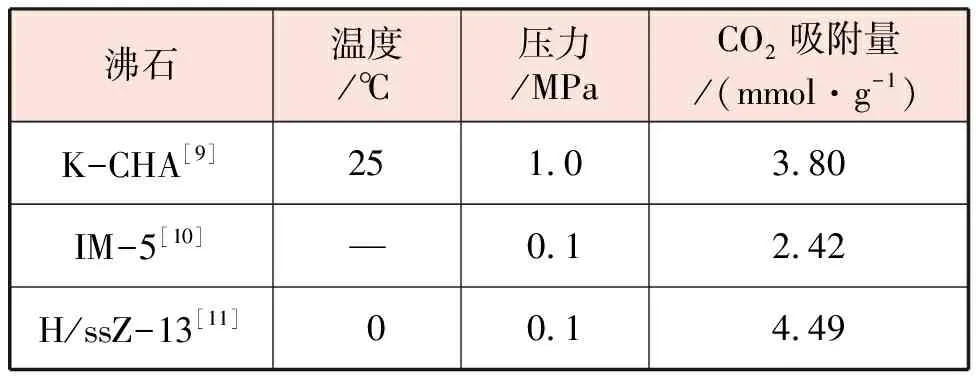
表2 不同沸石對二氧化碳吸收能力對比
盡管沸石對CO2有較好的吸附和脫附能力,但是沸石的脫附溫度一般高于300 ℃[12],而且若CO2中有水,沸石會優先吸附水分子,將造成微孔堵塞,從而大大影響CO2的吸附效果[13]。
2.3 金屬類吸附材料
金屬類吸附材料利用金屬類材料的堿性與酸性CO2發生作用,達到吸附的目的。根據材料不同,分為金屬有機骨架材料、金屬氧化物及其鹽類等。
金屬有機骨架材料是一種多孔材料,具有晶體結構、很高的比表面積和孔隙度。Vo等人[14]以鐵等為原料制備的金屬有機骨架材料的比表面積為200 m2/g,在25 ℃、101 kPa的條件下,實驗室測試該材料對CO2的吸附量為3.10 mmol/g。Kang等人[15]制備的氧化鋯金屬有機骨架材料比表面積為2 320 m2/g,在24.8 ℃、101 kPa的條件下,CO2吸附量為1.06 mmol/g。金屬有機骨架材料對CO2分壓要求較高,材料制備過程復雜,成本較高。
具有CO2吸附功能的金屬氧化物,一般為堿金屬或堿土金屬類的氧化物,該類氧化物本身具有較強的堿性,可以與CO2發生化學反應,達到吸附的目的。Zhu等人[16]制備的K-LDOS金屬氧化物吸附材料,在400 ℃、0.1 MPa的條件下,CO2的吸附量為0.722 mmol/g。金屬氧化物及其鹽類對CO2的吸收能力較強,但是能耗較高,特別是CO2脫附過程,一般需要在400~800 ℃下進行,需要消耗大量的能量。
3 化學吸收法
化學吸收法主要利用吸收劑的化學活性與CO2發生化學反應,生成介穩化合物,然后改變外界條件如溫度、壓力等,使生成物分解并釋放CO2,達到捕集CO2的目的,解吸后的吸收劑可以再循環使用[17]。常用的化學吸收劑一般為堿性液體,如醇胺、氨水和鉀堿溶液等。
3.1 醇胺類
醇胺類是最常用的化學吸收劑,分為單乙醇胺(MEA),二乙醇胺(MDEA)和混合乙醇胺等。
MEA 吸收CO2是可逆反應,溫度在20~40 ℃時反應正向進行,為放熱反應。當溫度達到104 ℃時,反應則逆向進行,釋放出吸收的CO2,MEA溶液再生[18]。MEA相對其他醇胺類吸收劑吸收速率較快,但是由于產物穩定性較高,需要在較高的溫度下完成CO2的解吸,捕集過程能耗較高。此外,由于MEA本身的腐蝕性較強,對設備要求也比較高。
MDEA是一種叔胺,穩定性較高,不易發生降解,與CO2反應后生成氨基甲酸鹽,產物穩定性較差,在較低的溫度可以實現分解,因此,MDEA的再生溫度比較低。但是MDEA吸收速率緩慢,不利于CO2快速吸收。
由于單一組分的醇胺存在不同的缺陷,因此國內外學者也在研究混合類吸收劑,如Nwaoha等人[19]探究了以MEA為主體,添加哌嗪改善MEA溶液脫除CO2的性能,在313 K下,該混合溶液與5 kmol/m3的MEA溶液相比,吸收容量增加大約30%,而且解析速率也比單一MEA快。根據Khan等人[20]的研究,將哌嗪加入到MDEA溶液作為吸收劑吸收電廠煙氣中的CO2,實驗結果表明,混合吸收劑的吸收性能明顯增強,MDEA溶液吸收速率得以提升。Archane等人[21]在MDEA中加入聚乙二醇(PEG)作為CO2混合吸收劑,研究發現PEG的濃度增加會導致CO2的吸附量減少,但解吸能耗降低。
3.2 熱鉀堿法
熱鉀堿法是一種應用比較早的CO2吸收方法,其原理是在90~110 ℃并且加壓的條件下,高濃度的碳酸鉀水溶液與CO2發生反應,生成碳酸氫鉀,對碳酸氫鉀溶液降壓處理后,可以再生得到碳酸鉀,同時分離CO2。碳酸鉀濃度越高,CO2的吸收能力越強,吸收速率越快。三氧化二砷、硼酸或磷酸、呱嗦等可以提高吸收和解吸速率,其中效果最好的是三氧化二砷。三氧化二砷劇毒,對操作工況要求非常嚴格,目前已被取代。同時碳酸鉀溶液的腐蝕性較強,對設備的防腐要求較高。
3.3 氨法
氨法吸收CO2原理是利用氨的弱堿性,與CO2反應生成碳酸銨或者碳酸氫銨。氨法吸收CO2與MEA相比,能耗低,吸收速率快,而且腐蝕性較低。氨可以吸收煙氣中的二氧化硫和氮氧化合物,在吸收CO2的同時可以降低其他污染物的排放,但是這也為后續分離CO2和吸收劑再生帶來一定的麻煩。此外,氨的揮發性較高,也限制了其應用。
4 膜分離法
膜分離法是一種常見的氣體分離方式,其原理是利用混合氣體中各組分與膜接觸的物理化學性質的差異,從而使某一種組分最先從膜的一側轉移到膜的另一側。膜分離法脫除CO2具有能耗低、設備尺寸小、操作和維護簡單、兼容性強等優勢。但是膜分離CO2也會受到煙氣壓力、CO2濃度、煙氣中NOx等組分影響[22]。常見的膜有無機膜、有機膜和復合膜。
無機膜可以在高溫、高壓的條件下工作,具有機械強度大、熱穩定性好、化學性質穩定、容易再生、使用壽命長且能耐各種酸堿性介質等優點。同時,也有可塑性差、易破損、價格昂貴等缺點[23]。
有機聚合體膜單位體積的過濾面積較大,容易裝配,但是不能在較高的溫度(大于150 ℃)和腐蝕環境中使用[24]。常用的有機膜有聚酰亞胺膜、聚砜膜等。Maya等人[25]采用共聚的方法改性了一種含有環氧乙烯的聚酰亞胺,經200 ℃熱處理后,CO2的滲透速率增加了2.4倍,但是對N2的選擇性降低了10%。Barooah等人[26]在聚醚砜膜中加入聚乙烯醇和丙二醇等得到的膜材料,CO2滲透系數達到0.061 7×10-10cm3/(cm2·s·Pa),CO2/N2選擇性(2種氣體滲透系數的比值)是370。
復合膜可以綜合不同膜的優點,提高CO2的選擇性。連少翰等人[27]對不同復合膜的CO2分離性能進行了對比,見表3。
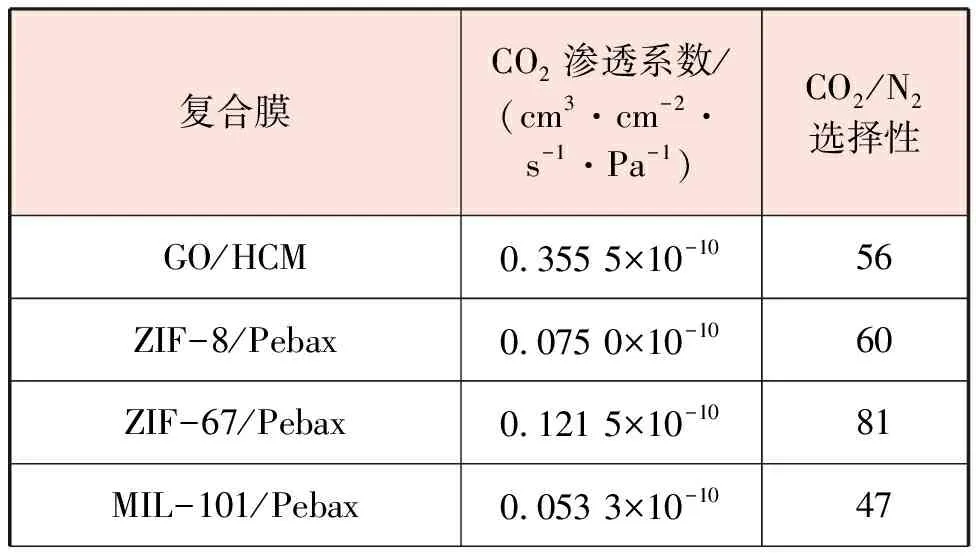
表3 不同復合膜的CO2分離性能對比
5 結語
對于固體吸附法,常規吸附劑吸附和脫附能力受溫度影響比較大,如沸石類吸收劑,脫附溫度高于300 ℃,能耗較高;對于堿金屬類吸附劑,脫附過程對溫度要求更高,能耗也更高。
化學吸收法可以在比較溫和的條件下完成二氧化碳的吸收與解吸,但是存在化學試劑的腐蝕和毒性等問題,因此對安全性要求比較高。同時化學吸收劑的揮發和回收也加大了對污水處理等環境保護方面的要求。
膜分離法的能耗較低,但是規模較小,大規模分離二氧化碳有一定的困難,同時膜材料成本也相對較高,這些都限制了膜材料的應用。
二氧化碳捕集技術研究主要目標是降低捕集成本。不論采用何種材料作為捕集媒介,材料本身的成本要足夠低,盡可能降低捕集、解吸、脫附過程的能耗。

