ω-3多不飽和脂肪酸強化的腸外營養對胰腺癌患者術后炎性介質及免疫功能的影響
許 嚴,麥 剛,2
(1.西南醫科大學,四川 瀘州 646000;2.德陽市人民醫院普外科,四川 德陽 618000)
胰腺癌(Pancreatic cancer,PCA)是消化道常見的惡性腫瘤疾病,素有“癌癥之王”的稱號[1]。據世衛組織統計,PCA發病率位居各類疾病發病率前列,且在各類腫瘤致死率中PCA位居第四位[2]。PCA前期臨床表現不明顯,而當患者出現明顯癥狀時,多已至中晚期[3]。胰十二指腸切除術(Pancreaticoduodenectomy,PD)是治療PCA重要方式,但其手術復雜,創傷大,手術需進行多次消化道重建,患者術后并發癥率高,而在腫瘤患者中,患者多存在營養不良情況,這會加重患者并發癥發生率及病死率,影響患者預后,因此,改善患者圍手術期營養狀態尤為重要。腸外營養支持對維持患者身體機能、創傷愈合有著重要意義,但臨床對于PD手術患者營養支持現狀并不理想,如術前營養狀態評估臨床不夠重視,圍手術期營養支持方案存在諸多爭議等,臨床還在探尋更為有效的營養支持方案[4]。ω-3多不飽和脂肪酸是人體必需但自身無法合成的必需脂肪酸,具有降血壓,降膽固醇等功效[5]。研究發現,將ω-3多不飽和脂肪酸用于腸外營養支持,可明顯改善手術患者炎癥反應及免疫狀態,其在心血管疾病、膽囊炎、多囊卵巢綜合征等臨床治療中發揮顯著效果[6-8]。基于此,探究ω-3多不飽和脂肪酸強化的腸外營養對PCA患者術后炎性介質及免疫功能的影響意義重大,具體報告如下。
1 資料與方法
1.1 一般資料 選取2020年1月至2022年11月接受胰十二指腸切除術的PCA患者80例進行研究。病例納入標準:①確診為胰腺癌[9],需接受開放性胰十二指腸切除術治療者;②符合手術指征;③預計生存期大于3個月;④臨床資料完整;⑤患者知情同意并自愿簽署知情書。排除標準:①術前兩周內服用過免疫類藥物;②無法耐受麻醉;③有潛在精神疾病;④存在其他惡性腫瘤疾病;⑤1年內有過手術治療。將納入的患者進行編號,經單雙號法隨機分為常規組(單號,n=40)和ω-3組(雙號,n=40),兩組患者基線資料比較差異無統計學意義(均P>0.05),具有可比性。見表1。

表1 兩組一般資料比較
1.2 治療方法 所有患者均給予開放性十二指腸切除術治療,所有患者均于術中行中心靜脈置管。兩組患者于術后第1 天開始給予營養支持治療,共進行7 d治療。第1天給予1/2供給量。第2天開始給予全量。常規組給予常規腸外營養治療,主要包括:熱量25 kcal/(kg·d)、氮攝入0.25 g/(kg·d)、氨基酸1.4 g/(kg·d)以及適量維生素、電解質、微量元素等。ω-3組在常規腸外營養治療基礎上添加ω-3魚油脂肪乳注射液(批號:16RG5161,50 ml:5g/瓶)治療,50 ml/d。
1.3 觀察指標 ①血常規指標:于術前、術后1 d、術后7 d、術后14 d抽取空腹患者靜脈血,采用WD-3000型全自動血分析儀對患者白細胞(WBC)、淋巴細胞百分率(LYMPH%)、中性粒細胞在白細胞中所占百分比(NEUT%)、紅細胞(RBC)進行檢測。②營養指標:于術前、術后1 d、術后7 d、術后14 d采集患者空腹靜脈血,使用全自動生化分析儀(G92000)檢測總蛋白(TP)、白蛋白(ALB)、前白蛋白(PALB)。③炎性介質:于術前、術后1 d、術后7 d、術后14 d,采用智能放射免疫測量儀(SN-695B)檢測兩組患者白細胞介素-6(IL-6)、白細胞介素-1(IL-1)、腫瘤壞死因子-α(TNF-α)。④免疫指標:于術前、術后1 d、術后7 d、術后14 d,取患者外周血,采用免疫比濁檢測儀(H790)測免疫球蛋白A(IgA)、免疫球蛋白G(IgG)。采用流式細胞儀(AccuriC6plus)檢測成熟T淋巴細胞(CD3+)、誘導性T細胞(CD4+)。⑤記錄兩組并發癥情況。⑥記錄住院時間及住院費用。
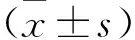
2 結 果
2.1 兩組患者血常規指標比較 術后,兩組患者WBC、NEUT、RBC均呈先增加后下降趨勢(均P<0.05),且ω-3組與常規組比較無統計學差異(P>0.05);兩組患者LYMPH呈先降低后增加趨勢(P<0.05),ω-3組與常規組比較無統計學差異(P>0.05)。見表2。
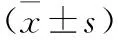
表2 兩組患者血常規指標比較
2.2 兩組患者治療前后營養水平比較 術后,兩組患者TP、ALB、PALB均呈先降低后增加趨勢(均P<0.05),且ω-3組大于常規組(P<0.05)。見表3。
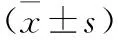
表3 兩組患者治療前后營養水平比較
2.3 兩組患者治療前后炎性介質水平比較 術后,兩組患者IL-6、IL-1、TNF-α均呈先降低后增加趨勢(均P<0.05),且ω-3組小于常規組(P<0.05),見表4。

表4 兩組患者治療前后炎性介質水平比較(pg/L)
2.4 兩組患者治療前后免疫功能水平比較 術后,兩組患者IgA、IgG、CD3+、CD4+均呈先降低后增加趨勢(均P<0.05),且ω-3組大于常規組(P<0.05),見表5。
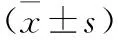
表5 兩組患者治療前后免疫功能水平比較
2.5 兩組術后不良反應發生情況比較 兩組術后不良反應發生情況比較無統計學差異(均P>0.05),見表6。

表6 兩組術后不良反應發生情況比較[例(%)]
2.6 兩組社會經濟學指標比較 兩組患者總住院天數和術后住院天數比較無統計學差異(均P>0.05),ω-3組總住院費用顯著高于常規組(P<0.05)。見表7。
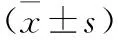
表7 兩組社會經濟學指標
3 討 論
由于早期病情隱匿、臨床特征不顯著,PCA往往預后較差,致死率較高,對于未發生轉移的PCA,手術治療仍然是目前最理想的根治方式。但因病灶解剖位置較深且游離難度較高,術中造成創傷較大,且術后無法直接經胃腸道補充能量,患者身體營養儲備面臨嚴重損耗,故通常表現為不同程度營養不良,因此采取有效措施補充患者營養損失對術后患者康復意義重大[10-11]。
胰腺是人體內參與蛋白質、脂肪和糖代謝的重要器官。當患有PCA時,人體胰液分泌可受到限制,消化功能也將受到影響,尤其根治術后患者機體受到損傷,蛋白質損耗嚴重,機體處于負氮平衡,適當補充營養有助于疾病康復[12]。本研究發現,術后,兩組患者TP、ALB、PALB均呈先降低后增加趨勢,且ω-3組大于常規組。提示給予患者ω-3多不飽和脂肪酸強化的腸外營養可改善PCA術后患者營養水平。究其原因,一方面ω-3多不飽和脂肪酸對人體營養物質吸收具有較大幫助,對于營養物質代謝與合成也有積極意義;另一方面ω-3多不飽和脂肪酸能在人體內氧化供能,促進T細胞增長,增強機體免疫力,從而有助于營養物質吸收[13]。
PCA根治術創傷較大,對患者神經內分泌調節可產生負面影響,加之營養損失嚴重會引起炎癥反應更甚,考慮控制炎癥因子表達有助于緩解疾病[14-15]。本研究顯示,術后,兩組患者IL-6、IL-1、TNF-α均呈先降低后增加趨勢,且在術后7 d和14 d ω-3組IL-6、IL-1、TNF-α水平顯著低于常規組。說明給予PCA術后患者ω-3多不飽和脂肪酸強化的腸外營養可調節炎癥介質。可能是ω-3多不飽和脂肪酸中的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)協同作用與花生四烯酸(AA)競爭相同代謝途徑,使炎癥反應中AA釋放和產物的合成減少,從而使促炎性因子釋放減少最終達到調節炎性介質的目的[16]。
PCA術后患者營養不良可導致機體免疫功能下降,嚴重威脅人體適應性與自我修復能力,而補充外源營養可改善患者免疫功能,利于患者術后康復[17]。本文研究發現,術后,兩組患者IgA、IgG、CD3+、CD4+均呈先降低后增加趨勢,且在術后7 d和14 d ω-3組IgA、IgG、CD3+、CD4+顯著高于常規組。說明給予PCA術后患者ω-3多不飽和脂肪酸強化的腸外營養可調節患者免疫功能。可能是由于ω-3多不飽和脂肪酸促進肝臟中脂肪酸氧化分解、減少體脂沉積、降低脂肪代謝紊亂等方式,提高患者抗原呈遞增性細胞活性進而激活機體免疫機制,使患者免疫系統改善[18]。
PCA根治術常見并發癥中,胰瘺、腹腔感染、肺部感染發生率最高,其中感染可能是由于延遲性胃排空導致的嘔吐和防止鼻腔管引起誤吸有關[19],而胰瘺主要與胰腺創傷、炎癥、胰腺手術導致的導管損傷[20],與術后腸外營養支持方式關聯性不大。本研究發現,術后兩組患者治療期間出現了延遲性胃排空、胰瘺、膽瘺、出血、腹腔感染、肺部感染、積液、血栓等并發癥,且兩組患者并發癥發生無統計學差異,且兩組患者總住院天數和術后住院天數無統計學差異,但ω-3組總住院費用顯著高于常規組。說明加用ω-3多不飽和脂肪酸不會引起并發癥發生風險,安全可靠,但會增加醫療費用和患者經濟負擔。因此,醫師可結合患者自身身體條件酌情考慮使用。
綜上所述,對胰腺癌患者術后給予ω-3多不飽和脂肪酸強化的腸外營養有助于患者機體恢復,可有效調節營養水平,改善炎性介質和免疫功能,但醫療成本更高,建議多方面綜合考量患者狀況后使用。

